创新药专题之新冠药物分析研究报告.docx
《创新药专题之新冠药物分析研究报告.docx》由会员分享,可在线阅读,更多相关《创新药专题之新冠药物分析研究报告.docx(18页珍藏版)》请在冰豆网上搜索。
创新药专题之新冠药物分析研究报告
创新药专题之新冠药物分析
1.新冠药物:
疫情长期化可能性下,药物治疗是最后一道防线
新冠肺炎疫情是近百年来影响范围最广的全球性流行疾病,自2019年末爆发至今已有一年多的时间,已给全球经济带来了严峻的考验。
然而,随着病毒变异株的不断出现,未来新冠肺炎疫情长期存在的可能性不断增大,这一背景下新冠药物的开发显得尤为重要,在病毒变异株不断出现的当下,新冠药物已成为疫苗防护之后新冠疫情防控的最后一道防线。
1.1.疫情出现反弹,未来新冠肺炎疫情长期化可能性不断增大
我们认为未来新冠肺炎疫情长期化的可能性不断增大,主要基于以下几方面因素:
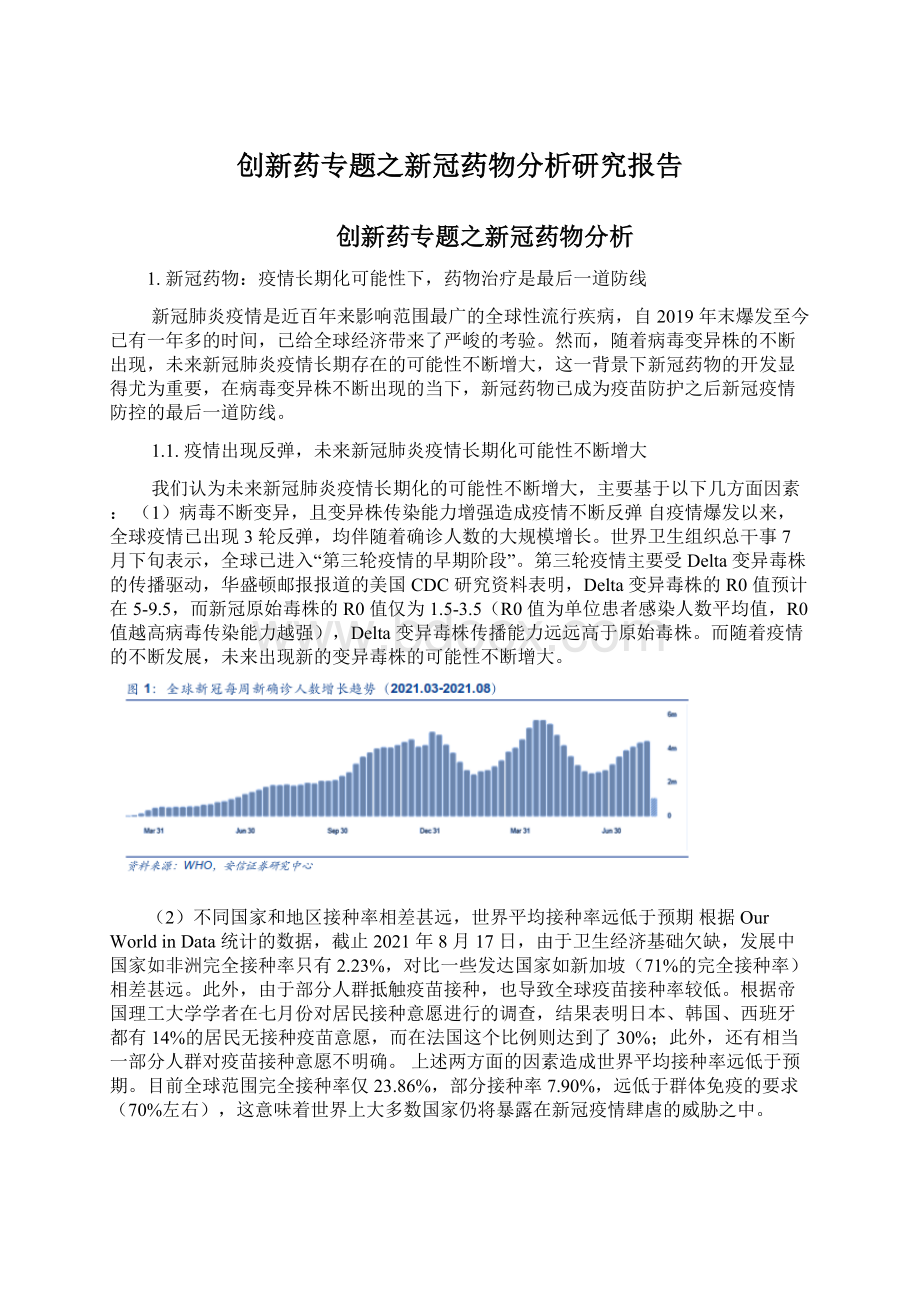
(1)病毒不断变异,且变异株传染能力增强造成疫情不断反弹自疫情爆发以来,全球疫情已出现3轮反弹,均伴随着确诊人数的大规模增长。
世界卫生组织总干事7月下旬表示,全球已进入“第三轮疫情的早期阶段”。
第三轮疫情主要受Delta变异毒株的传播驱动,华盛顿邮报报道的美国CDC研究资料表明,Delta变异毒株的R0值预计在5-9.5,而新冠原始毒株的R0值仅为1.5-3.5(R0值为单位患者感染人数平均值,R0值越高病毒传染能力越强),Delta变异毒株传播能力远远高于原始毒株。
而随着疫情的不断发展,未来出现新的变异毒株的可能性不断增大。
(2)不同国家和地区接种率相差甚远,世界平均接种率远低于预期根据OurWorldinData统计的数据,截止2021年8月17日,由于卫生经济基础欠缺,发展中国家如非洲完全接种率只有2.23%,对比一些发达国家如新加坡(71%的完全接种率)相差甚远。
此外,由于部分人群抵触疫苗接种,也导致全球疫苗接种率较低。
根据帝国理工大学学者在七月份对居民接种意愿进行的调查,结果表明日本、韩国、西班牙都有14%的居民无接种疫苗意愿,而在法国这个比例则达到了30%;此外,还有相当一部分人群对疫苗接种意愿不明确。
上述两方面的因素造成世界平均接种率远低于预期。
目前全球范围完全接种率仅23.86%,部分接种率7.90%,远低于群体免疫的要求(70%左右),这意味着世界上大多数国家仍将暴露在新冠疫情肆虐的威胁之中。
(3)病毒持续变异叠加时间推移,导致疫苗有效率下降疫苗毒株持续变异,由于Delta病毒拥有更强的传播性和抗性,部分海外疫苗的有效率有所下降。
根据以色列卫生部7月发布的一项报告表示,完成两剂辉瑞mRNA疫苗接种者在2021年1月至4月期间,疫苗的保护率高达95%;而在6月下旬至7月下旬期间,由于Delta变异株的传播,这一保护率下降到了39%。
美国CDC的研究也表明,应对突变病毒,疫苗能预防>90%的严重疾病症状及死亡威胁,但在预防感染或传播方面可能较差。
此外,疫苗保护作用也会随着时间的推移而逐渐减弱。
2021年8月19日,美国高级卫生官员们在一份联合声明中宣布,现有数据非常清楚地表明在接种初始疫苗后,疫苗对SARS-CoV-2感染的保护作用会随着时间的推移而降低,叠加Delta变体病毒传播迅猛,疫苗对轻、中症疾病保护作用有所降低。
此外,目前疫苗对重症、住院和死亡的保护也可能会在未来几个月内减弱。
1.2.新冠药物是疫情防控最后一条防线,伴随疫情反复全球开发热情不减
相比疫苗防护,新冠药物治疗是一个及时有效、能快速发挥抗病毒能力的治疗手段,在新冠肺炎的防治中,新冠药物治疗可与疫苗预防形成有效补充,两者缺一不可。
在未来新冠疫情长期化的可能性下,新冠药物治疗是抵抗疫情的最后一道防线。
全球范围内,针对新冠药物的开发热度自疫情发生以来一直持续,目前已有多款不同类型的药物进入开发后期,如主要针对轻中症患者的新冠病毒中和抗体、主要针对重症患者的抗细胞因子受体/中和抗体、可针对轻中重症患者的小分子新冠药物(包括RNA聚合酶抑制剂、JAK抑制剂、AR拮抗剂、3CL蛋白酶抑制剂等)等。
其中,部分药物已经通过紧急使用授权(EUA)的方式上市用于新冠患者的治疗。
自2020年5月瑞德西韦获得首个新冠治疗药物紧急使用授权(EUA)上市以来,目前已有6款药物或组合疗法获得FDA紧急授权使用。
包括小分子新冠药物瑞德西韦、巴瑞替尼,新冠中和抗体Casirivimab和Imdevimab联合疗法、Bamlanivimab和Etesevimab联合疗法、Sotrovimab,抗细胞因子受体抗体托珠单抗。
2.中和抗体:
主要针对轻中症患者
中和抗体(Neutralizingantibody)是一种用于防止细胞被某种抗原或感染原侵害而具有保护力的抗体。
在新冠肺炎感染发病进程中,SARS-CoV-2可利用表面刺突蛋白(Spike蛋白)的受体结合域(RBD)特异性识别并结合宿主细胞上的血管紧张素转化酶2受体(ACE2受体),进入呼吸道上皮细胞。
患者被感染后,其免疫系统将通过产生中和抗体来抗击病毒,这些中和抗体可通过结合RBD的表位阻断并抑制病毒结合ACE2受体,以达到中和病毒毒力、缓解疾病症状、降低感染者死亡率的效果。
由于人体在暴露于SARS-CoV-2感染后,自身免疫系统可能需要几天或几星期才能产生治疗性的中和抗体,因此通过自身产生的中和抗体抑制新冠肺炎进程难以实现理想的治疗效果。
在这一背景下,国内外多家企业研发了新冠病毒中和抗体,其可实现大规模生产,通过直接向患者输注以起到更快的治疗效果。
目前,全球范围内已有3款中和抗体或组合疗法处已获FDA紧急使用授权,包括再生元的Casirivimab/Imdevimab联合疗法、礼来/君实生物合作开发的Bamlanivimab/Etesevimab联合疗法、葛兰素史克(GSK)/VirBiotechnology合作开发的Sotrovimab。
在国内企业中,目前除了君实生物与礼来合作开发的Bamlanivimab/Etesevimab联合疗法获FDA紧急使用授权外;腾盛博药的BRII-196/BRII-198联合疗法的ACTIV-2三期临床研究已在美国、巴西、南非、墨西哥及阿根廷的研究中心完成846位受试者的入组工作;其他国内企业开发的中和抗体,如绿叶制药的LY–CovMab、济民可信的JMB2002、复宏汉霖的HLX70尚在早期临床阶段。
2.1.Casirivimab/Imdevimab联合疗法:
再生元—中和抗体
厂商:
再生元剂型:
注射剂机制:
中和抗体最高开发阶段&适应症:
紧急使用授权(EUA)上市。
(1)2020年11月获批用于治疗成人和儿童(12岁及以上,体重至少40kg)轻中症,且有高风险发展为重症/住院的新冠患者;
(2)2021年7月获批用于有高风险进展为严重COVID-19的人群的暴露后预防治疗。
销售金额:
Casirivimab/Imdevimab于2020年11月获得FDA紧急使用授权(EUA)上市,2020年Q4实现销售收入1.5亿美元,到2021年Q1实现销售收入4.4亿美元,2021年Q2剧增,实现销售收入30.6亿美元。
临床数据:
在针对非住院患者的3期R10933-10987-COV-2067临床试验中,在主要研究终点≥1次COVID-19住院或全因死亡的受试者比例方面,Casirivimab600mg+Imdevimab600mgIV组736例受试者中有7例(1.0%)患者报告了COVID-19住院或全因死亡的主要结局,安慰剂组748例受试者中有24例(3.2%)患者(P=0.0024),相比较下接受Casirivimab600mg+Imdevimab600mg的患者住院或死亡绝对减少2.2%,相对减少70%。
上述结果与接受Casirivimab1,200mg+Imdevimab1,200mgIV输注治疗时的结果相当。
接受Casirivimab1,200mg+Imdevimab1,200mgIV的1,355例患者中有18例(1.3%)报告了COVID-19住院或全因死亡的主要结局,接受安慰剂的1,341例患者中有62例(4.6%)患者(P<0.0001),相对安慰剂组,患者住院或死亡绝对减少3.3%,相对减少71%。
在针对有高风险进展为严重COVID-19的人群的暴露后预防的COV-2069研究中,在主要研究终点至第29天确诊的COVID-19的患者比例方面,在主要分析人群(基线时RT-qPCR阴性和血清阴性)中,与安慰剂组相比,Casirivimab+Imdevimab治疗组发生COVID-19的风险降低81%[11/753(1%)和59/752(8%);p<0.0001]。
2.2.Bamlanivimab/Etesevimab联合疗法:
礼来/君实生物—中和抗体
厂商:
礼来/君实生物剂型:
注射剂机制:
中和抗体最高开发阶段&适应症:
紧急使用授权(EUA)上市。
2021年2月获批,用于治疗成人和儿童(12岁及以上,体重至少40kg)轻中症,且有高风险发展为重症/住院的新冠患者。
由于美国卫生部门认为该疗法可能对Gamma(P.1)和Beta(B.1.351)变异株中和能力有限,2021年6月25日起FDA暂停分发。
销售金额:
Bamlanivimab/Etesevimab于2021年2月获得FDA紧急使用授权(EUA)上市,2021年Q1实现销售收入8.1亿美元,受FDA停止分发影响,到2021年Q2实现销售收入1.5亿美元。
临床数据:
针对非住院轻中症新冠患者的3期临床试验中,在主要研究终点COVID-19相关住院或全因死亡的受试者比例方面,Bamlanivimab+Etesevimab组的518名受试者中有11例(2.1%)报告了COVID-19住院或全因死亡结局,安慰剂组517名受试者中有36例(7%)患者(P<0.001),相比较下,接受Bamlanivimab+Etesevimab治疗的患者住院或死亡绝对减少4.8%,相对减少70%。
重新获得FDA分发的可能性:
2021年6月25日起,由于美国CDC认为Bamlanivimab/Etesevimab疗法可能对Gamma(P.1)和Beta(B.1.351)变异株中和能力有限,且上述突变当时在美国的总比例已超过11%并呈上升趋势,因此FDA暂停了分发Bamlanivimab/Etesevimab。
但过去数月内美国各地区SARS-CoV-2各突变类型所占比例变化较快,根据美国CDC的统计的数据,2021年8月8日至8月14日间,美国Gamma(P.1)和Beta(B.1.351)变异株总比例仅有0.2%;而占比最大的突变为Delta(B.1.617.2),占比86.1%;第二大突变为Delta(AY.3),占比12.3%。
根据2021年8月刊登在国际权威学术期刊《CELL》的论文《ReducedneutralizationofSARS-CoV-2B.1.617byvaccineandconvalescentserum》,在对由Vir开发的S309,再生元开发的REGN10987、REGN10933,阿斯利康开发的AZD7442(AZD1061和AZD8895联合疗法),Adagio开发的ADG10、ADG20和ADG30,礼来开发的LY-CoV555和LY-CoV16等中和抗体进行了针对B.1.617.1和B.1.617.2的体外中和试验后,发现LY-CoV555(即Bamlanivimab,由礼来开发)完全不能中和B.1.617.1,同时针对B.1.617.2的中和严重减弱,而LY-CoV16(即Etesevimab,JS016,由君实生物开发)则保持了对B.1.617.1和B.1.617.2的中和能力。
在当前美国国内以Delta(B.1.617.2)突变占据绝大多数的背景下,考虑到Etesevimab对B.1.617.2保持较强的中和能力,未来其单药或组合疗法存在在美国恢复使用的可能性。
2.3.Sotrovimab:
GSK/VirBiotechnology—中和抗体
厂商:
葛兰素史克(GSK)/VirBiotechnology剂型:
注射剂机制:
中和抗体最高开发阶段&适应症:
紧急使用授权(EUA)上市。
2021年5月获批用于治疗成人和儿童(12岁及以上,体重至少40kg)轻中症,且有高风险发展为重症/住院的新冠患者。
临床数据:
针对轻中症、非住院新冠患者的3期临床试验中,在主要研究终点全因住院/死亡的受试者比例方面,Sotrovimab组的291名受试者中有3例(1%)报告了全因住院或死亡结局,安慰剂组292名受试者中有21例(7%)患者(P=0.002),相比较下接受Sotrovimab治疗的患者全因住院/死亡绝对减少6%,相对减少85%。
2.4.BRII-196/BRII-198联合疗法:
腾盛博药—中和抗体
厂商:
腾盛博药剂型:
注射剂机制:
中和抗体最高开发阶段&适应症:
3期ACTIV-2临床试验(已完成入组),用于治疗有症状的COVID-19门诊患者。
BRII-196/BRII-198联合疗法的临床试验是ACTIV-23期临床研究的一部分,由美国国立卫生研究院(NIH)下属的美国国家过敏和传染病研究所(NIAID)资助,主要目的是评估中和抗体组与安慰剂组中,受试者在接受治疗后28天内住院和死亡的主要复合终点。
目前,BRII-196/BRII-198联合疗法的ACTIV-23期研究已在美国、巴西、南非、墨西哥和阿根廷的研究中心完成846位受试者的入组工作。
临床前&临床数据:
BRII-196及BRII-198可非竞争性地识别SARS-CoV-2病毒刺突蛋白RBD中独特的表位,减少在抗体治疗过程中产生抗药性病毒的机会,而增加抗体与未来病毒变种结合的可能性。
BRII-196及BRII-198的可结晶片段区域(Fc段)均进行过修饰,具有较长的抗体半衰期。
目前据腾盛博药公告,BRII-196/BRII-198联合疗法的1期及2期临床试验数据显示了良好的安全性和耐受性。
目前的体外嵌合病毒实验数据表明,BRII-196/BRII-198联合疗法对主要SARS-CoV-2变异株(包括以下常见病毒变异株:
B.1.1.7(阿尔法)、B.1.351(贝塔)、P.1(伽马)、B.1.429(伊普西龙)及B.1.617.2(德尔塔))均保持中和活性。
关于ACTIV-3研究未到达主要研究终点:
ACTIV-3同样NIH资助发起的针对COVID-19住院患者的临床研究。
2021年3月,NIH宣布该研究中的两项疗法,包括腾盛博药BRII-196/BRII-198联合疗法、以及葛兰素史克(GSK)/VirBiotechnology的Sotrovimab预计不能达到主要研究终点,因此中止了上述两项疗法针对COVID-19住院患者的临床研究。
目前,VirBiotechnology的Sotrovimab已于2021年5月获批获批紧急使用授权(EUA)上市,用于治疗成人和儿童(12岁及以上,体重至少40kg)轻中症,且有高风险发展为重症/住院的新冠患者。
3.抗细胞因子中和/受体抗体:
主要针对重症患者
细胞因子是由免疫细胞及组织细胞分泌的,在细胞间发挥调控作用的一类小分子可溶性蛋白质,其主要包括干扰素(interferon,IFN)、白介素(interleukin,IL)、趋化因子、集落刺激因子(ColonyStimulatingFactor,CSF)、肿瘤坏死因子(tumornecrosisfactors,TNF)等。
细胞因子以自分泌、旁分泌或内分泌形式发挥作用,可通过结合相应受体调节细胞生长分化,调控免疫应答,参与炎症等多种疾病的发生、发展。
细胞因子风暴又称为细胞因子瀑布级联,或高细胞因子血症。
当机体免疫系统受到感染(细菌、病毒、真菌等)或非感染(药物、自身免疫性疾病等)因素的影响时,机体先后启动非特异性免疫应答与特异性免疫应答,体内多种免疫细胞如巨噬细胞、中性粒细胞、自然杀伤细胞、树突状细胞等可以释放多种细胞因子,如IL-1、IL-2、IL-6、IL-8、IL-10、IL-12、趋化因子、粒细胞集落刺激因子(G-CSF)、粒细胞巨噬细胞集落刺激因子(GM-CSF)、IFN-γ、TNF-α等。
这些细胞因子与中性粒细胞、巨噬细胞及多种免疫细胞之间通过特定的正反馈机制,使多种细胞因子及相关免疫细胞在组织、器官中异常增多、聚集,形成细胞因子风暴,最终导致单器官或多器官损伤甚至功能衰竭。
研究表明,SARS-CoV-2可诱发促炎细胞因子激增,即细胞因子风暴,从而引发严重的肺部炎症,乃至多器官衰竭危及患者生命。
因此直接针对重症患者炎症因子,解决患者细胞因子风暴是治疗重症新冠肺炎的有效手段之一,这一治疗过程主要通过抗细胞因子抗体或抗细胞因子受体抗体来实现目前,全球范围内已有多款针对新冠肺炎的抗细胞因子中和抗体或抗细胞因子受体抗体进入开发后期阶段,比较有代表性的有罗氏的托珠单抗以及天境生物的Plonmarlimab(又称为TJM2)。
3.1.托珠单抗:
罗氏—抗IL-6受体单抗
厂商:
罗氏剂型:
注射剂机制:
抗IL-6受体单抗,抑制IL-6与IL-6受体的结合。
最高开发阶段&适应症:
紧急使用授权(EUA)上市。
2021年6月获批,用于治疗正在接受系统性皮质类固醇激素治疗并需要辅助供氧、无创或有创机械通气或体外膜肺氧合(ECMO)的成人和儿童住院患者(2岁及以上)的COVID-19的治疗临床数据:
在一项针对住院重症新冠肺炎患者的3期临床试验(RECOVERY)中,在主要研究终点至第28天死亡时间方面,比较托珠单抗+常规治疗组与单独常规治疗组的风险比为0.85,具有统计学显著差异(p=0.0028)。
托珠单抗+常规治疗组和常规治疗组在第28天死亡的概率分别为30.7%和34.9%,风险差异为-4.1%;托珠单抗+常规治疗组中位出院时间为19天,常规治疗组为>28天;在基线时不需要有创机械通气的患者中,到第28天托珠单抗+常规治疗组需要机械通气或死亡的患者比例为35%(619/1754),常规治疗单药组为42%(754/1800)。
3.2.Plonmarlimab:
天境生物—抗GM-CSF中和抗体
厂商:
天境生物剂型:
注射剂机制:
抗GM-CSF中和抗体,Plonmarlimab能够高效中和GM-CSF,从炎症细胞因子网络通路的上游阻断免疫系统的过度激活,从而减轻新冠患者的肺部及其它器官损伤等严重并发症。
最高开发阶段&适应症:
2/3期临床试验,治疗重症新冠肺炎(COVID-19)伴发的细胞因子释放综合征(CRS)。
临床数据:
Plonmarlimab治疗重症新冠肺炎(COVID-19)患者的2/3期临床试验中,根据中期研究结果,其达到多项主要和次要研究终点。
数据表明,入组时未经机械通气治疗的91名患者中,相较于安慰剂组,plonmarlimab治疗组的30天无需使用机械通气的比例更高(83.6%vs76.7%),30天死亡率更低(4.9%vs13.3%),康复率更高(14天康复率68.9%vs56.7%;30天康复率80.3%vs70.0%),患者达到康复的时间和住院期更短,其疗效与同款抗体药物lenzilumab在相似患者人群中的临床结果相当。
此外,Plonmarlimab的生物标记物分析结果也进一步印证了其临床疗效。
与安慰剂相比,Plonmarlimab能够降低CRS相关的主要促炎细胞因子和趋化因子(包括TARC、IP10、GCSF、IL10、IL6、MCP1、IL1RA和TNFα)的血清水平,并未观察到与疾病加重相关的中性粒/淋巴细胞比值的升高。
研究数据还显示,Plonmarlimab在所有受试患者中均展现出了良好的安全性和耐受性。
4.小分子新冠药物:
多种不同机制,可针对轻中、重症患者
小分子药物相对大分子生物药有其独有的优势:
(1)小分子药物作用靶点可分布在细胞内或细胞外,而大分子生物药一般只能作用在细胞表面;
(2)大多数小分子药物可以口服给药,而正常情况下大分子生物药只能注射给药;(3)小分子药物制备工艺相对简单成熟,产量远远高于大分子生物药,成本也较大分子低;(4)小分子药物储存、运输环境条件要求较低,方便储存或运输;(5)部分小分子药物可通过血脑屏障而大分子生物药几乎不可能。
在全球疫情不断反复的如今,小分子新冠药物的开发具备积极的意义。
生产规模方面,小分子新冠药物制备工艺相对简单成熟,可快速实现大规模批量生产以满足疫情爆发导致的感染数量剧增的患者人群;成本方面,小分子新冠药物成本较低,可提升新冠肺炎患者用药可及性;用药便利性方面,小分子新冠药物大多为口服用药,患者依存性大大提升;储存运输方面,小分子新冠药物对环境要求较低,可实现快速大规模地分发。
目前,全球范围内共有6款小分子新冠药物处在开发后期阶段,其中国内1款,国外5款。
上述药物按其作用机制不同可分为4大类:
(1)RNA聚合酶抑制剂,包括吉利德科学的瑞德西韦、默沙东/RidgebackBiotherapeutics的MK-4482、罗氏/AteaPharmaceuticals的AT-527;
(2)JAK抑制剂,包括礼来/Incyte的巴瑞替尼;(3)AR拮抗剂,包括开拓药业的普克鲁胺;(4)3CL蛋白酶抑制剂,包括辉瑞的PF-07321332。
4.1.瑞德西韦:
吉利德科学—RNA聚合酶抑制剂
厂商:
吉利德科学剂型:
注射剂机制:
RNA聚合酶抑制剂,是一种核苷类似物前体,可在体内通过磷酸化后形成三磷酸腺苷类似物,该类似物被RNA聚合酶识别后参与病毒基因组的合成,引起病毒RNA空间构象的变化,阻止磷酸二酯键的形成致使链合成中止,即通过抑制RNA依赖性的RNA聚合酶活性从而发挥作用。
最高开发阶段&适应症:
FDA批准上市。
2020年10月,FDA正式批准瑞德西韦上市,用于治疗12岁及以上、体重至少40公斤的需要住院治疗的成人和儿童COVID-19。
此外,FDA还于2020年5月1日批注其EUA,用于治疗体重为3.5kg至<40kg的住院儿科患者或体重至少为3.5kg的12岁以下住院儿科患者中疑似或实验室确诊的COVID-19。
销售金额:
作为目前全球唯一一款正式获批上市用于治疗新冠肺炎的药物,瑞德西韦2020年H2实现销售收入28.11亿美元,2021年H1实现销售收入22.85亿美元,表现出市场对于新冠药物的强烈需求。