普通生物化学核酸酶学知识点.docx
《普通生物化学核酸酶学知识点.docx》由会员分享,可在线阅读,更多相关《普通生物化学核酸酶学知识点.docx(7页珍藏版)》请在冰豆网上搜索。
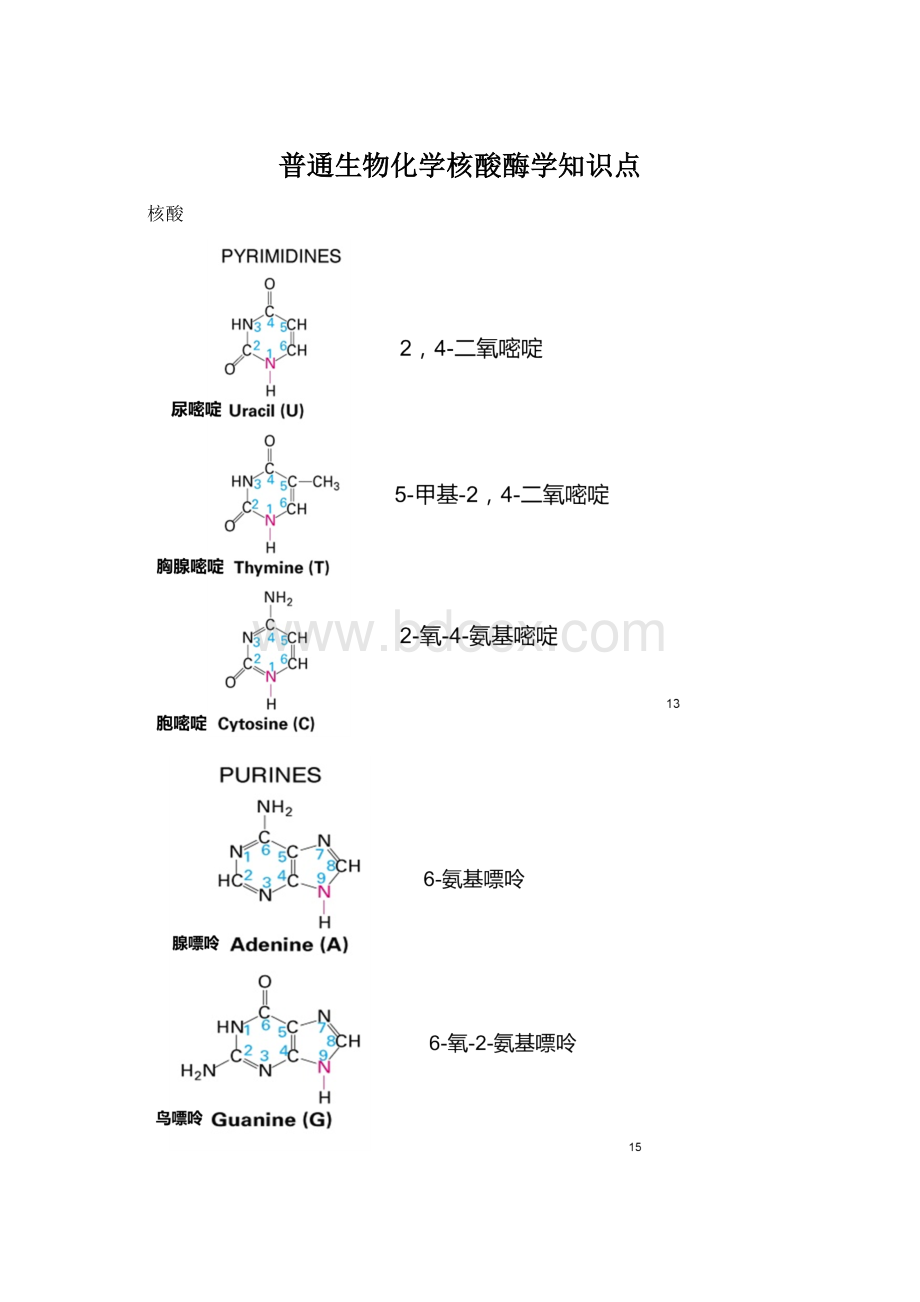
普通生物化学核酸酶学知识点
核酸
问答题:
1、某DNA样品含腺嘌呤15.1%(按摩尔碱基计),计算其余碱基的百分
含量。
2、DNA双螺旋结构是什么时候,1953,1962由谁提出来的?
试述其结构模型。
3、DNA双螺旋结构有些什么基本特点?
这些特点能解释哪些最重要的生命现象?
4、DNA和RNA的结构有何异同?
5、RNA干扰的意义?
1.是植物对抗某些病毒感染的机制;
2.使转座子沉默,维持基因组的稳定性;
3.抑制蛋白质合成,调控基因表达和个体生长发育;
4.提供了使特定基因沉默的重要实验手段;
5.为基因治疗提供了一条可能的途径.
6、miRNA和siRNA的异同点。
Pri-miRNAPre-miRNA细胞核miRNA细胞质dicer单链完全配对不完全配对
•它们都是Dicer酶的产物;
•它们在起干扰、调节作用时都会和RISC复合体结合;
•它们都可以在转录后和翻译水平干扰以抑制靶标基因的翻译;
名词解释:
1、核酸变性和复性;2、分子杂交;3、增色效应和减色效应;4、回文结构;5、Tm;6、Chargaff定律;7、surthern杂交技术;8、DNA指纹技术
1.在物理、化学因素影响下,DNA碱基对间的氢键断裂,双螺旋解开,这是一个是跃变过程,伴有A260增加(增色效应)。
复性:
在物理、化学因素影响下,DNA碱基对间的氢键断裂,双螺旋解开,这是一个是跃变过程,伴有A260增加(增色效应)。
2.不同来源的DNA单链间或单链DNA与RNA之间只要有碱基配对的区域,在复性时可形成局部双螺旋区,称核酸分子杂交(hybridization)
3.DNA变性复性过程中A260nm增加减少的过程。
4.回文结构DNA双链中正序反序碱基顺序相同的碱基对序列。
5.TmDNA热变性过程中A260达到最大值的一半时的温度。
6.C=GA=TA+G=C+TA+C=G+T
7.分析DNA样品中是否含有与探针序列同源的DNA片段
8.利用人体内小卫星DNA的高度多态性,将重复序列作为分子探针,与不同个体的基因组DNA的限制性酶切片段进行分子杂交,就会得出各自特有的杂交图谱,具有专一性和特征性,即DNA指纹。
酶学
问答题:
1.1、何谓酶?
酶促反应的特点是什么?
酶(enzyme)是由活细胞合成的、对其特异底物起高效催化作用的生物大分子,是机体内催化各种代谢反应最主要的催化剂。
易失活高催化效率专一性强反应活性可控
2、酶促反应高效率的机理是什么?
通过结合自由能降低反应的活化能,邻近效应定向效应
3、简述丝氨酸蛋白酶的催化机理?
丝氨酸羟基作为亲核基团进攻亲电中心,形成新的酯键,肽键断裂,形成的酰基-酶中间物被水解,酶还原。
4、什么是全酶、酶蛋白和辅助因子,在酶促反应中各起什么作用?
全酶=蛋白质+辅助因子酶蛋白是缀合酶的蛋白质部分,辅助因子是缀合酶的非蛋白质部分,小分子有机化合物金属离子
5、酶分为哪几大类,分别催化何反应?
氧化还原酶氧化还原反应
转移酶催化基团转移反应谷丙转氨酶
水解酶催化底物的加水分解反应
裂合酶从底物分子中移去原子或基团形成双键及其逆反应
异构酶催化同分异构体的相互转化
合成酶催化C-C等键的形成与ATP分解反应相互偶联
6、构成酶活性中心的常见必需基团有哪些?
结合基团催化基团
丝氨酸残基的羟基组氨酸残基的咪唑基半胱氨酸残基的巯基酸性氨基酸残基的羧基
7、酶的催化活性在体内有哪些调控方式?
浓度水平的调节活性水平的调节酶与底物的不同定位真核
8、抗体酶的生产步骤?
反应过渡态类似物为半抗原制作单克隆抗体,筛选出具有高催化活性的单抗即为抗体酶。
名词解释:
1.酶的特异性;
酶对它所催化的反应及其底物具有的严格的选择性。
通常一种酶只能催化一种或一类化学反应。
2、酶的活性中心;
必需基团在空间上彼此靠近形成具有一定结构的空间区域,该区域与底物结合并将底物转化为产物,这一区域称为酶的活性中心。
3、缀合酶;
缀合酶(conjugatedenzyme)是除了在其组成中含有由氨基酸组成的蛋白质部分外,还含有非蛋白质部分。
4、诱导契合假说;
当酶分子与底物接近时诱导酶分子构象发生变化以利于与底物的结合,形成复合物后,促进底物发生化学反应。
5活化能;
在一定温度下1摩尔底物全部进入活化态所需的自由能(kJ/mol)。
6、辅酶与辅基;缀合酶中非蛋白质部分,辅助因子,结合紧密程度,辅基辅酶。
7、酸碱催化;
瞬时向反应物提供质子;或向反应物接受质子;以稳定过渡态,加速反应的一类催化机制。
8.共价催化;
亲核亲电子催化酶亲核催化剂释放电子与底物缺电子中心形成不稳定的共价中间复合物,降低反应活化能
9、抗体酶
具有催化能力的免疫球蛋白。
5.11
问答题:
1、叙述Km值、Kcat值及Kcat/Km的意义。
KM=(k-1+k2)/k1,米氏常数,最大反应速度一半时对应的底物浓度
[S]足够大时,Vmax=k2[E]t;
K2表示当酶被底物饱和时,每秒钟每个酶分子转换底物的分子数,又称为转化常数(turnovernumber,TN),通称为Kcat,是一级反应常数。
Kcat越大,催化效率越高!
V=kcat[Et][S]/(KM+[S])
当S远小于km时,
V=(kcat/KM)[Et][S]
表观二级速率常数(专一性常数):
(kcat/KM)=k2k1/(k-1+K2)
2、何谓可逆性抑制作用,说明其特点?
Reversibleinhibition:
抑制剂和酶之间以noncovalent(非共价)键结合,可以通过透析、超滤等物理方法除去抑制剂而使酶的活性恢复;
3、简述磺胺类药物的作用机理及意义。
对苯磺酰-L赖氨酰氯甲酮(TLCK)是胰蛋白酶的底物对甲苯磺酰-L-赖氨酰甲酯(TLME)的结构类似物,TLCK可以和胰蛋白酶活性部位必需集团His57共价结合,从而引起酶不可逆失活。
4、简述四膜虫pre-tRNA发生自我剪接的过程。
一、鸟苷的3’-OH攻击内含子的5’剪接点,并与Intron的5’-端磷酸基形成共价键连接,同时5’外显子脱落下来,但3’外显子此时仍与Intron相连。
二、5’-端外显子的3’-OH进攻内含子的3’剪接点并使414nt的内含子脱落,同时5’外显子与3’外显子连接成成熟rRNA。
名词解释:
1、基元反应;2、初速度 ;3、Km值;4、Kcat值;5、核酶;6、抑制剂;7、可逆性抑制;8、不可逆性抑制;9、竞争性抑制;10、非竞争性抑制;11、反竞争性抑制;12、Kcat型抑制剂
•反应物分子在碰撞中一步转化为生成物分子的反应称为基元反应(Elementaryreaction)。
•初速度,即底物的消耗量很小(一般在5﹪以内)时的反应速度。
•KM=(k-1+k2)/k1,米氏常数,最大反应速度一半时对应的底物浓度
•K2表示当酶被底物饱和时,每秒钟每个酶分子转换底物的分子数,又称为转化常数(turnovernumber,TN),通称为Kcat。
•化学本质为核酸的酶称为核酶,具有催化功能的RNA。
•Inhibition(抑制):
酶未变性,由于活性中心的必需基团化学性质改变而引起酶活力的降低或丧失,引起抑制作用的物质称为抑制剂(Inhibitor);
•Reversibleinhibition:
抑制剂和酶之间以noncovalent(非共价)键结合,可以通过透析、超滤等物理方法除去抑制剂而使酶的活性恢复;
•Irreversibleinhibition:
抑制剂与酶的某些必需基团以covalent(共价)键结合,彻底导致酶活性的丧失。
不能通过物理方法除去抑制剂使酶复活。
•抑制剂和酶的底物结合部位作用;抑制剂和底物竞争结合酶;抑制剂往往是底物类似物;可以通过提高底物的浓度解除抑制剂的抑制作用。
加入竞争性抑制剂后,Vmax不变,Km值变大,Km值随着[I]的增加而增大。
•抑制剂分子可以结合到酶的非底物结合位点上;其结构和底物的结构没有任何共同之处;这种抑制作用不可以用增加底物的浓度解除,所以称为非竞争性抑制。
抑制剂的结合改变酶的构象,从而降低酶的催化活性。
加入非竞争性抑制剂后,Km不变,Vmax值变小,Vmax值随着[I]的增加而变小。
•抑制剂仅在底物和酶形成中间产物(ES)后与ES结合,使ES的量下降。
这样,既减少从ES转化为产物的量,也同时减少从ES解离出游离酶和底物的量。
Vmax,Km降低同样倍数
•结构类似于天然底物S,本身也是E的S,E与它结合,并对它进行催化反应时,暴露其潜伏的反应基团并活化,作用于酶活性部位的必需基团(或酶的辅基),酶不可逆失活。
5.18
问答题:
1、请举例说明酶原激活的过程和意义。
酶原的激活:
由无活性的酶原转变为有活性的酶的过程。
酶原激活的意义:
在特定的环境和条件下发挥作用;避免细胞自身消化;如胰腺中合成的酶trypsin,chymotrypsin,elastase,andcarboxypeptidase都是以酶原的形式存在。
2、请列举分子生物学中常用的工具酶以及它们的用途。
(1)限制性核酸内切酶:
识别并特异切割DNA碱基序列;
(2)TaqDNA聚合酶:
DNA体外扩增(PCR);(3)逆转录酶:
催化合成cDNA;(4)T4DNA连接酶:
应用于黏性或平末端DNA的连接;(5)碱性磷酸酶:
防止载体自身连接、32P标记5′端;(6)T4多核苷酸激酶:
5′端磷酸化、5′端标记放射性核素;(7)S1核酸酶:
确定RNA起始转录位点(8)末端脱氧核苷酸转移酶:
给载体或cDNA加上互补的同聚尾、加标记物。
名词解释:
1、别构调节;2、同促别构;3、异促别构;4、协同指数;5、K0.5;6、同功酶;7、酶的共价修饰;8、K型效应物;9、V型效应物;
(正负协同效应)
1、别构调节:
酶分子的非催化部位与某些化合物可逆地非共价结合后发生构象的改变,进而改变酶活性状态。
天冬氨酸转氨甲酰酶
2、同促别构---底物分子本身对别构酶的调节作用,表现为底物与酶结合的协同性;
3、异促别构---非底物分子对别构酶的调节作用。
4、n协同系数
5、K0.5---指的是别构酶催化反应达到最大反应速率一半时的底物浓度。
(和非别构酶相区别)
6、催化相同生化反应----相同的工作;
各组织或亚细胞组分中分布的不同以及它们之间底物的特异性和动力学的差别;
蛋白质分子结构、理化性质、免疫性能等方面有明显差异。
7、酶的共价修饰:
通过连接修饰基团活化或钝化酶,修饰基团有phosphorylation(磷酸化),adenylylation(腺苷酰化),uridylylation(脲苷酰化),methylation(甲基化),anddenosinediphosphateribosylgroups(ADP-核糖基化)
8、K型效应物:
K0.5isalteredwithoutachangeinVmax
9、V型效应物:
Vmaxisaltered,K0.5isnearlyconstant.