全国大联考宁夏新课标Ⅱ宁夏银川市届高三高中教学质量检测理科综合化学试题解析版.docx
《全国大联考宁夏新课标Ⅱ宁夏银川市届高三高中教学质量检测理科综合化学试题解析版.docx》由会员分享,可在线阅读,更多相关《全国大联考宁夏新课标Ⅱ宁夏银川市届高三高中教学质量检测理科综合化学试题解析版.docx(17页珍藏版)》请在冰豆网上搜索。
全国大联考宁夏新课标Ⅱ宁夏银川市届高三高中教学质量检测理科综合化学试题解析版
宁夏银川市2018届高三4月高中教学质量检测
理科综合化学试题
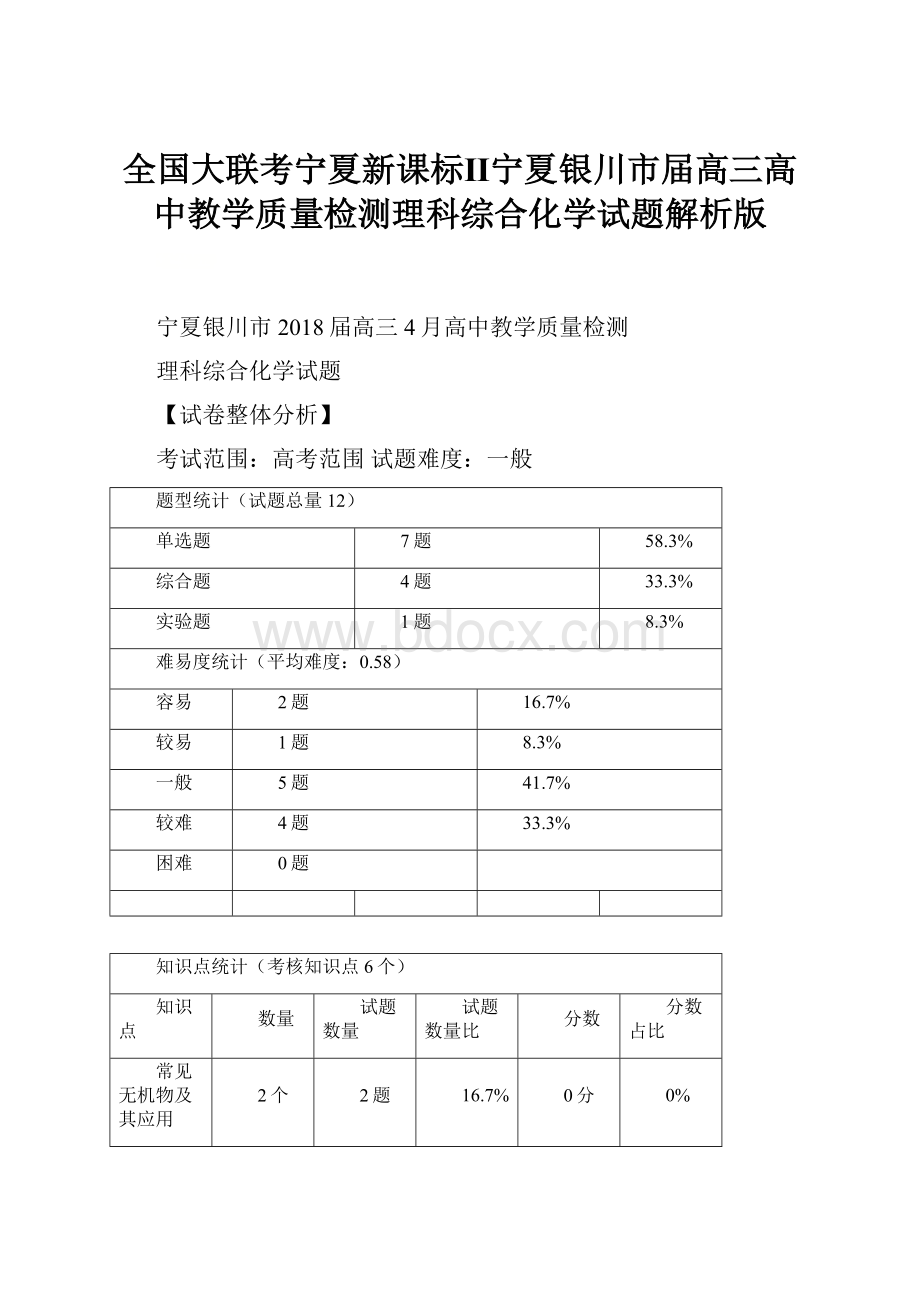
【试卷整体分析】
考试范围:
高考范围试题难度:
一般
题型统计(试题总量12)
单选题
7题
58.3%
综合题
4题
33.3%
实验题
1题
8.3%
难易度统计(平均难度:
0.58)
容易
2题
16.7%
较易
1题
8.3%
一般
5题
41.7%
较难
4题
33.3%
困难
0题
知识点统计(考核知识点6个)
知识点
数量
试题数量
试题数量比
分数
分数占比
常见无机物及其应用
2个
2题
16.7%
0分
0%
认识化学科学
1个
1题
8.3%
0分
0%
有机化学基础
2个
2题
16.7%
0分
0%
化学反应原理
4个
4题
33.3%
0分
0%
物质结构与性质
2个
2题
16.7%
0分
0%
化学实验基础
1个
1题
8.3%
0分
0%
【题型考点分析】
题号
题型
知识点
1
单选题
根据原子结构进行元素种类推断
2
综合题
物质结构与性质综合考查
3
单选题
Fe3+与其他物质氧化性强弱关系
4
单选题
乙烯
5
综合题
有机物的合成
6
实验题
常见无机物的制备
7
综合题
溶度积常数相关计算
8
综合题
化学反应原理综合考查
9
单选题
氢氧化铁化学性质
10
单选题
酸碱混合时的定性判断及计算
11
单选题
原电池电极反应式书写
12
单选题
阿伏加德罗常数的求算
第I卷(选择题)
1.下列说法错误的是
A.生活中大力推广使用一次性塑料袋和纸巾
B.用可溶性的铝盐和铁盐处理水中的悬浮物
C.维生素C具有还原性,可用作食品抗氧化剂
D.将SO2添加于红酒中可以起到杀菌和抗氧化作用
【答案】A
【解析】A.一次性塑料袋为难以降解的高分子化合物,会破坏环境,纸巾是由木材生产的,不应该大力提倡,故A错误。
B.铝盐和铁盐溶解后,溶液中的Al3+、Fe3+水解分别生成Al(OH)3胶体、Fe(OH)3胶体,吸附水中的悬浮物,故B项正确。
C.维生素C是一种经常用于食品抗氧化剂的还原剂,故C正确。
D、少量的二氧化硫加入到葡萄酒中可以起到杀菌、保鲜、抗氧化的作用,故D正确。
点睛:
本题从生活中的化学入手,考察了学生在日常学习中对化学知识的积累,考察了学生平时的化学素养。
2.阿伏加德罗常数的值为NA。
下列说法正确的是
A.4.6g乙醇分子中含极性键数目为0.6NA
B.标准状况下,2.24LSO3含分子数为0.1NA
C.Na2S和Na2O2固体混合物7.8g中,含有的阴离子数为0.1NA
D.0.2molNO和0.1molO2于密闭容器中充分反应后,其分子数为0.2NA
【答案】C
【解析】A.4.6g的乙醇物质的量为0.1mol,乙醇的结构简式为CH3CH2OH,一个分子中含有7个极性共价键,极性键的总数应为0.7mol,故A错误;B.标况下标况下,三氧化硫不是气体,故B错误;C.Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;7.8g的.Na2S和Na2O2的混合物物质的量为0.1mol,含有的阴离子数0.1NA,C选项正确;D反应中还存在:
2NO2⇌N2O4反应,其分子数小于0.2NA,故D错误。
点睛:
本题通过考察阿伏加德罗常数。
C项要注意Na2O2的结构,D项要注意隐含反应:
2NO2⇌N2O4。
3.下列说法正确的是
A.乙酸与乙酸乙酯互为同分异构体B.乙烷室温下能与溴水发生取代反应
C.医用消毒酒精中乙醇的浓度为9.5%D.乙烯可以用作生产食品包装材料的原料
【答案】D
点睛:
本题有机化学的基本常识,包括同分异构现象、取代反应的条件、生活中的化学常识,平时要多注重基础知识的学习。
注意乙烷与卤素发生取代反应的条件是光照并且是纯净的卤素单质。
4.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图,该电池在使用中石墨I电极上生成氧化物Y,下列说法错误的是
A.Y的化学式可能为NO
B.石墨I极为负极,石墨Ⅱ极为正极
C.该电池放电时NO3-从右侧向左侧迁移
D.石墨I附近发生的反应为NO2+NO3ˉ-eˉ=N2O5
【答案】A
【解析】解:
A.石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,所以石墨I为原电池的负极,发生失电子的氧化反应,NO2失电子不可能得到NO,所以A选项错误;B.石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,所以石墨I为负极,故B正确;C.原电池工作时,阴离子向负极移动,所以C选项是正确的;D.负极的电极反应应该为NO2+NO3ˉ-eˉ=N2O5,所以D选项是正确的。
点睛:
以NO2、O2、熔融NaNO3组成的燃料电池,在使用过程中石墨I电极为原电池的负极,NO2被氧化,N元素混合升高,应生成N2O5,电极方程式为NO2+NO3ˉ-eˉ=N2O5,石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4eˉ=4NO3-以此解答该题.
5.a、b、c、d为原子序数依次增大的短周期主族元素,a与b同族,a元素的一种同位素原子核内无中子;c原子最外层电子数是内层电子数的1/5;b、d同周期且d在该周期原子半径最小。
下列叙述正确的是
A.a分别与b、d形成化合物类型相同B.4种元素中b的金属性最强
C.d的氧化物的水化物一定是强酸D.工业上c单质常用电解熔融氧化物制备
【答案】B
6.通过实验、观察类比、推理等方法得出正确的结论是化学学习的方法之一。
对下列反应的现象和解释都正确的是
选项
操作
可能的实验现象
解释
A
品红溶液中通入某无色气体
溶液褪色
该气体一定是SO2
B
将CO2通入Ba(NO3)2溶液中
有白色沉淀生成
CO2与Ba(NO3)2反应生成BaCO3
C
向淀粉-KI溶液中通入少量Cl2
溶液变蓝
Cl2与淀粉发生显色反应
D
向FeCl2溶液中滴入用硫酸酸化的H2O2溶液
溶液变黄
发生氧化还原反应,且氧化性:
H2O2>Fe3+
【答案】D
【解析】A.能使品红溶液褪色的无色气体除了SO2之外还可以是臭氧气体,故A错误;B.二氧化碳和硝酸钡不反应,故B错误;C.氯气和碘化钾反应生成碘单质,遇到淀粉显蓝色,不是氯气和淀粉反应,故C错误;D.亚铁离子在酸性条件与过氧化氢反应生成铁离子,溶液变黄,故D正确。
7.常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。
稀释过程中,两溶液pH的变化如下图所示。
下列叙述正确的是
A.MOH为弱碱,HA为强酸
B.水的电离程度:
X=Z>Y
C.若升高温度,Y、Z点对应溶液的pH均不变
D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性
【答案】B
【解析】A.纵坐标为物质的量的倍数取对数,HA从pH=4到pH=5稀释了100倍,所以HA为弱酸,MOH的pH从10到9稀释了10倍,所以MOH为强碱,故A错误;B.水的电离度受溶液中酸电离出的H+浓度或者碱电离出的OH-浓度影响,X点pH=5时,c(H+)水=10-14/10-5=10-9mol/L,Z点c(H+)水=10-9mol/L,Y点c(H+)水=10-10mol/L,所以水的电离度X=Z>Y,故B正确;C.升温水的离子积会增大,溶液的pH值会发生变化,故C错误;D.HA为弱酸,MOH为强碱,X点和Z点相比,HA的溶液浓度大于MOH,所以等体积混合后溶液应该呈酸性,故D错误。
点睛:
本题通过图像的分析,考察了弱酸在稀释过程中电离程度的变化,同时考察了水的离子积,对学生知识的迁移运用有较高的要求。
第II卷(非选择题)
8.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子
Fe3+
Mg2+
Al3+
Cr3+
沉淀完全时的pH
3.7
11.1
5.4(>8溶解)
9(>9溶解)
(1)酸浸时,为了提高浸取率可采取的措施有_________________(写出两条)。
(2)过滤操作时所用玻璃仪器除烧杯外,还需要________________。
(3)H2O2的作用是将滤液I中的Cr3+转化为C2O72-,该反应的离子方程式为:
____________________。
(4)加入NaOH溶液调节溶液pH=8,既可以使溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为________(填微粒的化学式),当溶液的pH>8时,沉淀的主要成份为________(填化学式)。
(5)钠离子交换树脂的反应原理为:
Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________________,交换后溶液中浓度明显增大的离子为________________。
【答案】升高温度、适当增大硫酸浓度、搅拌等漏斗、玻璃棒2Cr3++3H2O2+H2O=Cr2O72−+8H+CrO42−Fe(OH)3Ca2+、Mg2+Na+
点睛:
本题以污水处理为背景,考查离子方程式、化学方程式的书写、物质的分离、利用溶液的PH值对溶液中的离子进行分离等知识点,考查考生的综合运用能力。
9.氢能是一种高效清洁、极具发展潜力的能源。
利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知下列反应:
(1)反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如图所示。
则△H1________△H2(填“>”、“<”或“=”);△H3=________(用△H1、△H2表示)。
(2)向2L密闭容器中充入H2和CO2共6mol,改变氢碳比[n(H2)/n(CO2)]在不同温度下发生反应III达到平衡状态,测得的实验数据如下表。
分析表中数据回答下列问题:
①温度升高,K值________(填“增大”、“减小”、或“不变”)。
②提高氢碳比,K值________(填“增大”“减小”或“不变”),对生成乙醇________(填“有利”或“不利”)
③在700K、氢碳比为1.5,若5min反应达到平衡状态,则0~5min用H2表示的速率为________。
(3)反应III在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
①阴极的电极反应式为________________。
②从电解后溶液中分离出乙醇的操作方法为________________。
(4)在一定条件下发生反应Ⅳ,测得不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,下列有关说法正确的为________(填序号)
①不同条件下反应,N点的速率最大
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率
【答案】>-(2△H2+△H1)减小不变有利0.144mol·L-1·min-114CO2+12e-+9H2O=CH3CH2OH+12HCO3-蒸馏②
10.[化学——选修3:
物质结构与性质]科学家成功合成了新型抗肿瘤铂(Ⅳ)类化合物Pt(HPxSC)Cl3,请回答下列问题:
(1)基态磷原子价电子排布图为__________________。
(2)在元素周期表中,铂元素与铁元素同族,则铂元素位于_________。
A.s区B.p区C.d区D.ds区E.f区
(3)磷、硫、氯的第一电离能由小到大的顺序为__________________(填化学式)。
(4)与S同族的相邻元素氢化物沸点最高的为_________(填化学式),其原因为_________。
(5)Pt2+还能与吡啶(
)、Clˉ结合形成二氯二吡啶合铂(Ⅱ)。
①吡啶分子中,氮原子的轨道杂化方式为__________________。
②二氯二吡啶合铂(Ⅱ)分子中存在的微粒间作用力有_________(填序号)。
A.离子键B.配位键C.金属键D.非极性键e.氢键
(6)铂(Pt)单质晶体中原子的堆积方式如图所示,由图可知,晶体铂的堆积方式为_________,一个晶胞中含有_________个铂原子,距离每个铂原子最近且等距离的铂原子有_________个。
【答案】
CS【解析】
(1)磷元素为15号元素,最外层为5个电子,故价电子排布图为
。
(2)铁的价电子排布为3d64s2,位于d区,故铂也位于D区。
(3)根据元素周期律,S、P、Cl三种元素在同一周期,但是P的最外层处于半充满状态,故按照S(4)同族的相邻元素氢化物沸点最高的是H2O,因为H2O中可以形成分子间氢键,造成H2O的沸点最高。
(5)①通过结构可知吡啶中的N的与两个C以σ键相连同时还有一个大π键,剩余一对孤电子对,所以N原子是sp2杂化。
②二氯二吡啶合铂(Ⅱ)分子中,中心离子是铂(Ⅱ),配体是氯和吡啶,所以有配位键和非极性键,故选bd。
学……科网
(6)由图像可知,为面心立方(最)密堆积,每个面心各有一个原子,八个顶点各有一个,6×1/2+8×1/8=4,所以一个晶胞有4个铂原子,密置型堆积配位数为12。
11.[化学——选修5:
有机化学基础]4-羟基水杨酰苯胺俗名柳胺酚,是一种利胆药,其结构简式如下:
某课题组以简单烃为主要原料,采用以下路线合成柳胺酚。
回答下列问题:
已知:
(1)A的化学名称为_________;柳胺酚的分子式为__________________。
(2)D的结构简式为_________;G中含有官能团的结构简式为__________________。
(3)由A生成B的反应类型为__________________。
(4)G和F反应的化学方程式为___________________________。
(5)H是G的同分异构体,可与FeCl3溶液发生显色反应,也能发生银镜反应,符合条件的H共有_________种。
(6)参照上述路线,以B和乙酸为原料合成
,请设计合成路线流程图(无机试剂及溶剂任选)_________________。
示例如下:
【答案】乙炔C13H11NO3
-COOH、-OH加成反应
9
【解析】
(1)A为简单烃并且相对分子质量为26,由此可推断为乙炔,由柳胺酚的结构式可以推出分子式是C13H11NO3。
(2)B为苯,苯在FeBr3做催化剂的条件下可以和Br2反应生成溴苯,故C为溴苯,溴苯C进一步发上硝化反应生成对硝基溴苯,所以D的结构式是
,由柳胺酚的结构简式可逆推出G中的官能团为-COOH、-OH。
12.三氯化硼(BCl3)是一种重要的化工原料,可用于制取乙硎烷(B2H6),也可做有机合成的催化剂。
某兴趣小组选用下列装置制备BCl3。
查阅资料:
①BCl3的沸点为12.5℃,熔点为-107.3℃,易水解;
②2B+6HCl
2BCl3+3H2
请回答下列问题:
(1)装置A中盛浓盐酸的仪器名称为_________;装置A中发生反应的离子方程为___________。
(2)按气流方向连接各装置的接口,顺序为a→___→___→___→___→b→c→f→g→h,连接好装置后的第一步实验操作为_________。
(3)装置C中盛放的试剂为_________,实验中若不用装置C,可能产生的危险为_________。
(4)装置E的作用为__________________。
(5)常温下,KSP[Mn(OH)2]=1.0×10-13,向制取Cl2后的残余液中加入氢氧化钠溶液至Mn2+沉淀完全[c(Mn2+)≤1.0×10-5mol·L-1]溶液的PH最小为_________。
【答案】分液漏斗MnO2+4H++2Cl-
Mn2++Cl2↑+2H2Oedjk检查装置的气密性饱和NaCl溶液Cl2和H2加热发生爆炸防止空气中的水蒸气进入U形管使产物发生水解;吸收多余Cl2,防止污染空气10