届高考化学考前训练原理综合大题.docx
《届高考化学考前训练原理综合大题.docx》由会员分享,可在线阅读,更多相关《届高考化学考前训练原理综合大题.docx(63页珍藏版)》请在冰豆网上搜索。
届高考化学考前训练原理综合大题
原理综合大题【原卷】
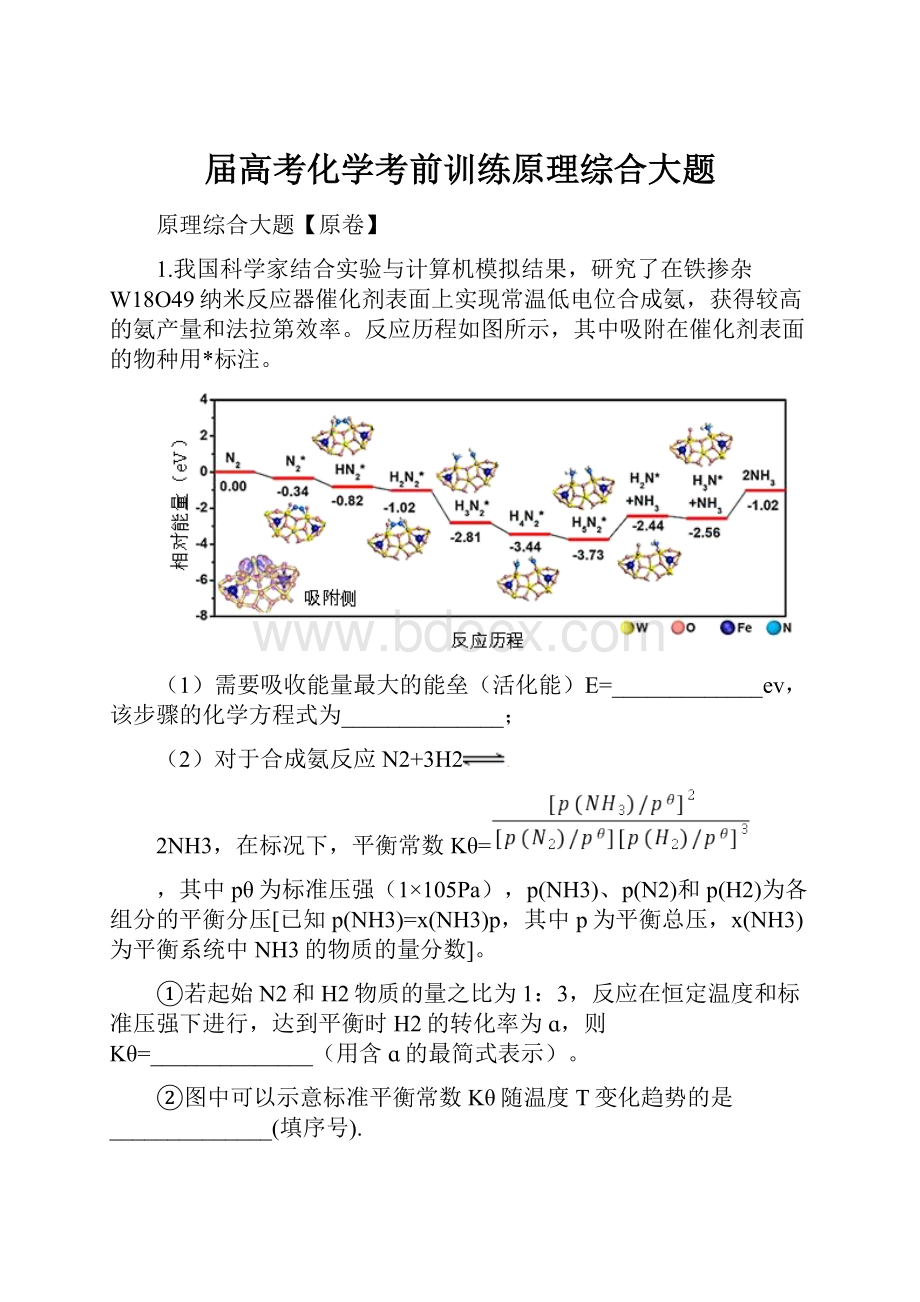
1.我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18O49纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。
反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
(1)需要吸收能量最大的能垒(活化能)E=_____________ev,该步骤的化学方程式为______________;
(2)对于合成氨反应N2+3H2
2NH3,在标况下,平衡常数Kθ=
,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
①若起始N2和H2物质的量之比为1:
3,反应在恒定温度和标准压强下进行,达到平衡时H2的转化率为ɑ,则Kθ=______________(用含ɑ的最简式表示)。
②图中可以示意标准平衡常数Kθ随温度T变化趋势的是______________(填序号).
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。
该电池工作时,正极的电极反应为______________。
中间所用的交换膜应该为______________(填“阳离子交换膜”或“阴离子交换膜”或“质子交换膜”)。
相比现有工业合成氨,该方法的优点是:
______________。
(任写一条)
2.氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)
CO2(g)+4H2(g)△H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)
CO(g)+3H2(g)△H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)
CO2(g)+H2(g)△H2
根据上述信息计算:
a=_________、△H2=_________。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为__________________(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有_______________(填标号)。
A.适当增大反应物投料比武n(H2O):
n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:
N2+3H2
2NH3。
将n(N2):
n(H2)=1:
3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是_________________________________。
某温度下,n(N2):
n(H2)=1:
3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为____________,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=_________(分压列计算式、不化简)。
3.碳及其化合物广泛存在于自然界。
请回答下列问题:
(1)反应Ⅰ:
Fe(s)+CO2(g)
FeO(s)+CO(g)ΔH1平衡常数为K1
反应Ⅱ:
Fe(s)+H2O(g)
FeO(s)+H2(g)ΔH2平衡常数为K2
不同温度下,K1、K2的值如下表:
现有反应Ⅲ:
H2(g)+CO2(g)
CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______(填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:
2CO2(g)+6H2(g)
C2H5OH(g)+3H2O(g)∆H<0。
设m为起始时的投料比,即m=n(H2)/n(CO2)。
①图1中投料比相同,温度从高到低的顺序为______________________。
②图2中m1、m2、m3从大到小的顺序为________________________。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。
则曲线d代表的物质化学名称为______________,T4温度时,该反应平衡常数KP的计算式为(不必化简)_______________________。
(3)已知:
NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。
工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。
所得溶液的pH___________7(填“>”、“=”或“<”)。
烟气需冷却至15.5℃~26.5℃的可能原因是____________。
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。
往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
4.随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。
甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,制取甲胺的反应为CH3OH(g)+NH3(g)
CH3NH2(g)+H2O(g)ΔH。
回答下列问题:
(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+
O2(g)═CO2(g)△H1=-284kJ/mol
②H2(g)+
O2(g)═H2O(g)△H2=-248kJ/mol
③CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H3=-651kJ/mol
CO(g)+2H2(g)
CH3OH(g)ΔH=___________。
(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________________。
②X轴上b点的数值比a点_________(填“大”或“小”)。
某同学认为图中Y轴表示温度,你认为他判断的理由是_______________________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=_______;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq)
PbCl2(s)+2I-(aq)的平衡常数K=___________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
①反应H2(g)+I2(g)
2HI(g)的ΔH__________(填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:
SO2+I2+2H2O
3H++HSO4-+2I-,I2+I-
I3-,图2中曲线a、b分别代表的微粒是___________、___________(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___________________。
6.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生如下反应:
CO2(g)+CH4(g)
2CO(g)+2H2(g)。
平衡体系中各组分体积分数如下表:
物质
CH4
CO2
CO
H2
体积分数
0.1
0.1
0.4
0.4
①此温度下该反应的平衡常数K=__________。
②已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=
890.3kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ·mol-1
2CO(g)+O2(g)=2CO2(g)△H=
566.0kJ·mol-1
反应CO2(g)+CH4(g)
2CO(g)+2H2(g)的△H=_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
250~300℃时,温度升高而乙酸的生成速率降低的原因是______。
②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______。
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2,原理是:
在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:
CO2+H2O
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。
工作原理示意图如下:
CO2在电极a放电的电极反应式是______________。
7.随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。
甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。
已知该反应中相关化学键的键能数据如下:
共价键
C—O
H—O
N—H
C—N
C—H
键能/kJ·mol-1
351
463
393
293
414
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。
在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________(填“大”或“小”)。
某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH
CO+2H2的方法来制取高纯度的CO和H2。
我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式A:
CH3OH*→CH3O*+H*Ea=+103.1kJ·mol-1
方式B:
CH3OH*→CH3*+OH*Eb=+249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=_________。
8.联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:
①N2H4
(1)+O2(g)=N2(g)+2H2O(g)△H1=-621.5kJ•mol-1
②N2O4
(1)=N2(g)+2O2(g)△H2=+204.3kJ•mol-1
则火箭燃料的燃烧反应为2N2H4
(1)+N2O4
(1)=3N2(g)+4H2O(g)△H=__。
(2)已知反应N2H4(g)+2Cl2(g)
N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
①0~10min内,用N2(g)表示的平均反应速率v(N2)=__。
②M点时,N2H4的转化率为__(精确到0.1)%。
③T℃时,达到平衡后再向该容器中加入1.2molN2H4(g)、0.4molCl2(g)、0.8molN2(g)、1.2molHCl(g),此时平衡__(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下,1.0mol•L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=__。
②用次磷酸钠通过电渗析法制备次磷酸,装置如图所示。
交换膜A属于__(“阳离子”或“阴离子”)交换膜,电极N的电极反应式为___。
9.煤的气化和液化是现代能源工业中重点考虑的综合利用技术。
最常见的气化方法是用煤作原料生产水煤气,而比较流行的液化方法是煤在催化剂等条件下生产CH3OH。
已知制备甲醇的有关化学反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=−90.8kJ•mol−1
②CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2=−412kJ•mol−1
③CO(g)+2H2(g)⇌CH3OH(g)△H3
I.回答下列问题:
(1)欲提高甲醇的产率,可以采取的措施有______(填字母序号)。
A.升高温度B.增大压强C.降低温度D.降低压强
(2)提高甲醇反应选择性的关键因素是______。
(3)保持温度和容积不变,下列描述能说明反应③达到平衡状态的是______(填字母序号)。
A.v(CO):
v(H2):
v(CH3OH)=1:
2:
1
B.混合气体的压强不再随时间的变化而变化
C.单位时间内断裂2molH−H键,同时生成3molC−H键
D.一段时间内的平均反应速率等于0
E.混合气体的平均摩尔质量保持不变
Ⅱ.在一密闭容器中投入1molCO和2molH2发生反应③,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图1所示:
(4)压强P1______P2(填“>”、“<“或”=”)。
(5)M、N两点的化学反应速率:
vM______vN(填“>”、“<“或“=”)
(6)对于气相反应,用某组分B的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(Kp),则M点时,平衡常数Kp=______(P1=5MPa)。
(7)甲、乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:
P(M)______2P(L),平衡常数:
K(M)______K(L)(填“>”、“>”或“=”)。
10.氮的氧化物是造成大气污染的主要物质。
研究氮氧化物的反应机理对消除环境污染有重要意义。
(1)NO在空气中存在如下反应:
2NO(g)+O2(g)⇌2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:
回答下列问题:
①写出反应I的热化学方程式_____________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。
决定2NO(g)+O2(g)⇌2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:
C(s)+2NO(g)⇌N2(g)+CO2(g)。
向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
①T℃时,该反应的平衡常数为__________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:
2NO2(g)⇌N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:
v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=_______;在上图标出点中,指出能表示反应未达到平衡状态的点是_________。
11.随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。
Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g)
NH4HCO3(aq) ΔH1
2NH3(l)+H2O(l)+CO2(g)
(NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g)
2NH4HCO3(aq) ΔH3
则ΔH3=_________________(用含ΔH1、ΔH2的代数式表示)。
Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为CO2(g)+4H2(g)
CH4(g)+2H2O(g),已知:
H2的体积分数随温度的升高而增加。
(1)该反应的ΔS________0(填“>”“<”或“=”),该反应的ΔH________0(填“>”或“<”)。
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。
下列能说明反应达到平衡状态的是________(填字母代号)。
A.体系压强保持不变B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变D.H2的质量分数保持不变
(3)T℃下,反应前20s的平均反应速率v(H2)=______________(用含a、b的代数式表示)。
(4)T℃下,该反应的平衡常数K=_________________________(用含a、b的代数式表示)。
(5)若降低温度,反应重新达到平衡,则v(正)________;CO2转化率________(填“增大”“减小”或“不变”)。
Ⅲ.工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
(1)在阳极区发生的反应包括___________________________________和H++HCO3-=CO2↑+H2O。
(2)简述CO32-在阴极区再生的原理:
____________________________。
12.含氮物质被广泛应用于化肥、制药、合成纤维等化工行业造福人类,但如果使用或处理不当,也会对环境造成影响。
如何合理地使用含氮物质,是化学学科肩负的重要社会责任。
请根据所学知识解答下列问题:
(1)利用甲烷催化还原氮氧化物。
已知:
Ⅰ:
Ⅱ.
则CH4将NO还原为N2的热化学方程式为____________________________。
(2)在
密闭容器中通入
和
,在一定温度下进行反应Ⅱ,反应时间(t)与容器内气体总压强(p)的数据见下表:
反应时间t/min
0
2
4
6
8
10
总压强P/100kPa
4.80
5.44
5.76
5.92
6.00
6.00
由表中数据计算,
内
_________
,该温度下的浓度平衡常数
___________。
(3)在一密闭的恒容容器中,若按
投料进行反应Ⅱ,下列说法正确的是_______。
A.使用催化剂可以提高CH4的平衡转化率
B.若反应Ⅱ在400℃和500℃的平衡常数分别为Ka和Kb,则Ka>Kb
C.投料比不变,温度越低,反应一定时间后CH4的转化率越高
D.投料比不变,增加反应物的浓度,达到新平衡后CH4的转化率减小
E.若
,说明反应达到平衡状态
(4)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:
。
其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
①工业上选择催化剂__________(填“甲”或“乙”)
②在催化剂甲作用下,温度高于210℃时,NO转化率降低的原因可能是_______(写一条即可)。
(5)工业合成尿素的反应如下:
,在恒定温度下,将NH3和CO2按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经
达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1molCO2,在40min时重新达到平衡,请在图中画出
内NH3的浓度变化曲线。
13.甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,该物质可由甲胺(CH3NH2)、PbI2及HI为原料来合成。
请回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)==CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:
共价键
C-O
H-O
N-H
C-N
键能/(kJ
mol-1)
351
463
393
293
则该反应的△H=_____kJ·mol-1
(2)工业上利用水煤气合成甲醇的反应为CO(g)+2H2(g)
CH3OH(g)△H<0。
一定温度下,向体积为2L的密闭容器中加入CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。
物质
CO
H2
CH3OH
浓度/(mol
L-1)
0.9
1.0
0.6
①0~5min内,用CO表示的平均反应速率为_____。
②既能加快反应速率,又能提高氢气转化率的措施有_____(答一条即可)。
③能说明上述反应已达化学平衡状态的是_____(填字母)。
A.v正(CO)=2v逆(H2)B.混合气体密度保持不变
C.反应容器内压强保持不变D.混合气体的平均摩尔质量不变
(3)PbI2可由Pb3O4和HI反应制备,反应的化学方程式为_____