高考一轮复习硫氮及其化合物docx.docx
《高考一轮复习硫氮及其化合物docx.docx》由会员分享,可在线阅读,更多相关《高考一轮复习硫氮及其化合物docx.docx(12页珍藏版)》请在冰豆网上搜索。
高考一轮复习硫氮及其化合物docx
高中化学学习材料
(灿若寒星**整理制作)
硫、氮及其化合物
一、重要方程式的书写
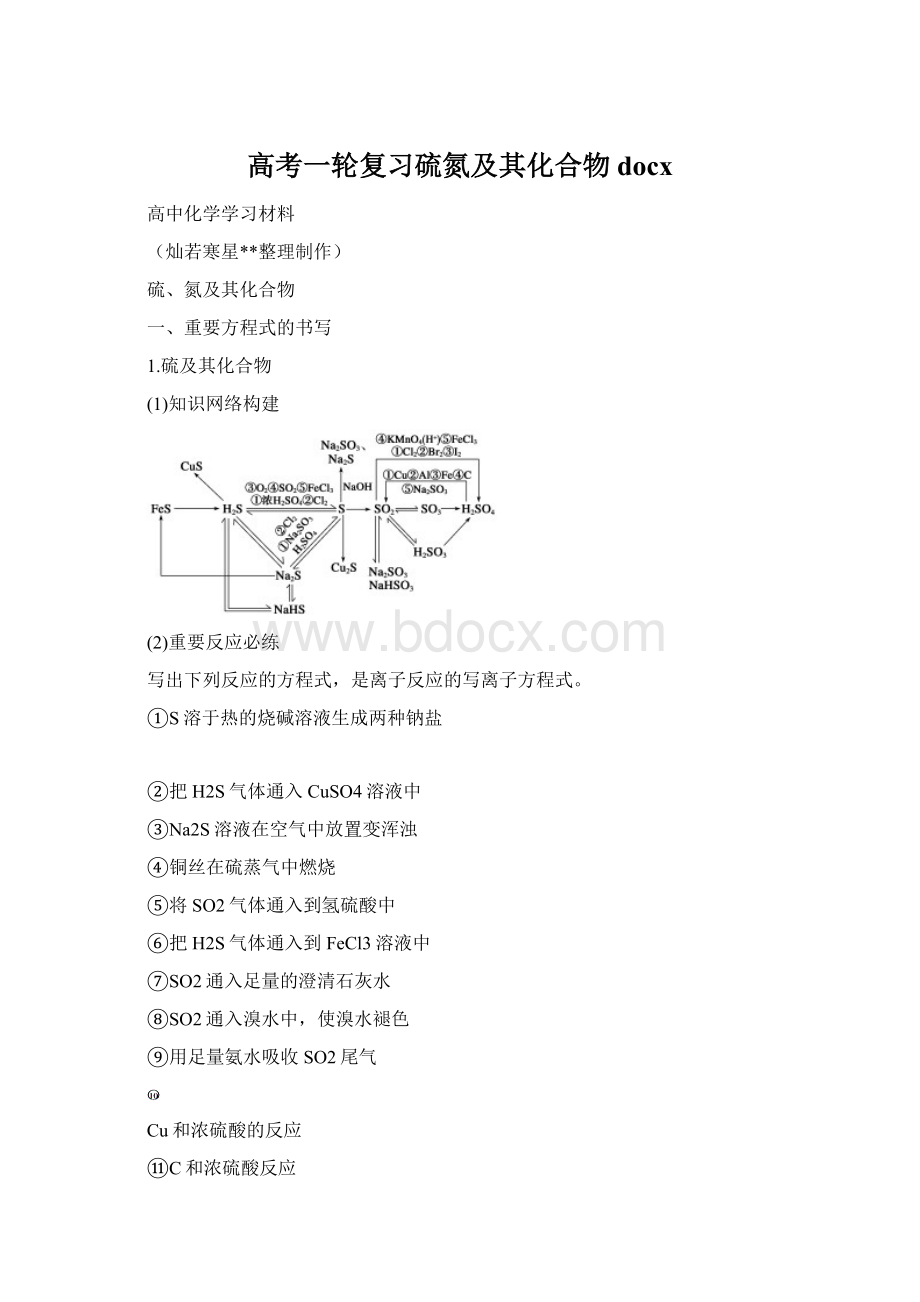
1.硫及其化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
①S溶于热的烧碱溶液生成两种钠盐
②把H2S气体通入CuSO4溶液中
③Na2S溶液在空气中放置变浑浊
④铜丝在硫蒸气中燃烧
⑤将SO2气体通入到氢硫酸中
⑥把H2S气体通入到FeCl3溶液中
⑦SO2通入足量的澄清石灰水
⑧SO2通入溴水中,使溴水褪色
⑨用足量氨水吸收SO2尾气
Cu和浓硫酸的反应
⑪C和浓硫酸反应
⑫把浓H2SO4滴到Na2SO3固体上
2.氮及其化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
①N2和H2的反应
②把NH3通入水中
③实验室利用NH4Cl固体、Ca(OH)2固体混合加热制备NH3
④NH3的催化氧化
⑤NH4HCO3溶液中加入过量稀NaOH溶液
⑥NO2溶于水
⑦NO2被烧碱溶液吸收生成两种钠盐
⑧物质的量之比为1∶1的NO和NO2混合气体恰好被烧碱溶液吸收生成一种钠盐
⑨Cu和稀HNO3的反应
⑩Cu和浓HNO3的反应
⑪Fe和过量稀HNO3的反应
⑫C和浓HNO3的反应
⑬浓硝酸见光分解(化学方程式)
二、值得强化记忆的实验现象
1.硫在纯O2中燃烧的现象。
2.加热NH4HCO3固体现象。
3.将SO2气体通入到品红溶液中再加热的现象。
4.加热盛有NH4Cl固体的试管,现象。
5.无色试剂瓶内的浓HNO3受日光照射,其现象为。
6.铜片和过量浓硝酸反应的现象。
7.铜片和过量稀HNO3反应的现象
。
8.把SO2气体通入到FeCl3溶液的现象。
9.将两支蘸有浓盐酸和浓氨水的玻璃棒相互靠近。
10.将浓硫酸滴到蓝矾晶体上,现象。
三、简答类语言规范再落实
1.离子检验
(1)检验Na2SO3样品部分被氧化的实验操作及现象。
(2)检验Na2SO4中含有少量NaCl的实验操作及现象。
(3)NH
的检验
试剂及用品:
_______________________操作及现象:
______________________________
2.气体检验
有下列几瓶气体:
①NO2、②Cl2、③HCl、④NO、⑤NH3、⑥H2S、⑦SO2、⑧O2、⑨H2、⑩CO2
(1)瓶内气体为红棕色的是。
(2)瓶内气体为黄绿色的是。
(3)打开瓶,瓶口有白雾的是,瓶口出现红棕色气体的是。
(4)使湿润红色石蕊试纸变蓝的是。
(5)使湿润醋酸铅试纸变黑的是。
(6)使石灰水变浑浊的气体是,使品红溶液褪色的是。
(7)使余烬木条复燃的是。
(8)点燃产生爆鸣声的是。
3.气体制备
回答下列问题。
有下列几种气体:
①O2、②NH3、③H2、④CO2、⑤H2S、⑥C2H2、⑦SO2、⑧NO2、⑨Cl2、⑩HCl、⑪NO、⑫HBr、⑬HI
(一)制备
(1)
此装置适用于制备。
(2)
此装置适用于制备。
(3)
此装置适用于制备。
(4)
此装置适用于制备。
(二)干燥
(1)能用浓硫酸、P2O5干燥的是。
(2)能用碱石灰干燥的是。
4.浓硫酸为什么不能干燥NH3、H2S、HBr、HI等气体?
5.SO2的水溶液和Cl2的水溶液均能使品红溶液褪色,将SO2和Cl2按1∶1体积比(同温同压)混合后通入品红溶液中,品红溶液不褪色,其原因是_________________________。
6.工业上为什么常用“H2O2”作氧化剂?
7.SO2能使Na2CO3溶液(滴有酚酞)、酸性高锰酸钾溶液、溴水、品红溶液褪色,原理相同吗?
表现了SO2的什么性质?
8.SO2、漂白粉、活性炭、H2O2和Na2O2都能使红墨水褪色,试述其各自原理。
9.加热时,浓硫酸和足量Zn反应与浓硫酸和足量Cu反应产生的气体成分相同吗?
为什么?
10.将等质量的铜片分别与等体积、过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?
________(填“同意”或“不同意”),原因是_____________________________________________。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论):
硫、氮及其化合物
一、重要方程式的书写
1.硫及其化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
①S溶于热的烧碱溶液生成两种钠盐
3S+6OH-
2S2-+SO
+3H2O;
②把H2S气体通入CuSO4溶液中
H2S+Cu2+===CuS↓+2H+;
③Na2S溶液在空气中放置变浑浊
2S2-+O2+2H2O===2S↓+4OH-;
④铜丝在硫蒸气中燃烧
2Cu+S
Cu2S;
⑤将SO2气体通入到氢硫酸中
SO2+2H2S===3S↓+2H2O;
⑥把H2S气体通入到FeCl3溶液中
H2S+2Fe3+===S↓+2Fe2++2H+;
⑦SO2通入足量的澄清石灰水
SO2+Ca2++2OH-===CaSO3↓+H2O;
⑧SO2通入溴水中,使溴水褪色
SO2+Br2+2H2O===SO
+2Br-+4H+;
⑨用足量氨水吸收SO2尾气
2NH3·H2O+SO2===2NH
+SO
+H2O;
Cu和浓硫酸的反应
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
⑪C和浓硫酸反应
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
⑫把浓H2SO4滴到Na2SO3固体上
H2SO4(浓)+Na2SO3===Na2SO4+H2O+SO2↑。
2.氮及其化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
①N2和H2的反应
N2+3H2
2NH3;
②把NH3通入水中
NH3+H2ONH3·H2ONH
+OH-;
③实验室利用NH4Cl固体、Ca(OH)2固体混合加热制备NH3
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;
④NH3的催化氧化
4NH3+5O2
4NO+6H2O;
⑤NH4HCO3溶液中加入过量稀NaOH溶液
NH
+HCO
+2OH-===NH3·H2O+CO
+H2O;
⑥NO2溶于水
3NO2+H2O===2H++2NO
+NO;
⑦NO2被烧碱溶液吸收生成两种钠盐
2NO2+2OH-===NO
+NO
+H2O;
⑧物质的量之比为1∶1的NO和NO2混合气体恰好被烧碱溶液吸收生成一种钠盐
NO+NO2+2OH-===2NO
+H2O;
⑨Cu和稀HNO3的反应
3Cu+8H++2NO
===3Cu2++2NO↑+4H2O;
⑩Cu和浓HNO3的反应
Cu+4H++2NO
===Cu2++2NO2↑+2H2O;
⑪Fe和过量稀HNO3的反应
Fe+4H++NO
===Fe3++NO↑+2H2O;
⑫C和浓HNO3的反应
C+4H++4NO
CO2↑+4NO2↑+2H2O;
⑬浓硝酸见光分解(化学方程式)
4HNO3(浓)
4NO2↑+O2↑+2H2O。
二、值得强化记忆的实验现象
1.硫在纯O2中燃烧的现象产生明亮的蓝紫色火焰,放出热量,有刺激性气味的气体生成。
2.加热NH4HCO3固体现象生成有刺激性气味的气体,试管内壁上有液滴生成。
3.将SO2气体通入到品红溶液中再加热的现象品红溶液褪色,加热又恢复红色。
4.加热盛有NH4Cl固体的试管,现象NH4Cl固体分解生成气体,在试管口又生成白色晶体。
5.无色试剂瓶内的浓HNO3受日光照射,其现象为瓶中上部空间部分呈棕色,硝酸显黄色。
6.铜片和过量浓硝酸反应的现象反应剧烈,有红棕色气体生成,铜片消失,生成蓝色溶液。
7.铜片和过量稀HNO3反应的现象开始反应缓慢,铜片上有少量气泡产生,随着反应的进行,反应速率加快,试管下端产生无色气体,气体上升变成红棕色,最后铜片消失,生成蓝色溶液。
8.把SO2气体通入到FeCl3溶液的现象溶液由棕黄色变成浅绿色。
9.将两支蘸有浓盐酸和浓氨水的玻璃棒相互靠近有大量白烟产生。
10.将浓硫酸滴到蓝矾晶体上,现象蓝矾晶体上出现白斑。
三、简答类语言规范再落实
1.离子检验
(1)检验Na2SO3样品部分被氧化的实验操作及现象。
答案 取样品,加入过量稀盐酸,产生有刺激性气味的气体,通入品红溶液,品红溶液褪色;再加入BaCl2溶液,产生白色沉淀。
(2)检验Na2SO4中含有少量NaCl的实验操作及现象。
答案 取少量样品溶于水,加入过量的Ba(NO3)2溶液,静置,取上层清液于试管中,再滴加AgNO3溶液,产生白色沉淀,证明Na2SO4中含有少量NaCl。
(3)NH
的检验
试剂及用品:
_______________________操作及现象:
______________________________
答案 NaOH溶液、湿润的红色石蕊试纸 向所取试液中加入浓NaOH溶液,加热,把湿润的红色石蕊试纸放在试管口,若试纸变蓝,说明有NH3生成,证明原溶液含有NH
2.气体检验
有下列几瓶气体:
①NO2、②Cl2、③HCl、④NO、⑤NH3、⑥H2S、⑦SO2、⑧O2、⑨H2、⑩CO2
(1)瓶内气体为红棕色的是①。
(2)瓶内气体为黄绿色的是②。
(3)打开瓶,瓶口有白雾的是③⑤,瓶口出现红棕色气体的是④。
(4)使湿润红色石蕊试纸变蓝的是⑤。
(5)使湿润醋酸铅试纸变黑的是⑥。
(6)使石灰水变浑浊的气体是⑦⑩,使品红溶液褪色的是②⑦。
(7)使余烬木条复燃的是⑧。
(8)点燃产生爆鸣声的是⑨。
3.气体制备
回答下列问题。
有下列几种气体:
①O2、②NH3、③H2、④CO2、⑤H2S、⑥C2H2、⑦SO2、⑧NO2、⑨Cl2、⑩HCl、⑪NO、⑫HBr、⑬HI
(一)制备
(1)
此装置适用于制备①②。
(2)
此装置适用于制备③④⑤。
(3)
此装置适用于制备①②③④⑤⑥⑦⑧⑪。
(4)
此装置适用于制备⑦⑨⑩⑪⑫⑬。
(二)干燥
(1)能用浓硫酸、P2O5干燥的是①③④⑦⑧⑨⑩⑪。
(2)能用碱石灰干燥的是①②③⑥⑪。
4.浓硫酸为什么不能干燥NH3、H2S、HBr、HI等气体?
答案 浓硫酸具有酸性和强氧化性,吸收NH3生成(NH4)2SO4,能把H2S、HBr、HI氧化成
单质。
5.SO2的水溶液和Cl2的水溶液均能使品红溶液褪色,将SO2和Cl2按1∶1体积比(同温同压)混合后通入品红溶液中,品红溶液不褪色,其原因是_________________________。
答案 SO2+Cl2+2H2O===2HCl+H2SO4,HCl、H2SO4均不具有漂白性
6.工业上为什么常用“H2O2”作氧化剂?
答案 当H2O2作氧化剂时,其还原产物为H2O,无污染。
7.SO2能使Na2CO3溶液(滴有酚酞)、酸性高锰酸钾溶液、溴水、品红溶液褪色,原理相同吗?
表现了SO2的什么性质?
答案 原理不相同。
SO2能使Na2CO3溶液(滴有酚酞)红色褪去,是因为发生了反应Na2CO3+2SO2+