常见共沸物.docx
《常见共沸物.docx》由会员分享,可在线阅读,更多相关《常见共沸物.docx(39页珍藏版)》请在冰豆网上搜索。
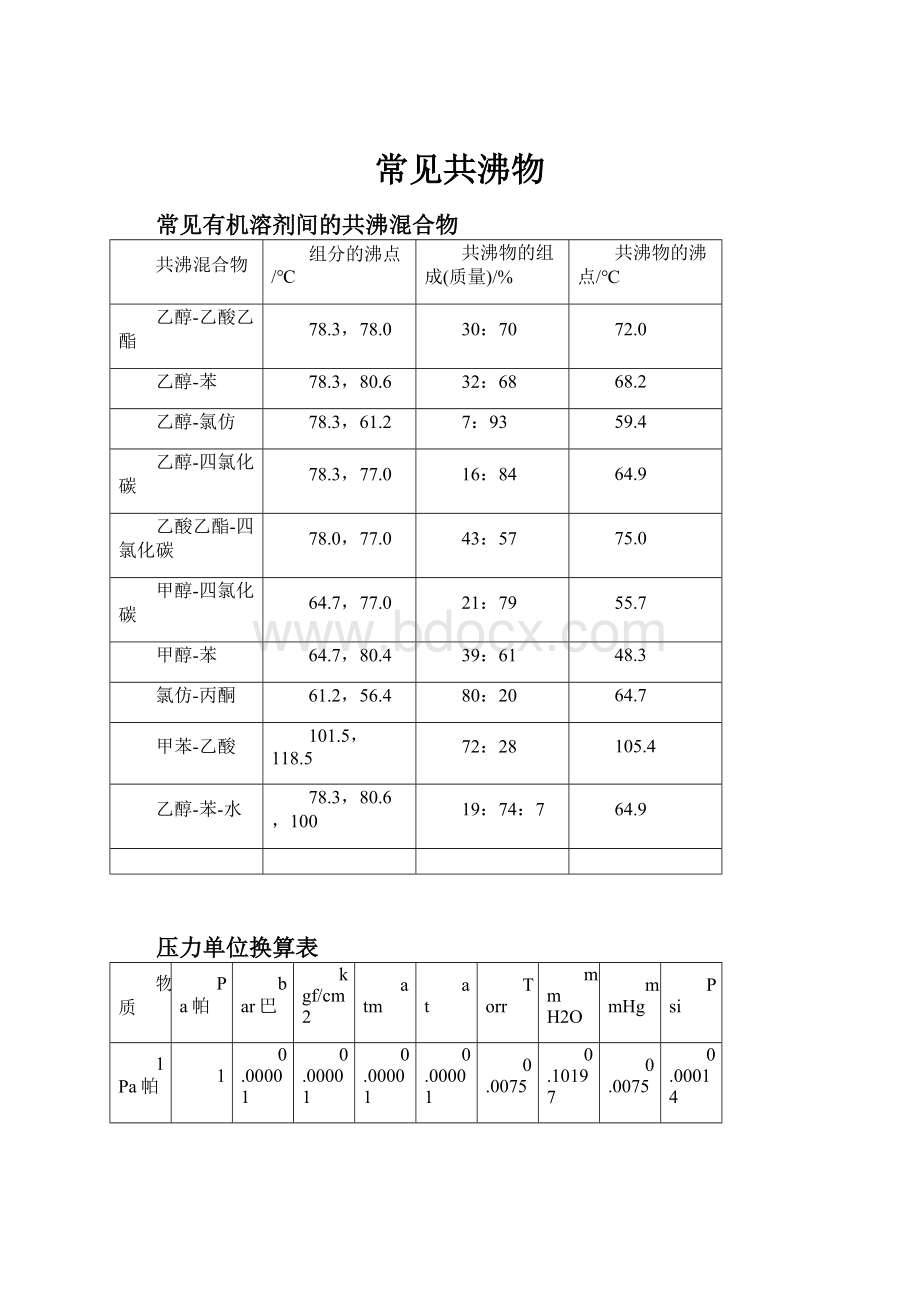
常见共沸物
常见有机溶剂间的共沸混合物
共沸混合物
组分的沸点/℃
共沸物的组成(质量)/%
共沸物的沸点/℃
乙醇-乙酸乙酯
78.3,78.0
30:
70
72.0
乙醇-苯
78.3,80.6
32:
68
68.2
乙醇-氯仿
78.3,61.2
7:
93
59.4
乙醇-四氯化碳
78.3,77.0
16:
84
64.9
乙酸乙酯-四氯化碳
78.0,77.0
43:
57
75.0
甲醇-四氯化碳
64.7,77.0
21:
79
55.7
甲醇-苯
64.7,80.4
39:
61
48.3
氯仿-丙酮
61.2,56.4
80:
20
64.7
甲苯-乙酸
101.5,118.5
72:
28
105.4
乙醇-苯-水
78.3,80.6,100
19:
74:
7
64.9
压力单位换算表
物质
Pa帕
bar巴
kgf/cm2
atm
at
Torr
mmH2O
mmHg
Psi
1Pa帕
1
0.00001
0.00001
0.00001
0.00001
0.0075
0.10197
0.0075
0.00014
1bar巴
100000
1
1.01972
0.9869
1.01972
750.062
10.1972
750.062
14.504
1kgf/cm2
98066.5
0.98067
1
0.9678
11
735.6
10.000
735.6
14.22
1atm标准大气压
101325
1.01325
1.033
1
760
10.332
760
14.7
1at工程大气压
98067
0.98067
11
0.9678
1
735.6
10.000
735.6
14.22
1Torr托
133.3
0.00133
0.00136
0.00132
0.00136
1
13.6
1
0.01934
H2O1mm毫米水柱
9.8067
0.000098
0.0001
0.0000968
0.0001
0.07356
1
0.07356
0.00142
1mmHg毫米汞柱
133.322
0.00133
0.00136
0.00132
0.00136
1
13.5951
1
0.01934
1Psi磅/寸2
6894.76
0.06895
0.07031
0.06805
0.07031
51.7149
703.07
51.7149
1
注:
毫米水柱是指4摄氏度状态的水柱高度,毫米汞柱是指0摄氏度状态的水柱高度。
实验室常用酸、碱的浓度
试剂名称
密度(20℃)g/ml
浓度mol/L
质量分数
浓硫酸
1.84
18.0
0.960
浓盐酸
1.19
12.1
0.372
浓硝酸
1.42
15.9
0.704
磷酸
1.70
14.8
0.855
冰醋酸
1.05
17.45
0.998
浓氨水
0.90
14.53
0.566
浓氢氧化钠
1.54
19.4
0.505
一些溶剂与水形成的二元共沸物
溶剂
沸点/℃
共沸点/℃
含水量/%
溶剂
沸点/℃
共沸点/℃
含水量/%
氯仿
61.2
56.1
2.5
甲苯
110.5
85.0
20
四氯化碳
77.0
66.0
4.0
正丙醇
97.2
87.7
28.8
苯
80.4
69.2
8.8
异丁醇
108.4
89.9
88.2
丙烯腈
78.0
70.0
13.0
二甲苯
137-40.5
92.0
37.5
二氯乙烷
83.7
72.0
19.5
正丁醇
117.7
92.2
37.5
乙腈
82.0
76.0
16.0
吡啶
115.5
94.0
42
乙醇
78.3
78.1
4.4
异戊醇
131.0
95.1
49.6
乙酸乙酯
77.1
70.4
8.0
正戊醇
138.3
95.4
44.7
异丙醇
82.4
80.4
12.1
氯乙醇
129.0
97.8
59.0
乙醚
35
34
1.0
二硫化碳
46
44
2.0
甲酸
101
107
26
用于有机溶剂的中等强度的干燥剂
干燥剂
容量
速率
注解
CaSO4
1/2H2O
极快
(1)
以商品名Drieritt出售,加或不加颜色指示剂;非常有效,干时,指示剂(CoCL2)呈蓝色,吸水后变成粉红色(容量CoCL2.6H2O);适用的温度范围为-50~+86度。
某些有机溶剂能使CoCL2沥出或改变颜色(如丙酮,醇类,吡啶等)。
CaCL2
6H2O
极快
(2)
不是很有效;只用于烃或卤代烃(与含氮和含氮化合物形成溶剂化物,络合物,或发生反应)。
MgSO4
7H2O
极快(4)
出色的通用干燥剂;非常惰性单可能呈弱酸性(避免用于对酸极敏感的化合物),可能溶于某些有机溶剂。
4A分子筛
高
块(30)
非常有效;建议先用普通干燥剂后用此物(见下述有关分子筛的详情)3A分子筛也是出色的干燥剂。
NaSO4
10H2O
慢(290)
非常温和,非常有效,便宜,高容量;很适于初步干燥,但不可以使溶剂受热。
K2CO3
2H2O
快
对于酯腈酮,特别是醇,是良好的干燥剂,不可以用于酸性化合物。
NaOH,KOH
极高
快
高效但只适用于不会使他们溶解的惰性溶液;特别适用于胺。
H2SO4
极高
极快
极为有效,但只限于用来干燥饱和烃或芳香烃或卤代烃(硫酸会与烯或其他碱性化合物作用二使之损失)。
氧化铝或硅胶(SiO2)
极高
极快
特别适用于烃,应该研细;用过后加热(SiO2为300度,Al2O3为500度)就可以重新活化。
有机化合物的鉴别
在药品的生产、研究及检验等过程中,常常会遇到有机化合物的分离、提纯和鉴别等问题。
有机化合物的鉴别、分离和提纯是三个既有关联而又不相同的概念。
分离和提纯的目的都是由混合物得到纯净物,但要求不同,处理方法也不同。
分离是将混合物中的各个组分一一分开。
在分离过程中常常将混合物中的某一组分通过化学反应转变成新的化合物,分离后还要将其还原为原来的化合物。
提纯有两种情况,一是设法将杂质转化为所需的化合物,另一种情况是把杂质通过适当的化学反应转变为另外一种化合物将其分离(分离后的化合物不必再还原)。
鉴别是根据化合物的不同性质来确定其含有什么官能团,是哪种化合物。
如鉴别一组化合物,就是分别确定各是哪种化合物即可。
在做鉴别题时要注意,并不是化合物的所有化学性质都可以用于鉴别,必须具备一定的条件:
(1)化学反应中有颜色变化
(2)化学反应过程中伴随着明显的温度变化(放热或吸热)
(3)反应产物有气体产生
(4)反应产物有沉淀生成或反应过程中沉淀溶解、产物分层等。
本课程要求掌握的重点是化合物的鉴别,为了帮助大家学习和记忆,将各类有机化合物的鉴别方法进行归纳总结,并对典型例题进行解析。
一.各类化合物的鉴别方法
1.烯烃、二烯、炔烃:
(1)溴的四氯化碳溶液,红色腿去
(2)高锰酸钾溶液,紫色腿去。
2.含有炔氢的炔烃:
(1)硝酸银,生成炔化银白色沉淀
(2)氯化亚铜的氨溶液,生成炔化亚铜红色沉淀。
3.小环烃:
三、四元脂环烃可使溴的四氯化碳溶液腿色。
4.卤代烃:
硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
5.醇:
(1)与金属钠反应放出氢气(鉴别6个碳原子以下的醇);
(2)用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化。
6.酚或烯醇类化合物:
(1)用三氯化铁溶液产生颜色(苯酚产生兰紫色)。
(2)苯酚与溴水生成三溴苯酚白色沉淀。
7.羰基化合物:
(1)鉴别所有的醛酮:
2,4-二硝基苯肼,产生黄色或橙红色沉淀;
(2)区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;
(3)区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;
(4)鉴别甲基酮和具有结构的醇,用碘的氢氧化钠溶液,生成黄色的碘仿沉淀。
8.甲酸:
用托伦试剂,甲酸能生成银镜,而其他酸不能。
9.胺:
区别伯、仲、叔胺有两种方法
(1)用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。
(2)用NaNO2+HCl:
脂肪胺:
伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应。
芳香胺:
伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体。
10.糖:
(1)单糖都能与托伦试剂和斐林试剂作用,产生银镜或砖红色沉淀;
(2)葡萄糖与果糖:
用溴水可区别葡萄糖与果糖,葡萄糖能使溴水褪色,而果糖不能。
(3)麦芽糖与蔗糖:
用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能。
二.例题解析
例1.用化学方法鉴别丁烷、1-丁炔、2-丁炔。
分析:
上面三种化合物中,丁烷为饱和烃,1-丁炔和2-丁炔为不饱和烃,用溴的四氯化碳溶液或高锰酸钾溶液可区别饱和烃和不饱和烃,1-丁炔具有炔氢而2-丁炔没有,可用硝酸银或氯化亚铜的氨溶液鉴别。
因此,上面一组化合物的鉴别方法为:
例2.用化学方法鉴别氯苄、1-氯丙烷和2-氯丙烷。
分析:
上面三种化合物都是卤代烃,是同一类化合物,都能与硝酸银的醇溶液反应生成卤化银沉淀,但由于三种化合物的结构不同,分别为苄基、二级、一级卤代烃,它们在反应中的活性不同,因此,可根据其反应速度进行鉴别。
上面一组化合物的鉴别方法为:
例3.用化学方法鉴别下列化合物
苯甲醛、丙醛、2-戊酮、3-戊酮、正丙醇、异丙醇、苯酚
分析:
上面一组化合物中有醛、酮、醇、酚四类,醛和酮都是羰基化合物,因此,首先用鉴别羰基化合物的试剂将醛酮与醇酚区别,然后用托伦试剂区别醛与酮,用斐林试剂区别芳香醛与脂肪醛,用碘仿反应鉴别甲基酮;用三氯化铁的颜色反应区别酚与醇,用碘仿反应鉴别可氧化成甲基酮的醇。
鉴别方法可按下列步骤进行:
(1)将化合物各取少量分别放在7支试管中,各加入几滴2,4-二硝基苯肼试剂,有黄色沉淀生成的为羰基化合物,即苯甲醛、丙醛、2-戊酮、3-戊酮,无沉淀生成的是醇与酚。
(2)将4种羰基化合物各取少量分别放在4支试管中,各加入托伦试剂(氢氧化银的氨溶液),在水浴上加热,有银镜生成的为醛,即苯甲醛和丙醛,无银镜生成的是2-戊酮和3-戊酮。
(3)将2种醛各取少量分别放在2支试管中,各加入斐林试剂(酒石酸钾钠、硫酸酮、氢氧化钠的混合液),有红色沉淀生成的为丙醛,无沉淀生成的是苯甲醛。
(4)将2种酮各取少量分别放在2支试管中,各加入碘的氢氧化钠溶液,有黄色沉淀生成的为2-戊酮,无黄色沉淀生成的是3-戊酮。
(5)将3种醇和酚各取少量分别放在3支试管中,各加入几滴三氯化铁溶液,出现兰紫色的为苯酚,无兰紫色的是醇。
(6)将2种醇各取少量分别放在支试管中,各加入几滴碘的氢氧化钠溶液,有黄色沉淀生成的为异丙醇,无黄色沉淀生成的是丙醇。
例4.用化学方法鉴别甲胺、二甲胺、三甲胺。
分析:
上面三种化合物都是脂肪胺,分别为伯、仲、叔胺。
伯胺和仲胺在氢氧化钠溶液存在下,能与苯磺酰氯发生反应,生成苯磺酰胺。
伯胺反应后生成的苯磺酰胺,因其氮原子上还有一个氢原子,显示弱酸性,能溶于氢氧化钠而生成盐;仲胺生成的苯磺酰胺中,其氮原子上没有氢原子,不溶于氢氧化钠而呈固体析出;叔胺不发生反应,因此,可用此反应(兴斯堡反应)鉴别三种化合物。
鉴别方法如下:
例5.用化学方法鉴别葡萄糖、果糖、蔗糖。
分析:
上面三种化合物都是糖,葡萄糖、果糖是单糖,具有还原性,能被托伦试剂和斐林试剂氧化,而蔗糖是非还原性双糖,因此,可用托伦试剂和斐林试剂将蔗糖与葡萄糖、果糖区别;葡萄糖是醛糖,可被溴水氧化,而果糖是酮糖,不被溴水氧化,因此,溴水可将二者区别。
鉴别方法如下:
有机实验室常用仪器与使用--气压计
气压计的作用是指示系统内的压力,通常采用水银气压计。
在厚玻璃管内盛水银,管背后装有移动标尺,移动标尺将零度调整在接尽活塞一边玻璃管B中的水银平面处,当减压泵工作时,A管汞柱下降,B管汞柱上升,两者之差,表明系统的压力。
使用时必须注意勿使水或赃物侵入测压计内,水银柱中也不得有气泡存在,否则将影响测定压力的准确性。
封闭式水银测压计的优点是轻巧方便,但如有残留空气或引入了水或杂质时,则准确度受到影响。
这种测压计装入水银时要严格控制不让空气进入,方法是先将纯净汞放入小圆底烧瓶,然后与测压计相连的高效油泵抽气至13033Pa(10-1mmHg)以下,并轻拍小烧瓶,使泵内的气泡逸出,用电吹风微热玻璃管使气体抽出,然后把水银注入U形管停止抽气放入大气即成。
开口式水银测压计装汞比较方便,比较准确,所用玻璃管的比度要超过760mm。
U形管两臂汞柱的高度之差即为公共压力与系统中压力之差。
有机实验室常用仪器与使用--真空泵
根据使用的范围和抽气效能可将真空泵分为三类:
(1)一般水泵,压强可达到1.333~100kPa(10~760mmHg)为“粗”真空。
(2)油泵,压强可达0.133~133.3Pa(0.001~1mmHg)为“次高”真空。
(3)扩散泵,压强可达0.133Pa以下,(10-3mmHg)为“高”真空。
在有机化学实验室里常用的减压泵有水泵和油泵两种,若不要求很低的压力时,可用水泵,如果水泵的构造好且水压又高,抽空效率可达1067~3333Pa(8~25mmHg)。
水泵所能抽到的最低压力理论上相当于当时水温下的水蒸气压力。
例如,水温25℃、20℃、10℃时,水蒸气的压力分别为3192、2394、1197Pa(8-25mmHg)。
用水泵抽气时,应在水泵前装上安全瓶,以防水压下降,水流倒吸;停止抽气前,应先放气,然后关水泵。
若要较低的压力,那就要用到油泵了,好的油泵能抽到133.3Pa(1mmHg)以下。
油泵的好坏决定于其机械结构和油的质量,使用油泵时必须把它保护好。
如果蒸馏挥发性较大的有机溶剂时,有机溶剂会被油吸收结果增加了蒸气压,从而降低了抽空效能,如果是酸性气体,那就会腐蚀油泵,如果是水蒸气就会使油成乳浊液而抽坏真空泵。
因此使用油泵时必须注意下列几点:
在蒸馏系统和油泵之间,必须装有吸收装置。
蒸馏前必须用水泵彻底抽去系统中有机溶剂的蒸汽。
如能用水泵抽气的,则尽量用水泵,如蒸馏物质中含有挥发性物质,可先用水泵减压抽降,然后改用油泵。
减压系统必须保持密不漏气,所有的橡皮塞的大小和孔道要合适,橡皮管要用真空用的橡皮管。
磨口玻璃涂上真空油脂。
搅拌器也是有机化学实验必不可少的仪器之一,它可使反应混合物混合得更加均匀,反应体系的温度更加均匀,从而有利于化学反应的进行特别是非均相反应。
搅拌的方法有三种:
人工搅拌、磁力搅拌、机械搅拌。
人工搅拌一般借助于玻棒就可以进行,磁力搅拌是利用磁力搅拌器,机械搅拌则是利用机械搅拌器。
磁力搅拌器
由于磁力搅拌器容易安装,因此,它可以用来进行连续搅拌尤其当反应量比较少或在反应是在密闭条件下进行,磁力搅拌器的使用更为方便。
但缺点是对于一些粘稠液或是有大量固体参加或生成的反应,磁力搅拌器无法顺利使用,这时就应选用机械搅拌器作为搅拌动力。
磁力搅拌器是利用磁场的转动来带动磁子的转动。
磁子是在一小块金属用一层惰性材料(如聚四氟乙烯等)包裹着的,也可以自制:
用一截10#铁铅丝放入细玻管或塑料管中,两端封口。
磁子的大小大约有10mm、20mm、30mm长,还有更长的磁子,磁子的形状有圆柱形、椭圆形和圆形等,如图2.5,可以根据实验的规模来选用。
机械搅拌器
机械搅拌器主要包括三部分:
电动机、搅拌棒和搅拌密封装置。
电动机是动力部分,固定在支架上,由调速器调节其转动快慢。
搅拌棒与电动机相连,当接通电源后,电动机就带动搅拌棒转动而进行搅拌,搅拌密封装置是搅拌棒与反应器连接的装置,它可以使反应在密封体系中进行。
搅拌的效率在很大程度上取决于搅拌棒的结构,图2.6介绍的老式搅拌棒是用粗玻璃棒制成的。
根据反应器的大小、形状、瓶口的大小及反应条件的要求,选择较为合适的搅拌棒。
有机实验室常用仪器与使用--加热
为了加速有机化学反应,以及将产物蒸馏、分馏等,往往需要加热。
但是考虑到大多数有机化合物包括有机溶剂都是易燃易爆物,所以在实验室安全规则中就规定禁止用明火直接加热(特殊需要除外)。
为了保证加热均匀,一般使用热浴进行间接加热。
作为传热的介质有空气、水、有机液体、熔融的盐和金属等,根据加热温度、升温的速度等需要,常用下列手段:
(1)水浴和蒸汽浴
当加热的温度不超过100℃时,最好使用水浴加热较为方便。
但是必须指出(强调):
当用到金属钾、钠的操作以及无水操作时,决不能在水浴上进行,否则会引起火灾或使实验失败,使用水浴时勿使容器触及水浴器壁及其底部。
由于水浴的不断蒸发,适当时要添加热水,使水浴中的水面经常保持稍高于容器内的液面。
电热多孔恒温水浴,使用起来较为方便。
(2)油浴
当加热温度在100~200℃时,宜使用油浴,优点是使反应物受热均匀,反应物的温度一般低于油浴温度20℃左右。
常用的油浴有:
1)甘油可以加热到140-150℃,温度过高时则会炭化。
2)植物油如菜油、花生油等,可以加热到220℃,常加入1%的对苯二酚等抗氧化剂,便于久用。
若温度过高时分解,达到闪点时可能燃烧起来,所以使用时要小心。
3)石蜡油可以加热到200℃左右,温度稍高并不分解,但较易燃烧。
4)硅油硅油在250℃时仍较稳定,透明度好,安全,是目前实验室里较为常用的油浴之一,但其价格较贵。
使用油浴加热时要特别小心,防止着火,当油浴受热冒烟时,应立即停止加热,油浴中应挂一温度计,可以观察油浴的温度和有无过热现象,同时便于调节控制温度,温度不能过高,否则受热后有溢出的危险。
使用油浴时要竭力防止产生可能引起油浴燃烧的因素。
加热完毕取出反应容器时,仍用铁夹夹住反应器离开油浴液面悬置片刻,待容器壁上附着的油滴完后,再用纸片或干布檫干器壁。
(3)砂浴
一般用铁盆装干燥的细海砂(或河砂),把反应器埋在砂中,特别适用于加热温度在220℃以上者。
但砂浴传热慢,升温较慢,且不易控制。
因此,砂层要薄一些,砂浴中应插入温度计,温度计水银球要靠近反应器。
(4)电热套
电热套是用玻璃纤维包裹着地电热丝组成帽状的加热器,由于不是使用明火,因此不易着火,并且热效应高,加温温度用调压变压器控制,最高温度可达400℃左右,是有机实验室中常用的一种简便、安全的加热装置。
需要强调的是,当一些易燃液体(如酒精、乙醚等)洒在电热套上,仍有引起火灾的危险。
有机实验室常用仪器与使用--玻璃仪器的干燥
有机化学实验室经常需要使用干燥的玻璃仪器,故要养成在每次实验后马上把玻璃仪器洗净和倒置使之晾干的习惯,以便下次实验时使用。
干燥玻璃仪器的方法有下列几种:
(1)自然风干
是指把已洗净的玻璃仪器在干燥架上自然风干,这是常用而简单的方法。
但必须注意,若玻璃仪器洗得不够干净时,水珠不易流下,干燥较为缓慢。
(2)烘干
是指把已洗净的玻璃仪器由上层到下层放入烘箱中烘干。
放入烘箱中干燥的玻璃仪器,一般要求不带水珠,器皿口侧放。
带有磨砂口玻璃塞的仪器,必须取出活塞才能烘干,玻璃仪器上附带的橡胶制品在放入烘箱前也应取下,烘箱内的温度保持105℃左右,约0.5h,待烘箱内的温度降至室温时才能取出。
切不可把很热的玻璃仪器取出,以免骤冷使之破裂,当烘箱已工作时,不能往上层放入湿的器皿,以免水滴下落,使热的器皿骤冷使之破裂。
(3)吹干
有时仪器洗涤后需要立即使用,可使用吹干,即用气流干燥器或电吹风把仪器吹干。
首先将水尽量晾干后,加入少量丙酮或乙醇摇洗并倾出,先通入冷吹风1-2min,待大部分溶剂挥发后,再吹入热风至完全干燥为止,最后吹入冷风使仪器逐渐冷却。
有机实验室常用仪器与使用--玻璃器皿的洗涤
进行化学实验必须使用清洁的玻璃仪器。
应该养成实验用过的玻璃器皿立即洗涤的习惯。
由于污垢的性质在当时是清楚的,用适当的方法进行洗涤是容易办到的,若日子久了,将会增加洗涤的困难。
洗涤的一般方法是用水、洗衣粉、去污粉刷洗,刷子是特制的,如瓶刷、烧杯刷、冷凝管刷等,但用腐蚀性洗液时则不用刷子。
若难于洗净时,则可根据污垢的性质选用适当的洗液进行洗净,如果是酸性的污垢用碱性洗液洗净,反之亦然;有机污垢用碱性或有机溶剂洗涤。
下面介绍几种常用洗液:
(1)铬酸洗涤
这种洗液氧化性很强,对有机污垢破坏力很强。
倾去器皿内的水,慢慢倒入洗液,转动器皿,使洗液充分浸润不干净的器壁,数分钟后把洗液倒回洗液瓶中,用自来水冲洗器皿。
若器壁上粘有少量炭化残渣,可加入少量洗液,浸泡一段时间后在小火上加热,直至冒出气泡,炭化残渣可被除去。
当洗液颜色变绿,表示已经失效,不能在倒回洗液瓶中而应倒在指定地点。
(2)盐酸
浓盐酸可洗去附着在器壁上的二氧化锰,碳酸盐等污垢
(3)碱性和合成洗涤剂
配成浓溶液即可。
用以洗涤油脂等一些有机物。
(4)有机溶剂洗涤剂
当胶状或焦油状的有机污垢如用上述方法不能洗去时,可选用丙酮、乙醚、苯等有机溶剂浸泡,同时应加盖以避免溶剂挥发或用NaOH的乙醇溶液亦可。
用有机溶剂作洗涤剂时,使用后可回收重复利用。
若用于精制或有机分析的器皿,除用上述方法处理外,还必须用去离子水冲洗。
器皿是否清洁的标志是:
加水倒置,水顺着器壁流下,内壁被均匀湿润着一层薄的水膜,且不挂水珠。
萃取与洗涤
基本原理:
萃取是利用物质在两种不互溶(或微溶)溶剂中溶解度或分配比的不同来达到分离。
提取或纯化目的的一种操作。
萃取是有机化学实验中用来提取或纯化有机化合物的常用方法之一。
应用萃取可以从固体或液体混合物中提取出所需物质,也可以用来洗去混合物中少量杂杂质。
通常称前者为“抽取”或萃取,后者为“洗涤”。
1.仪器的选择
液体萃取最通常的仪器是分液漏斗,一般选择容积较被萃取液大1-2倍的分液漏斗.
2.萃取溶剂
萃取溶剂的选择,应根据被萃取化合物的溶解度而定,同时要易于和溶质分开,所以最好用低沸点溶剂。
一般难溶于水的物质用石油醚等萃取;较易溶者,用苯或乙醚萃取;易溶于水的物质用乙酸乙酯等萃取。
每次使用萃取溶剂的体积一般是被萃取液体的1/5~1/3,两者的总体积不应超过分液漏斗总体积的2/3
3.操作方法
在活塞上涂好润滑脂,塞后旋转数圈,使润滑脂均匀分布,再用小像皮圈套住活塞尾部的小槽,防止活塞滑脱。
关好活塞,装入待萃取物和萃取溶剂。
塞好塞子,旋紧。
先用右手食指末节将漏斗上端玻塞顶住,再用大拇指及食指和中指握住漏斗,用左手的食指和中指蜷握在活塞的柄上,上下轻轻振摇分液漏斗,使两相之间充分接触,以提高萃取效率。
每振摇几次后,就要将漏斗尾部向上倾斜(朝无人处)打开活塞放气,以解除漏斗中的压力。
如此重复至放气时只有很小压力后,再剧烈振摇2~3min,静置,待两相完全分开后,打开上面的玻塞,再将活塞缓缓旋开,下层液体自活塞放出,有时在两相间可能出现一些絮状物也应同时放去。
然后将上层液体从分液漏斗上口倒出,却不可也从活塞放出,以免被