高考化学高无机综合推断大题培优.docx
《高考化学高无机综合推断大题培优.docx》由会员分享,可在线阅读,更多相关《高考化学高无机综合推断大题培优.docx(16页珍藏版)》请在冰豆网上搜索。
高考化学高无机综合推断大题培优
高考化学高无机综合推断(大题培优)
一、无机综合推断
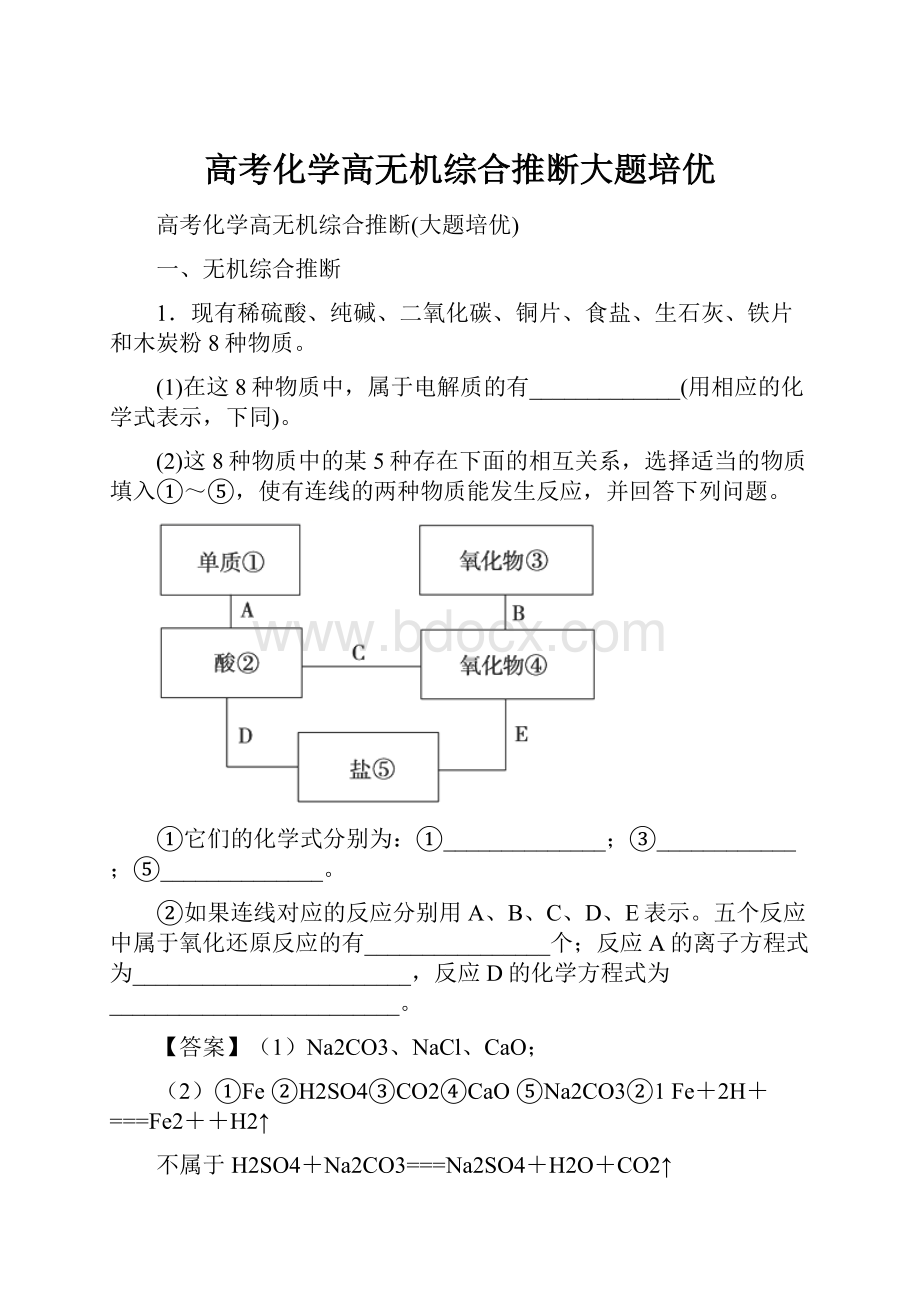
1.现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质。
(1)在这8种物质中,属于电解质的有_____________(用相应的化学式表示,下同)。
(2)这8种物质中的某5种存在下面的相互关系,选择适当的物质填入①~⑤,使有连线的两种物质能发生反应,并回答下列问题。
①它们的化学式分别为:
①______________;③____________;⑤______________。
②如果连线对应的反应分别用A、B、C、D、E表示。
五个反应中属于氧化还原反应的有________________个;反应A的离子方程式为________________________,反应D的化学方程式为_________________________。
【答案】
(1)Na2CO3、NaCl、CaO;
(2)①Fe②H2SO4③CO2④CaO⑤Na2CO3②1Fe+2H+===Fe2++H2↑
不属于H2SO4+Na2CO3===Na2SO4+H2O+CO2↑
【解析】
试题分析:
(1)电解质指的是在水溶液或熔融状态下能够导电的化合物,因此属于电解质的有Na2CO3、NaCl、CaO;
(2)单质①能够和酸②,则单质①为Fe,酸②为H2SO4;盐⑤能够和H2SO4反应,因此盐⑤为Na2CO3;氧化物④能够和H2SO4反应,因此氧化物④为碱性氧化物CaO;氧化物③能够和CaO反应,则氧化物③为CO2;故答案:
①Fe②H2SO4③CO2④CaO⑤Na2CO3;②有化合价升降的反应为氧化还原反应,在五个反应中,只有反应A为氧化还原反应;反应A的离子方程式为Fe+2H+===Fe2++H2↑;反应B为CO2和CaO的反应,不属于离子反应;反应D是Na2CO3和H2SO4的反应,反应的化学方程式为:
H2SO4+Na2CO3===Na2SO4+H2O+CO2↑。
考点:
考查物质的分类与性质。
2.氢能源是一种重要的清洁能源。
现有两种可产生H2的化合物甲和乙。
将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。
化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。
请回答下列问题:
(1)甲的化学式是__________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________。
(3)气体丙与金属镁反应的产物是__________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之__________(已知Cu2O+2H+=Cu+Cu2++H2O)。
【答案】AlH3
AlH3+3H2O=Al(OH)3↓+3H2↑Mg3N22NH3+3CuO
3Cu+N2+3H2O将固体溶于稀硫酸中,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O
【解析】
【分析】
将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液,因此白色沉淀是Al(OH)3,则金属单质是铝,因此甲是AlH3。
化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g·L-1,则丙的相对分子质量是1.25×22.4=28,因此丙是氮气,则乙是氨气NH3,据此解答。
【详解】
(1)根据以上分析可知甲的化学式是AlH3。
乙是氨气,含有共价键的共价化合物,电子式为
;
(2)甲与水反应生成氢气和氢氧化铝,反应的化学方程式是AlH3+3H2O=Al(OH)3↓+3H2↑。
(3)氮气与金属镁反应的产物是Mg3N2。
(4)氨气在加热条件下与CuO反应可生成Cu和氮气,根据原子守恒可知该反应的化学方程式为2NH3+3CuO
3Cu+N2+3H2O。
铜与稀硫酸不反应,则根据Cu2O+2H+=Cu+Cu2++H2O可知,要检验产物Cu中可能还混有Cu2O可以将固体溶于稀硫酸中,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O。
3.为探究某无结晶水的正盐X(仅含有两种短周期元素)的组成和性质,设计并完成下列实验。
(气体体积已转化为标准状况下的体积)
已知:
B是空气的主要成分之一;C是一种强碱,且微溶于水,载人宇宙飞船内常用含C的过滤网吸收宇航员呼出的CO2,以净化空气;D遇湿润的红色石蕊试纸变蓝。
(1)X的化学式为__________________。
(2)图中B的组成元素在元素周期表中的位置是______________。
(3)A的电子式为____________。
(4)X受热分解转变成A和B的化学反应方程式为____________。
【答案】LiN3第2周期VA族
3LiN3
Li3N+4N2↑
【解析】
【分析】
B是空气的主要成分之一,B为氮气或氧气;C是一种强碱,且微溶于水,C为LiOH,载人宇宙飞船内常用含C的过滤网吸收宇航员呼出的CO2,以净化空气,LiOH与反应生成Li2CO3;D遇湿润的红色石蕊试纸变蓝,D是NH3,确定B为氮气,NH3是2.24L合0.1mol,A中N为14g·mol-1×0.1mol=1.4g。
A为Li3N,3.5g中Li为3.5-1.4=2.1g,14.7gX中Li为2.1g,n(Li)=
=0.3mol,n(N)=
=0.9mol,n(Li):
n(N)=0.3:
0.9=1:
3,X的化学式为:
LiN3。
【详解】
(1)由分析可知:
X的化学式为LiN3。
故答案为:
LiN3;
(2)B为氮气,组成元素N在元素周期表中的位置是第2周期VA族。
故答案为:
第2周期VA族;
(3)A为Li3N,Li最外层只有1个电子,显+1价,N最外层5个电子,得三个电子,显-3价,电子式为
。
故答案为:
;
(4)由分析X的化学式为:
LiN3,X受热分解转变成Li3N和N2,由质量守恒:
化学反应方程式为3LiN3
Li3N+4N2↑。
故答案为:
3LiN3
Li3N+4N2↑。
4.A是一种红棕色金属氧化物;B、D是金属单质;J是一种难溶于水的白色化合物,受热易分解。
回答下列问题:
(1)A、E、J、G的化学式分别为___、___、___、___。
(2)C转化为I的离子方程式为___。
(3)H和I反应生成J的离子方程式为___。
(4)如何检验E溶液中大量存在的阳离子?
___。
【答案】Fe2O3FeCl2Al(OH)3Fe(OH)3Al2O3+2OH-═2AlO2-+H2OAl3++3AlO2-+6H2O═4Al(OH)3↓取E溶液2mL于试管中,滴入几滴KSCN溶液,无现象,再滴入几滴氯水,溶液呈血红色,则含有Fe2+
【解析】
【分析】
A是一种红棕色金属氧化物,则A是Fe2O3,红褐色沉淀G为Fe(OH)3,分解可以生成氧化铁,则F是 Fe(OH)2.B、D是金属单质,Fe2O3和B在高温下能反应生成金属单质D,则该反应是铝热反应,B是Al,D是Fe,C是Al2O3,J是一种不溶于水的白色化合物,受热容易分解成C,则J是Al(OH)3,由转化关系可知,I是NaAlO2,H是AlCl3;铁和盐酸反应生成氯化亚铁和氢气,E和氨水反应生成 Fe(OH)2,则E是 FeCl2,以此解答该题。
【详解】
(1)由以上分析可知,则A为Fe2O3,E是FeCl2,J是Al(OH)3,G是Fe(OH)3;
(2)氧化铝是两性氧化物,与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:
Al2O3+2OH-═2AlO2-+H2O;
(3)铝离子和偏铝酸根之间双水解而不共存,反应的离子方程式为Al3++3AlO2-+6H2O═4Al(OH)3↓;
(4)E是FeCl2,检验亚铁离子,可取E溶液2mL于试管中,滴入几滴KSCN溶液,无现象,再滴入几滴氯水,溶液呈血红色,则含有Fe2+。
5.探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X的化学式是____。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是____。
(3)高温条件下白色粉末与焦炭发生置换反应,写出该反应的化学方程式____。
【答案】Mg2SiO4或2MgO·SiO2SiO2+2OH-=SiO32-+H2OSiO2+2C
Si+2CO↑
【解析】
【详解】
无机盐X(仅含三种短周期元素),加入过量盐酸溶解,离心分离得到白色胶状物沉淀和无色溶液,白色胶状沉淀为硅酸,白色沉淀充分灼烧得到白色粉末1.80g为SiO2,物质的量=1.8g÷60g/mol=0.03mol,溶于氢氧化钠溶液得到无色溶液为硅酸钠溶液,说明无机盐中含硅酸根离子或原硅酸根离子,物质的量为0.03mol,若为硅酸根离子其质量=0.03mol×76g/mol=2.28g,金属质量=4.20g-2.28g=1.92g,无色溶液中加入过量氢氧化钠溶液生成白色沉淀则判断为Mg(OH)2,金属离子物质的量=3.48g÷58g/mol=0.06mol,质量为0.06mol×24g/mol=1.44g,不符合,则应为原硅酸根,物质的量为0.03mol,质量=0.03mol×92g/mol=2.76g,金属质量4.20g-2.76g=1.44g,物质的量=1.44g÷24g/mol=0.06mol,得到X为Mg2SiO4,则
(1)X的化学式是Mg2SiO4或2MgO·SiO2。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是SiO2+2OH-=SiO32-+H2O。
(3)高温条件下白色粉末与焦炭发生置换反应,该反应的化学方程式SiO2+2C
Si+2CO↑。
6.生氢材料甲由X、Y两种元素组成,两元素的原子最外层电子数相等。
为确定甲的组成,进行了如下实验:
①称取1.2g甲固体与一定量的水蒸气刚好完全反应,生成标准状况下1.12L可燃性单质气体乙,同时得到2g化合物丙。
②用0.05mol甲与0.8g氧气恰好发生化合反应,得到2g丙。
请回答:
(1)乙的分子式____。
(2)写出甲与氧气反应生成丙的化学方程式____。
(3)设计实验方案检验丙中的阴离子_____。
【答案】H22NaH+O2
2NaOH取少量丙溶液于试管中,向试管中滴加少量无色酚酞试液,若溶液变红,则说明有OH-的存在
【解析】
【分析】
由0.05mol甲与0.8g氧气恰好发生化合反应,得到2g丙,得甲的质量为:
2g-0.8g=1.2g,则M(甲)=
=24g/mol,根据甲由X、Y两种元素组成,甲是生氢材料,两元素的原子最外层电子数相等,可得符合条件的化合物为NaH,NaH可以与水蒸气反应生成氢气和氢氧化钠,反应的化学方程式为:
NaH+H2O(g)=H2↑+NaOH,符合题意,则乙为H2,丙为NaOH,据此分析。
【详解】
由0.05mol甲与0.8g氧气恰好发生化合反应,得到2g丙,得甲的质量为:
2g-0.8g=1.2g,则M(甲)=
=24g/mol,根据甲由X、Y两种元素组成,甲是生氢材料,两元素的原子最外层电子数相等,可得符合条件的化合物为NaH,NaH可以与水蒸气反应生成氢气和氢氧化钠,反应的化学方程式为:
NaH+H2O(g)=H2↑+NaOH,符合题意,则乙为H2,丙为NaOH;
(1)乙的分子式为H2;
(2)甲与氧气反应生成丙的化学方程式为2NaH+O2
2NaOH;
(3)丙中的阴离子为氢氧根离子,检验氢氧根离子的方法为:
取少量丙溶液于试管中,向试管中滴加少量无色酚酞试液,若溶液变红,则说明有OH-的存在。
7.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:
丙_________、乙_________。
(2)图中反应①②③④⑤⑥中属于氧化还原反应的有:
_____________________,属于置换反应反应的有:
_______________。
(3)写出反应⑤的离子方程式:
_____________________;
(4)写出反应①的化学方程式_______________________________,当得到标准状况下的甲气体2.24L,则参加反应的金属A____________g。
【答案】HClCl2①②③④⑤①③④
4.6
【解析】
【分析】
金属A焰色为黄色,则金属A为Na,与水反应生成H2和NaOH,故气体甲为H2,物质D为NaOH;NaOH与Al反应生成H2,故金属B为Al;黄绿色气体乙为Cl2,与H2反应生成HCl气体,则气体丙为HCl,物质E为盐酸;红褐色沉淀H为Fe(OH)3,物质G为FeCl3,物质F为FeCl2,金属C为Fe,据此答题。
【详解】
经分析得,金属A为Na,气体甲为H2,物质D为NaOH,金属B为Al,气体乙为Cl2,气体丙为HCl,物质E为盐酸,红褐色沉淀H为Fe(OH)3,物质G为FeCl3,物质F为FeCl2,金属C为Fe,
(1)丙为HCl;乙为Cl2;
(2)反应①②③④⑤⑥中属于氧化还原反应的有:
①②③④⑤,属于置换反应的有:
①③④;
(3)反应⑤的离子方程式:
;
(4)反应①的化学方程式:
;得到标准状况下的甲气体2.24L,则H2物质的量
;由化学方程式可知钠的物质的量
,则参加反应的钠质量
。
【点睛】
推断题的核心是找到关键突破口,本题的突破口为金属A焰色为黄色,气体乙为黄绿色气体,沉淀H为红褐色沉淀,这些特殊的焰色需要牢记。
8.已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。
(1)物质A的化学式为___,F化学式为___;
(2)B和R在溶液中反应生成F的离子方程式为___;
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,由此反应可知A有作为___的用途。
(5)M投入盐酸中的离子方程式___。
【答案】Na2O2H22Al+2OH-+2H2O=2AlO2-+3H2↑白色沉淀迅速变成灰绿色,最终变成红褐色4Fe(OH)2+O2+2H2O=4Fe(OH)32Na2O2+2H2O=4Na++4OH-+O2↑供氧剂Fe(OH)3+3H+=Fe3++3H2O
【解析】
【详解】
A为淡黄色固体,其能与水反应,则其为Na2O2;R是地壳中含量最多的金属元素的单质,则其为Al;T为生活中使用最广泛的金属单质,则其为Fe;D是具有磁性的黑色晶体,则其为Fe3O4;Na2O2与水反应生成NaOH和O2,所以C为O2;Al与NaOH溶液反应,生成偏铝酸钠和氢气,所以F为H2,B为NaOH;Fe3O4与盐酸反应,生成FeCl3、FeCl2和水,FeCl3再与Fe反应,又生成FeCl2,所以E为FeCl2;它与NaOH溶液反应,生成白色沉淀Fe(OH)2,它是H;Fe(OH)2在空气中被氧化为Fe(OH)3,它与盐酸反应生成FeCl3,它为W。
(1)物质A的化学式为Na2O2。
答案为:
Na2O2
F化学式为H2。
答案为:
H2
(2)NaOH和Al在溶液中反应生成H2的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
答案为:
2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)Fe(OH)2在潮湿空气中变成Fe(OH)3的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色。
答案为:
白色沉淀迅速变成灰绿色,最终变成红褐色
化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)Na2O2和水反应生成NaOH和O2的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
答案为:
2Na2O2+2H2O=4Na++4OH-+O2↑
由此反应可知A有作为供氧剂的用途。
答案为:
供氧剂
(5)Fe(OH)3投入盐酸中的离子方程式Fe(OH)3+3H+=Fe3++3H2O。
答案为:
Fe(OH)3+3H+=Fe3++3H2O
9.某种电镀废水含A阴离子,排放前的处理过程如下:
己知:
4.5g沉淀D在氧气中灼烧后,产生4.0g黑色固体,生成的无色无味气体通过足量澄清石灰水时,产生5.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标准状况下密度为1.25g·L-1的单质气体E560mL。
(1)E的结构式为____________。
(2)写出沉淀D在氧气中灼烧发生的化学方程式_______________________________。
(3)溶液B具有性质____________(填“氧化性”或“还原性”)。
(4)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,用离子方程式表示该反应为______________________________________。
【答案】
2CuCN+3O2
2CuO+2CO2↑+N2↑还原性2CN-+5ClO-+2H+=5Cl-+2CO2↑+N2↑+H2O
【解析】
【分析】
单质气体E的摩尔质量为1.25g·L-1×22.4L·mol-1=28g·mol-1,则E为N2,则n(N2)=
=0.025mol;沉淀D含有Cu,灼烧后产生的黑色固体为CuO,产生无色无味气体为CO2,n(CuO)=
=0.5mol,n(CO2)=n(CaCO3)=
=0.05mol;即D中含有0.05molCu、0.05molC、0.05molN,共4.5g,则D中不含其他元素,所以D为CuCN;则A离子为CN-。
【详解】
(1)经分析,E为N2,其结构式为
;
(2)D为CuCN,其灼烧的化学方程式2CuCN+3O2
2CuO+2CO2↑+N2↑;
(3)由题知,Cu(II)→Cu(I),该过程需要还原剂,A溶液不体现还原性,故B溶液具有还原性;
(4)用次氯酸钠把CN-氧化为无毒的二氧化碳和氮气,离子方程式为2CN-+5ClO-+2H+=5Cl-+2CO2↑+N2↑+H2O。
10.下列图示中,A、B是金属单质,E、K是非金属单质,其它为化合物,F、G、H、I、J焰色反应均为黄色,在这些物质中只有C、K是气体,其中K是黄绿色气体,反应⑧⑨是工业由H制I的重要反应。
填写下列空白:
(1)写出化学式:
B___,F___。
(2)写出反应①的化学反应方程式:
____。
(3)写出反应⑦离子反应方程式:
___。
【答案】MgNa2O22Mg+CO2
2MgO+COH-+CO2=HCO3-
【解析】
【分析】
由“K是黄绿色气体”,可确定K为Cl2;由“F、G、H、I、J焰色反应均为黄色”,可确定A为Na,则F为Na2O2,G为NaOH,H为NaCl。
由
可确定J为NaHCO3,C为CO2,I为Na2CO3。
金属单质B能与CO2反应,则B为Mg,从而得出D为MgO,E为C。
(1)从上面分析中,我们可确定B、C的化学式。
(2)反应①是Mg与CO2发生的置换反应,产物为MgO和C。
(3)反应⑦为过量CO2与NaOH反应生成NaHCO3。
【详解】
由“K是黄绿色气体”,可确定K为Cl2;由“F、G、H、I、J焰色反应均为黄色”,可确定A为Na,则F为Na2O2,G为NaOH,H为NaCl。
由
可确定J为NaHCO3,C为CO2,I为Na2CO3。
金属单质B能与CO2反应,则B为Mg,从而得出D为MgO,E为C。
(1)从上面分析中,我们可确定化学式:
B为Mg,F为Na2O2;答案为:
Mg;Na2O2;
(2)反应①是Mg与CO2发生的置换反应,产物为MgO和C,反应方程式为2Mg+CO2
2MgO+C;答案为:
2Mg+CO2
2MgO+C;
(3)反应⑦为过量CO2与NaOH反应生成NaHCO3,反应的离子方程式为
OH-+CO2=HCO3-。
答案为:
OH-+CO2=HCO3-。
【点睛】
框图题分析的思路为:
解题时,寻找解题的突破口至关重要,通常情况下,特殊的反应条件、特殊的反应现象、信息点多的某个反应,便是解题的突破口。
对于本题来说,我们容易推出A、F、G、H,解题的真正突破口是C物质的确定,也就是下列物质转化中C的确定,
。