届高考化学二轮复习化学常用计量学案全国通用1.docx
《届高考化学二轮复习化学常用计量学案全国通用1.docx》由会员分享,可在线阅读,更多相关《届高考化学二轮复习化学常用计量学案全国通用1.docx(25页珍藏版)》请在冰豆网上搜索。
届高考化学二轮复习化学常用计量学案全国通用1
第2讲 化学常用计量
知考点 明方向 满怀信心正能量
设问
方式
①有关阿伏加德罗常数的综合判断
[例](2018·全国卷Ⅰ,10),(2018·全国卷Ⅱ,10),
(2017·全国卷Ⅲ,10),(2017·海南卷,7)
②以“物质的量”为核心的多角度计算
[例](2018·全国卷Ⅲ,8)
③一定物质的量浓度溶液的配制
[例](2018·全国卷Ⅱ,11)
知识点 网络线 引领复习曙光现
释疑难 研热点 建模思维站高端
考点一 阿伏加德罗常数的应用
▼命题规律:
1.题型:
正误判断型选择题
2.考向:
以选择题的形式考查一定量的物质所含粒子(分子、原子、离子、质子、中子等)数目、氧化还原转移电子的数目、一定量的物质所含某种化学键的数目等。
▼方法点拨:
1.关于阿伏加德罗常数试题常设的“陷阱”
(1)气体摩尔体积的运用条件陷阱:
考查气体时经常给定非标准状况下(如25℃、1.01×105Pa)气体体积,考生易用22.4L·mol-1进行换算,误入陷阱。
(2)物质的聚集状态陷阱:
22.4L·mol-1适用对象是标准状况下的气体。
命题者常用在标准状况下非气态的物质来迷惑考生,如H2O、CCl4、辛烷、汽油、SO3、C6H6等。
(3)单质的组成陷阱:
气体单质的组成除常见的双原子分子外,还有单原子分子(如He、Ne等)、三原子分子(如O3)等。
(4)某些氧化还原反应中电子转移的数目陷阱:
命题者常用一些反应中转移电子的数目来迷惑考生,如Na2O2与H2O反应、Cl2与NaOH溶液反应、Fe与HCl反应、HNO3与过量Fe反应、电解CuSO4溶液等。
(5)物质的组成、结构陷阱:
如Na2O2是由Na+和O构成,而不是Na+和O2-;NaCl为离子化合物,只有离子没有分子;苯中不含碳碳单键和碳碳双键。
(6)电离、水解对溶液中离子数目的影响陷阱:
考查电解质溶液中离子数目或浓度时常设置弱电解质的电离、盐类水解方面的陷阱。
(7)可逆反应不能进行到底陷阱:
如2NO2N2O4、2SO2+O22SO3、合成氨反应、氯气和水反应等。
2.突破陷阱六法
(1)“两看”——是否是标准状况和气体状态,突破“Vm=22.4L/mol”陷阱;
(2)排“干扰”,突破“mnN与状态无关”陷阱;
(3)记“组成”,突破“物质组成混乱关系”陷阱;
(4)审“附加条件与反应要求”,突破“离子数目”判断陷阱;
(5)记“隐含反应”,突破“粒子组成、电子转移”判断陷阱;
(6)“分类”比较氧化还原类型、强弱用量、特殊反应,突破“电子转移”判断陷阱。
1.设NA为阿伏加德罗常数的值,下列说法正确的是__(5)(6)(9)(12)(13)__。
(1)16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA(2018·全国卷Ⅰ)
(2)92.0g甘油(丙三醇)中含有羟基数为1.0NA(2018·全国卷Ⅰ)
(3)1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA(2018·全国卷Ⅰ)
(4)常温常压下,124gP4中所含P—P键数目为4NA(2018·全国卷Ⅱ)
(5)标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA(2018·全国卷Ⅱ)
(6)0.1mol11B的原子中,含有0.6NA个中子(2017·全国卷Ⅲ)
(7)2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子(2017·全国卷Ⅲ)
(8)密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加2NA个P—Cl键(2017·全国卷Ⅲ)
(9)0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数为0.2NA(2017·全国卷Ⅱ)
(10)pH=1的H3PO4溶液中,含有0.1NA个H+(2017·全国卷Ⅲ)
(11)50ml12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA(2015·四川卷)
(12)钠在空气中燃烧可生成多种氧化物。
23g钠充分燃烧时转移电子数为1NA(2015·全国卷Ⅱ)
(13)1molS8
单质中含有的S—S键个数为8NA(2015·天津卷)
(14)2L0.5mol/L亚硫酸溶液中含有的H+数为2NA(2015·全国卷Ⅰ)
(15)1L0.1mol·L-1的NaHCO3溶液中HCO和CO离子数之和为0.1NA(2015·全国卷Ⅱ)
突破点拨
(1)化学键数目:
注意物质的结构特点;
(2)溶液中离子数目判断:
注意浓度和体积是否确定,注意是否发生水解和电离等变化;
(3)晶体中离子数目:
注意物质的真实组成;
(4)电子得失数目:
注意价态变化;
(5)化学反应前后微粒数目变化:
注意反应是否彻底。
解析 FeCl3水解不能彻底,而且一个Fe(OH)3胶粒不止含有一个Fe(OH)3,
(1)错误;92.0g丙三醇为1mol,而1mol丙三醇含有3mol羟基,
(2)错误;CH4和Cl2反应产物除CH3Cl外有CH2Cl2、CHCl3、CCl4等,(3)错误;白磷结构为
,每个P拥有1.5个P—P键,124gP4拥有6NA个P—P键,(4)错误;CH4和C2H4分子均含4个H原子,(5)正确;每个11B有6个中子,(6)正确;苯在标准状况下为液态,(7)错误;PCl3与Cl2的反应为可逆反应,(8)错误;H2和I2的反应虽然可逆,但该反应分子总数不变,(9)正确;溶液体积未知,无法确定离子数目,(10)错误;浓盐酸变稀后反应停止,(11)错误;Na与O2反应无论生成Na2O还是Na2O2,Na均为+1价,23g钠的物质量为1mol,充分燃烧时转移电子数为1NA,(12)正确;根据S8的分子结构模型可知,1个S8分子含有8个S—S键,所以1molS8中含有8NA个S—S键,(13)正确;H2SO3为弱酸,无法完全电离,(14)错误;根据物料守恒应可知HCO、CO、H2CO3个数之和为0.1NA,(15)错误。
【变式考法】设NA为阿伏加德罗常数的值,下列说法中正确的是__
(2)(8)(11)(12)__。
(1)46g分子式为C2H6O的有机物中含有的C—H键的数目为6NA(2018·湖南G10四调)
(2)8.4gNaHCO3和MgCO3混合物中含有阴离子数目为0.1NA(2018·湖南G10四调)
(3)1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为3NA(2018·江苏四市联考)
(4)1molNaHSO4固体中所含阴、阳离子数目总数为3NA(2018·江苏四市联考)
(5)标准状况下,44.8LNO与22.4LO2完全反应所得分子数目为2NA(2018·江苏四市联考)
(6)常温常压下,1.8g甲基(—CD3)中含有的中子数为NA(2018·江淮十校模拟)
(7)标准状况下,22.4LHF与0.5NA个H2O中含有的氢原子个数相同(2018·湖南十四校二调)
(8)含有NA个Fe(OH)3胶粒的氢氧化铁胶体溶液中,铁元素的质量远大于56g(2018·湖南十四校二调)
(9)10.4g苯乙烯分子中含有的碳碳双键数为0.4NA(2018·江淮十校模拟)
(10)1molNH4HCO3晶体中,含有NH、NH3和NH3·H2O的总数为NA(2018·湖北七市调考)
(11)将1molCl2通入足量NaOH溶液完全反应后,溶液中HClO、Cl-、ClO-粒子数之和为2NA(2018·湖北七市调考)
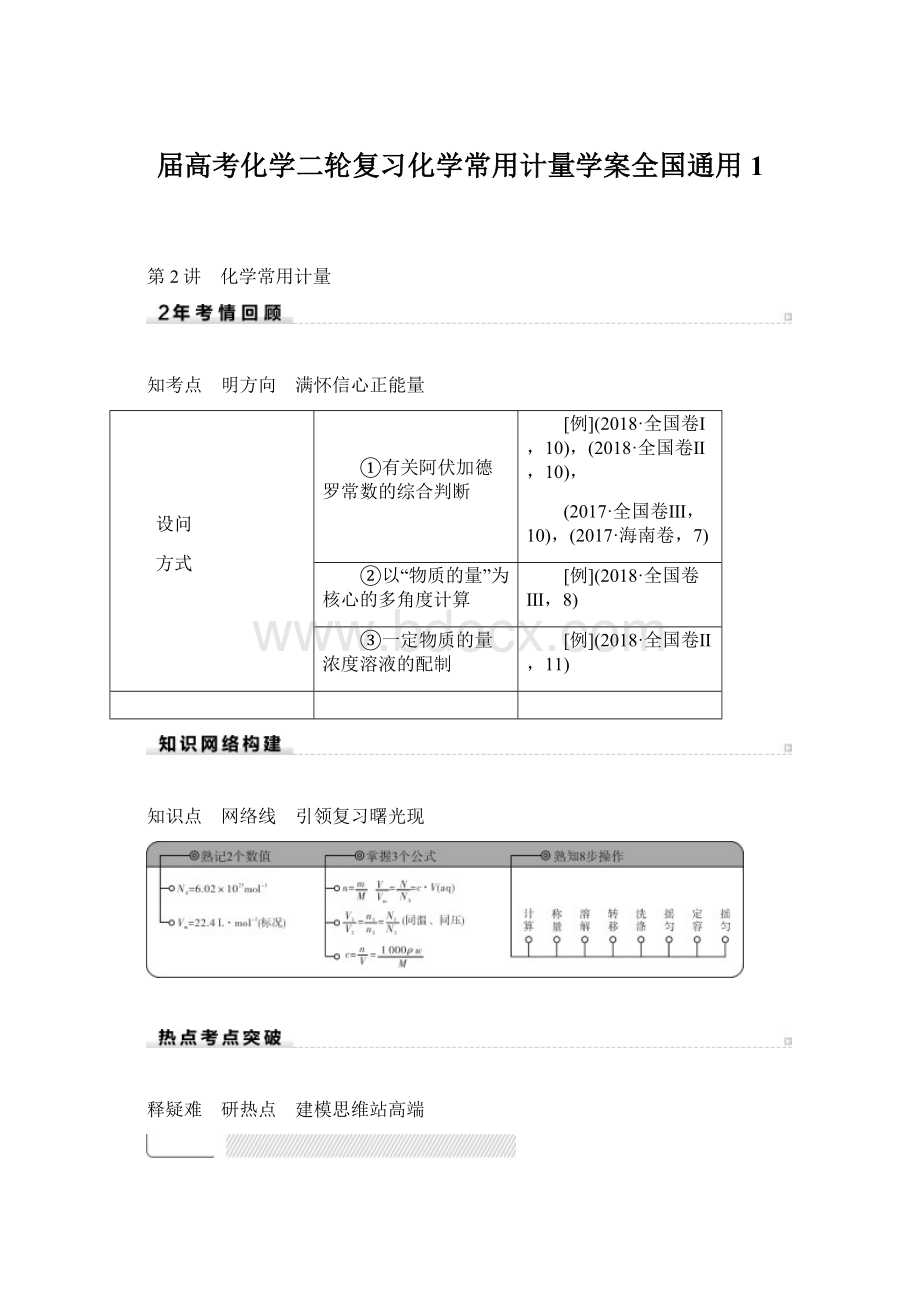
(12)
28gN60单质(如图)中含有的N—N键键数为3NA(2019·鄂东南新起点)
解析
(1)C2H6O可能为乙醇和甲醚,所以C—H键的数目无法确定,错误;
(2)NaHCO3和MgCO3二者摩尔质量相同,且阴离子数目相同,正确;(3)无论生成MgO还是Mg3N2,1molMg参与反应转移电子2mol,错误;(4)NaHSO4固体中离子为钠离子和硫酸氢根离子,二者比值1∶1,错误;(5)二氧化氮有部分转化为四氧化二氮,错误;(6)1.8g甲基(-CD3)的物质的量为=0.1mol,其中含有的中子为0.1mol×(6+1×3)=0.9mol,错误;(7)标准状况下HF是液体,错误;(8)每个氢氧化铁胶体粒子不止含有一个氢氧化铁,正确;(9)苯乙烯中苯环上不存在双键,所以每个苯乙烯分子只有一个双键,错误;(10)NH4HCO3晶体中只含有NH不存在NH3和NH3·H2O,错误;(11)根据氯元素守恒,正确;(12)由图可知,每个N原子分摊的键为1.5个,正确。
2.(2018·遂宁三诊)NA代表阿伏加德罗常数的值,下列叙述正确的是( B )
A.标准状况下,1.12LCCl4含有质子的数目为3.7NA
B.常温常压下,3.0g含葡萄糖的冰醋酸中含有的原子总数为0.4NA
C.常温时,56gFe与足量浓硝酸反应,转移的电子数目为3NA
D.晶体B的结构单元如图
,则11g晶体B含有0.6NA个三角形(相邻原子构成)
解析 标况下,CCl4是液体,选项A错误;葡萄糖(C6H12O6)与冰醋酸(C2H4O2)的混合物,最简式为(CH2O)n,3.0g混合物中有0.1molCH2O,原子总数为0.4NA,选项B正确;常温时,Fe与浓硝酸反应出现钝化现象,选项C错误;B的晶体中,一个三角形有三个B,每个B参与形成5个三角形,故一个三角形有0.6个B,则11gB,即1molB含有的三角形数为,选项D错误。
3.(2018·合肥八校模拟)设NA为阿伏加德罗常数的值,下列叙述正确的组合是( B )
(1)Ag+为NA个的AgNO3溶液中,NO个数大于NA
(2)60克乙酸、甲醛和葡萄糖混合物完全燃烧消耗2NA个O2
(3)5NH4NO32HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
(4)28g分子式为CnH2n的烃中含有的C—H键的数目一定为4NA
(5)高温下,16.8gFe与足量水蒸气完全反应转移电子数为0.8NA
(6)某温度下,1LpH=1的稀硫酸溶液中,H+离子数目一定为0.1NA
(7)一定温度下,6.4gS2、S4、S6、S8混合蒸气中,一定含有0.2NA个S原子
(8)用惰性电极电解KOH溶液,若阳极产生5.6L气体,则电路中通过0.5NA电子
A.
(1)
(2)(4)(5)(8)B.
(1)
(2)(4)(5)(6)(7)
C.
(2)(3)(5)(8)D.全部
解析 由于Ag+部分水解,当Ag+为NA个时,溶液中AgNO3大于1mol,NO个数大于NA,
(1)正确;由于乙酸、甲醛和葡萄糖的最简式均为CH2O,所以60g的乙酸、甲醛和葡萄糖混合物完全燃烧消耗2NA个O2,
(2)正确;反应时NH中的N全部转化为N2,而NO中N一部分转化为N2,另外一部分化合价不变转化为HNO3,每生成4molN2时,有5molNH被氧化,电子转移数目为15NA,所以生成56gN2,即2molN2时电子转移数目为7.5NA,(3)错误;CnH2n的最简式为CH2,28g分子式为CnH2n的烃中含有2molCH2,所含的C—H键的数目一定为4NA,(4)正确;高温下铁与水蒸气反应产生四氧化三铁,每3mol铁失去8mol电子,(5)正确;pH=1的溶液无论温度如何,c(H+)均为0.1mol/L,(6)正确;6.4gS2、S4、S6、S8混合蒸气中S原子为0.2mol,(7)正确;用惰性电极电解KOH溶液,阳极发