反应热中和热燃烧热的联系与区别.docx
《反应热中和热燃烧热的联系与区别.docx》由会员分享,可在线阅读,更多相关《反应热中和热燃烧热的联系与区别.docx(24页珍藏版)》请在冰豆网上搜索。
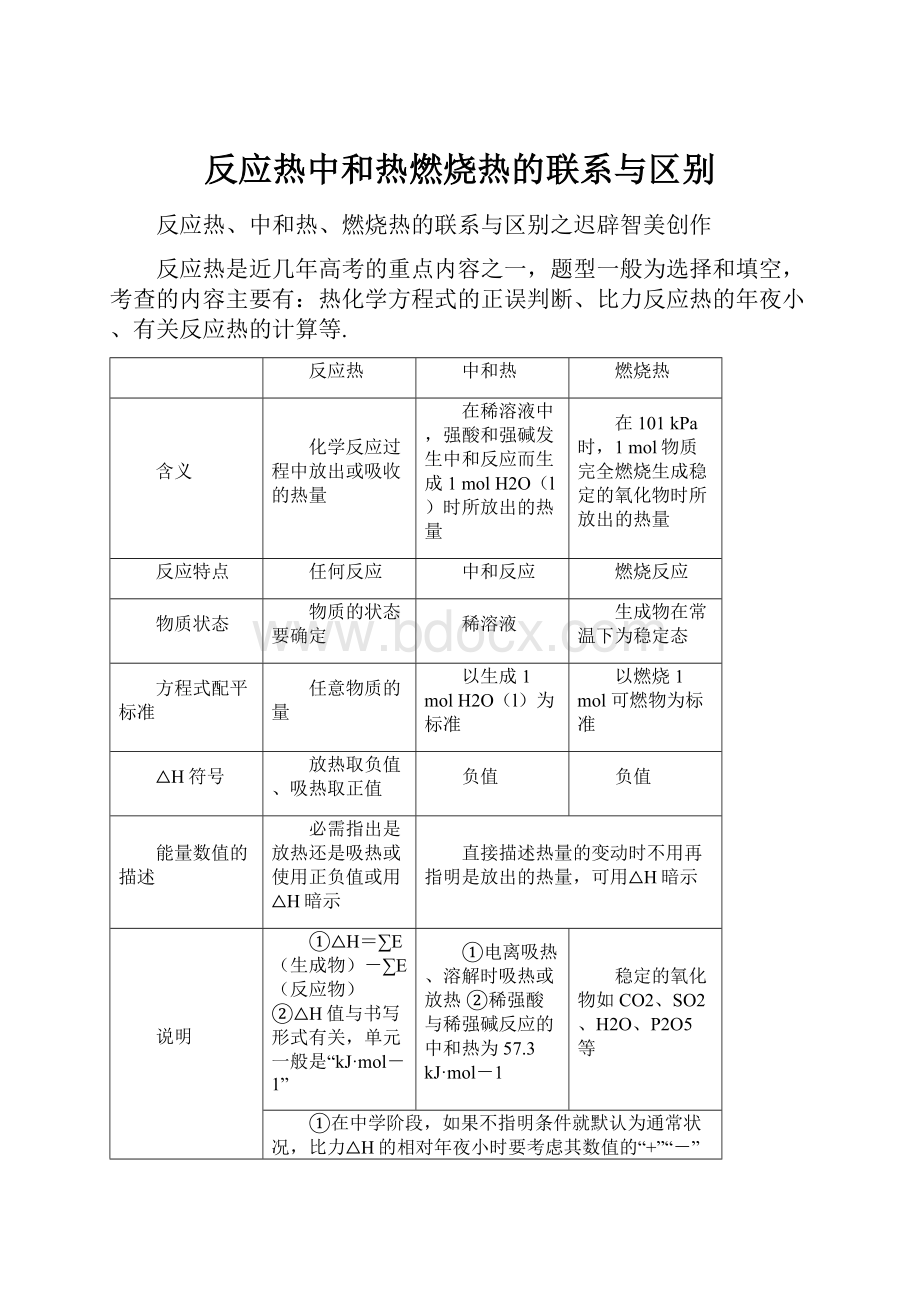
反应热中和热燃烧热的联系与区别
反应热、中和热、燃烧热的联系与区别之迟辟智美创作
反应热是近几年高考的重点内容之一,题型一般为选择和填空,考查的内容主要有:
热化学方程式的正误判断、比力反应热的年夜小、有关反应热的计算等.
反应热
中和热
燃烧热
含义
化学反应过程中放出或吸收的热量
在稀溶液中,强酸和强碱发生中和反应而生成1molH2O(l)时所放出的热量
在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量
反应特点
任何反应
中和反应
燃烧反应
物质状态
物质的状态要确定
稀溶液
生成物在常温下为稳定态
方程式配平标准
任意物质的量
以生成1molH2O(l)为标准
以燃烧1mol可燃物为标准
△H符号
放热取负值、吸热取正值
负值
负值
能量数值的描述
必需指出是放热还是吸热或使用正负值或用△H暗示
直接描述热量的变动时不用再指明是放出的热量,可用△H暗示
说明
①△H=∑E(生成物)-∑E(反应物)②△H值与书写形式有关,单元一般是“kJ·mol-1”
①电离吸热、溶解时吸热或放热②稀强酸与稀强碱反应的中和热为57.3kJ·mol-1
稳定的氧化物如CO2、SO2、H2O、P2O5等
①在中学阶段,如果不指明条件就默认为通常状况,比力△H的相对年夜小时要考虑其数值的“+”“-”的问题②用弱酸或弱碱的稀溶液进行中和反应时,每生成1molH2O(l)放出的热量小于57.3kJ
不能根据反应条件是否需要加热来判断一个反应是放热反应还是吸热反应,因为有些放热反应需要加热才华进行,而有些吸热反应在常温下也可自发进行.
实际上反应热就是反应物分子中旧的化学键断裂时所吸收的总能量与形成的生成物分子中新的化学键所释放的总能量之差.△H=∑E(反应物键能)-∑E(生成物键能).同样当“△H”为“-”即△H<0时为放热反应;反之,为吸热反应,这时“△H”为“+”即△H>0.
【例题1】(09重庆高考)下列热化学方程式书写正确的是(△H的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
解析:
A项燃烧热要求可燃物的物质的量必需为1mol,获得的氧化物必需是稳定的氧化物,即H2O的状态必需为液态,因此A选项毛病;中和反应是放热反应,△H应小于0,因此B选项毛病;热化学反应方程式要注明物质在反应时的状态,因此D选项毛病.只有C选项正确.谜底:
C
【例题2】(09四川高考)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ·mol-1.下列热化学方程式书写正确的是()
+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O
(1);△H=-57.3kJ·mol-1
B.KOH(aq)+H2SO4(aq)=K2SO4(aq)+H2O(l);△H=-57.3kJ·mol-1
8H18(l)+O2(g)=8CO2(g)+9H2O(g);△H=-5518kJ·mol-1
8H18(g)+25O2(g)=16CO2(g)+18H2O
(1);△H=-5518kJ·mol-1
解析:
中和热的标准是生成1molH2O(l)时所放出的热量,A项不符合中和热的界说;燃烧热要求必需生成稳定的氧化物,C项中生成物水为气态,应该为液态.D项中辛烷的物质的量不是1mol,D中△H=-11036kJ·mol-1才正确.所以ACD毛病.谜底:
B
点拨:
燃烧热、中和热概念的理解及热化学方程式的正确书写是解该题的关键.
【例题3】(08年海南高考)白磷与氧可发生如下反应:
P4+5O2===P4O10.已知断裂下列化学键需要吸收的能量分别为:
P-PakJ·mol-1、P-ObkJ·mol-1、P=OckJ·mol-1、O=OdkJ·mol-1.
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是()
A.(6a+5d-4c-12b)kJ·mol-1B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1D.(4a+5d-4c-12b)kJ·mol-1
解析:
由图可以看出1molP4中有6molP-P键,5molO2中有5molO=O键,1molP4O10中有4molP=O键、12molP-O键,所以△H=(6a+5d-4c-12b)kJ·mol-1.谜底:
A
点拨:
化学反应的实质就是旧化学键的断裂和新化学键的形成,在断裂和形成的过程中陪伴着能量的吸收和释放.
检测题
1、下列说法正确的是()
A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C.燃烧热或中和热是反应热的种类之一
D.在稀溶液中,1molCH3COOH和1molNaOH完全中和时放出的热量为
2、已知:
2CO(g)+O2(g)=2CO2(g);△H=–()
3、已知:
①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O
(1)△H=-下列结论正确的是()
A、碳的燃烧热年夜于110.5kJ/molB、①的反应热为-221kJ/mol
C、稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量
4、已知,在25℃、101kPa时,1molC(石墨)完全燃烧生成CO2气体,放热393.5kJ,1molCO完全燃烧生成CO2气体,放热283.0kJ.下列说法正确的是()
℃、101kPa时,C(石墨)燃烧生成CO气体的热化学方程式是2C(石墨)+O2(g)=2CO(g);△
B.C(石墨)不完全燃烧,生成CO2
C.C(石墨)和CO2(g)反应生成CO(g)的反应是吸热反应
D.如果金刚石燃烧生成CO2放出的热量年夜于石墨,则从石墨转酿成金刚石的变动需要吸热
5、(08四川卷)下列关于热化学反应的描述中正确的是()
A.HCl和NaOH反映的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热△H=2×(-57.3)kJ/molB.需要加热才华发生的反应一定是吸热反应
C.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=2×
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
知识要点:
反应热是一个矢量,吸热为+号,放热为—号.所以反应热必需带正负号,且只能用△H来暗示.在表述燃烧热和中和热时不带正负号,因为中和热和燃烧热不存在正负的问题,均用数值直接表达.(反应热、中和热和燃烧热三者而言:
即用△H暗示的时候标注+、—号,其余情况均都不标注)
一、正确理解“三热”概念
1、反应热:
在化学反应过程中反应自己放出或吸收的热量.在恒温恒压条件下的反应热用△H暗示,单元是kJ/mol,并规定放热反应的△H<0,吸热反应的△H>0.
2、标准燃烧热与热值
燃烧热是反应热的一种形式,使用燃烧热的概念时要理解下列要点.
①规定是在101kPa压强下测出热量.书中提供的燃烧热数据都是在101kPa下测定出来的.因为压强分歧,反应热有所分歧.
②规定可燃物的物质的量为1mol(这样才有可比性).因此,暗示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常呈现分数.例如,C8H18的燃烧热为5518kJ·mol-1,用热化学方程式暗示则为
C8H18(l)+
O2(g)=8CO2(g)+9H2O(l);△H=-5518kJ·mol-1
③规定生成物为稳定的氧化物.例如C→CO2、H→H2O(l)、S→SO2等.
C(s)+
O2(g)=CO(g);△H=-110.5kJ·mol-1C(s)+O2(g)=CO2(g);△H=-393.5kJ·mol-1
C的燃烧热为kJ·mol-1,而不是kJ·mol-1.
④叙述燃烧热时,用正值,在热化学方程式中用△H暗示时取负值.例如,CH4的燃烧热为kJ·mol-1,而△H=-890.3kJ·mol-1且必需以1mol可燃物燃烧为标准.
要与热值概念进行区别.热值:
1g物质完全燃烧的反应热叫该物质的热值.
3、中和热:
把在稀溶液中酸跟碱发生中和反应而生成1molH2O时的反应热叫中和热,单元是kJ/mol.燃烧热和中和热都属于反应热.
二、正确书写热化学方程式
1、ΔH只能写在标有反应物和生成物状态的化学方程式的右边,并用“;”隔开.若为放热反应,ΔH为<0:
若为吸热反应,ΔH为>0.ΔH的单元一般为kJ/mol.
2、注意热化学方程式中各物质化学式前面的化学计量数仅暗示该物质的物质的量,其实不暗示物质的个数.因此化学计量数可以是整数、也可以是分数.
3、反应物和产物的聚集状态分歧,反应热数值以及符号都可能分歧.因此,必需注明物质的聚集状态(s、l、g)才华完整地体现出热化学方程式的意义.热化学方程式中不用↑和↓.
4、由于ΔH与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必需与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍.
5、当反应向逆向进行时,其反应热与正反应的反应热数值相等,符号相反.
6、用中文暗示焓变时数值没有正负号,而用符号暗示焓变时数值必需注明正负号.如H2的燃烧热为285.8kJ/mol,△H=-285.8kJ/mol.
三、盖斯定律
1、界说:
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关.即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的.即
甲
乙,甲
丙
乙,ΔH=ΔH1+ΔH2.
2、应用
(1)利用关系图找出反应热之间的关系
①找起点和终点(起点是A,终点是C);②找途径:
一个是A→B→C,一个是A→C;③列式:
△H3=△H1+△H2.
(2)利用方程组找出反应热之间的关系
①找出中间产物(中间产物是B);②利用方程组消去中间产物:
反应c=反应a+反应b;③列式:
△H3=△H1+△H2.
四、键能、反应热和稳定性的关系
1、键能界说:
在101kPa、298K条件下,1mol气态AB分子全部拆开成气态A原子和B原子时需吸收的能量称AB间共价键的键能,单元为kJ·mol–1.
2、键能与反应热化学反应中最主要的变动是旧化学键发生断裂和新化学键的形成.化学反应中能量的变动也主要决定于这两个方面吸热与放热,可以通过键能计算获得近似值.
①放热反应或吸热反应旧键断裂吸收的能量年夜于新键形成放出的能量,为吸热反应;旧键断裂吸收的能量小于新键形成所放出的能量,该反应为放热反应.
②反应热化学反应中吸收或放出的热量称反应热,符号ΔH,单元kJ·mol–1,吸热为正值,放热为负值.可以通过热化学方程式暗示.反应热的年夜小与多个因素有关,其数据来源的基础是实验测定.由于反应热的最主要原因是旧化学键断裂吸收能量与新化学键形成放出能量,所以通过键能粗略计算出反应热.
ΔH(反应热)==反应物的键能总和—生成物键能总和.为方便记忆,可作如下理解:
断裂旧化学键需吸热(用+号暗示),形成新化学键则放热(用-号暗示),化学反应的热效应即是反应物和生成物键能的代数和,即ΔH=(+反应物的键能总和)+(—生成物键能总和),若ΔH<0,为吸热,若ΔH>0,为放热.
3、物质稳定性:
物质在反应中放出能量越多,则生成物能量越小,该物质越稳定,生成物中化学键越牢固.反之亦然.如:
同素异形体稳定性的比力:
根据△H正负和年夜小判断,反应放热,说明生成物能量小,较稳定.
五、误点警示
1、吸热反应一定需要加热才华发生吗?
答:
吸热反应纷歧定需要加热才华发生,如氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵晶体的反应为吸热反应,但只要用玻璃棒搅拌混合,温度即迅速降低,同时有安慰性气体发生,说明该反应已进行.加热只是反应所需的一种条件,放热、吸热取决于反应物总能量和生成物总能量的相对年夜小,只要反应物总能量年夜于生成物总能量,反应一定放热,反之,就一定吸热.有的放热反应如碳的燃烧需要加热到着火点才华进行.
2、中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离的吸热所陪伴的热效应.若反应过程中有其他物质生成,这部份反应热也不在中和热内.
以下反应热均非中和热:
①H2SO4(aq)+
Ba(OH)2(aq)==
BaSO4(s)+
H2O
(1)(此处还有BaSO4(s)的生成热);②NaOH(s)+HCl(aq)==NaCl(aq)+H2O(此处还有NaOH的溶解热);
③CH3COOH(aq)+NaOH(aq)==CH3COONa(aq)+H2O
(1)(此处还有CH3COOH电离热).
3、已知:
H2(g)+Cl2(g)=2HCl(g)ΔH=-184.6kJ·mol-1,能由此判断出氢气的燃烧热为184.6KJ·mol-1吗?
已知2C2H2(g)+5O2(g)
4CO2(g)+2H2O(l);△H=-2600kJ·mol-1,能说乙炔的燃烧热为-2600kJ·mol-1吗?
另外,物质的燃烧热年夜,其发生的火焰温度就高吗?
答:
“燃烧热”的界说是:
在101kPa时,1mol物质完全燃烧生成稳定的氧化物(或单质)时放出的能量.完全燃烧,是指物质中下列元素完全转酿成对应的物质:
C→CO2(g),H→H2O(l),P→P2O5(s),N→N2(g),S→SO2(g).生成不稳定的氧化物所放出的热量不是燃烧热,如:
C→CO(g),H→H2O(g).氢气在氯气中虽能燃烧,但其热效应却不是燃烧热,只能称为反应热.
燃烧热叙说有两种形式:
一是用文字暗示,此时只能用相应的数值和单元,不能用“—”号.如乙炔的燃烧热为1300kJ·mol-1;一是用△H暗示,此时需用负号暗示,如乙炔的燃烧热△H=-1300kJ·mol-1.火焰的温度与可燃物的燃烧热和热量损失(如生成的水等)有关.燃烧热相差不年夜时,生成的水越多,热量损失就越多,火焰温度就低.
【例题解析】
例1.已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是()
A.A的能量一定高于C
20090318
B.B的能量一定高于D
C.A和B的总能量一定高于C和D的总能量
D.该反应为放热反应,故不用加热就一定能发生
例2.关于吸热反应的说法正确的是()
A.凡需加热的反应一定是吸热反应B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
例3.在同温同压下,下列各组热化学方程式中,△H1>△H2的是()
A.2H2(g)+O2(g)==2H2O(g);△H12H2(g)+O2(g)==2H2O(l);△H2
B.S(g)+O2(g)==SO2(g);△H1S(s)+O2(g)==SO2(g);△H2
C.C(s)+
O2(g)==CO(g);△H1C(s)+O2(g)==CO2(g);△H2
D.H2(g)+Cl2(g)==2HCl(g);△H1
H2(g)+
Cl2(g)==HCl(g);△H2
例4.灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g);△H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g);△H2
③Sn(s、灰)
Sn(s、白);△H3
下列说法正确的是()
A.△H1>△H2B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
例5.下列各组热化学方程式中,化学反应的ΔH前者年夜于后者的是()
①C(s)+O2(g)====CO2(g);ΔH1C(s)+
O2(g)====CO(g);ΔH2
②S(s)+O2(g)====SO2(g);ΔH3S(g)+O2(g)====SO2(g);ΔH4
③H2(g)+
2O2(g)====H2O(l);ΔH52H2(g)+O2(g)====2H2O(l);ΔH6
④CaCO3(s)====CaO(s)+CO2(g);ΔH7CaO(s)+H2O(l)====Ca(OH)2(s);ΔH8
A.①B.④C.②③④D.①②③
例6.已知反应:
①101kPa时,2C(s)+O2(g)====2CO(g);ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-====(aq)H2O(l);ΔH=-57.3kJ·mol-1
下列结论正确的是()
A.碳的燃烧热年夜于110.5kJ·mol-1B.①的反应热为221kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
例7.25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ·mol-1、285.8kJ·mol-1、890.3kJ·mol-1、2800kJ·mol-1,则下列热化学方程式正确的是()
A.C(s)+
O2(g)====CO(g);ΔH=-393.5kJ·mol-1
B.2H2(g)+O2(g)====2H2O(g);ΔH=+571.6kJ·mol-1
C.CH4(g)+2O2(g)====CO2(g)+2H2O(g);ΔH=-890.3kJ·mol-1
D.
C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l);ΔH=-1400kJ·mol-1
例8.已知充沛燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4bkJ·mol—1l
B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=2bkJ·mol—1
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2bkJ·mol—1
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=bkJ·mol—1
例9.CH3—CH3→CH2=CH2+H2;有关化学键的键能如下.
化学键
C-H
C=C
C-C
H-H
键能(kJ·mol—1)
试计算该反应的反应热
例10.在氢气与氯气反应生成氯化氢气体的反应中,若断裂1molH-H键要吸收436KJ的能量,断裂1molCl-Cl键要吸收243KJ的能量,断裂1molH—Cl键要吸收432KJ的能量,则在氯气中充沛燃烧1molH2的能量变动是.
例11.将的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出热量,该反应的热化学方程式为_____________.
又已知:
H2O(g)=H2O(l);△H2=-44.0kJ·mol—1,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ.
例12.10g硫磺在O2中完全燃烧生成气态SO2,放出的热量能使500gH2O温度由18℃升至62.4℃,则硫磺的燃烧热为,热化学方程式为.
例13.实验室用50mL0.50mol·L-1盐酸、50mL0.55mol·L-1NaOH溶液和下图所示装置进行测定中和热的实验,获得表中的数据:
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是________________________,
不能用铜丝搅拌棒取代环形玻璃棒的理由是__________________________________.
(2)经数据处置,t2-t1=3.4℃.则该实验测得的中和热ΔH=_________〔盐酸和NaOH溶液的密度按1g·cm-3计算,反应后混合溶液的比热容(c)按4.18J·(g·℃)-1计算〕.
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:
ΔH1_________ΔH(填“<”“>”或“=”=,理由是________________________.
实验次数
起始温度t1/℃
终止温度t2/℃
盐酸
NaOH溶液
1
2
3
【专题训练与高考预测】
1.知
(1)H2(g)+
O2(g)=H2O(g);△H1=akJ/mol,
(2)2H2(g)+O2(g)=2H2O(g);△H2=bkJ/mol
(3)H2(g)+O2(g)=H2O(l);△H3=ckJ/mol,(4)2H2(g)+O2(g)=2H2O(l);△H4=dkJ/mol
下列关系式中正确的是()A.ad>0C.2a=b<0D.2c=d>0
2.强酸与强碱的稀溶液发生中和反应的反应热可暗示如下:
H+(aq)+OH-(aq)=H2
向1L1mol/L的NaOH(aq)中加入:
①稀醋酸②浓硫酸③稀硝酸恰好完全反应时的反应热为△H1、△H2、△H3,它们的关系正确的是( )
A.△H1>△H2>△H3B.△H2>△H3>△H1C.△H1=△H2=△H3D.△H1>△H3>△H2
3.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种
反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1
下列说法正确的是()
A.CH3OH的燃烧热为192.9kJ·mol-1B.反应①中的能量变动如右图所示
C.CH3OH转酿成H2的过程一定要吸收能量
D.根据②推知反应:
CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
4.下列有关热化学方程式及其叙述正确的是()
A.氢气的燃烧热为285.5kJ/mo1,则水电解的热化学方程式为:
2H2O
(1)=2H2(g)+O2/mo1
B.1mol甲烷完全燃烧生成CO2和H2O
(1)时放出890kJ热量,它的热化学方程式为1/2CH4(g)+O2(g)=1/2CO2(g)+H2O
(1);△H=-445kJ/mol
C.已知2C(s)+O2(g)=2CO(g);△H=-221kJ·mol-1,则C的燃烧热为110.5kJ/mo1
D.HF与NaOH溶液反应:
H+(aq)+OH—