物理化学复习(上).ppt
《物理化学复习(上).ppt》由会员分享,可在线阅读,更多相关《物理化学复习(上).ppt(41页珍藏版)》请在冰豆网上搜索。
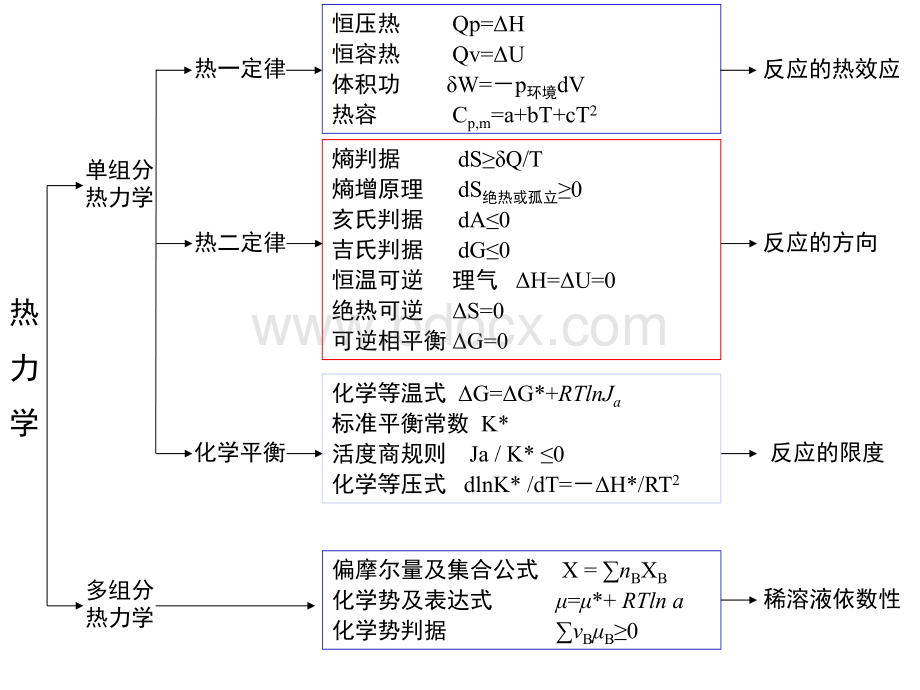
热力学单组分热力学多组分热力学热一定律热二定律化学平衡熵判据dSQ/T熵增原理dS绝热或孤立0亥氏判据dA0吉氏判据dG0恒温可逆理气H=U=0绝热可逆S=0可逆相平衡G=0恒压热Qp=H恒容热Qv=U体积功W=p环境dV热容Cp,m=a+bT+cT2反应的方向反应的限度反应的热效应化学等温式G=G*+RTlnJa标准平衡常数K*活度商规则Ja/K*0化学等压式dlnK*/dT=H*/RT2偏摩尔量及集合公式X=nBXB化学势及表达式=*+RTlna化学势判据BB0稀溶液依数性热热力力学学第第一一定定律律目的:
解决过程的目的:
解决过程的能量能量问题问题化学反应热效应化学反应热效应数学式:
数学式:
特定过程特定过程恒容过程:
恒容过程:
恒压过程:
恒压过程:
化学反应化学反应体积功体积功W=P环境环境dV热热力力学学第第二二定定律律目的:
解决过程的目的:
解决过程的方向和限度方向和限度问题问题数学式数学式通过卡诺热机得到通过卡诺热机得到孤立系统或绝热过程孤立系统或绝热过程特定过程特定过程恒容过程:
恒容过程:
恒压过程:
恒压过程:
热力学基本方程热力学基本方程派生公式派生公式麦克斯韦关系式麦克斯韦关系式吉吉亥方程亥方程热力学状态方程热力学状态方程演绎演绎推导推导应用应用化化学学反反应应热热效效应应等等温温反反应应非非等等温温反反应应化化学学反反应应方方向向反反应应方方向向反应限度反应限度恒容过程:
恒容过程:
恒压过程:
恒压过程:
任何过程:
任何过程:
绝热过程:
绝热过程:
熵判据熵判据熵增原理熵增原理计算计算11、主要公式主要公式凝聚态:
凝聚态:
Cp,m=Cv,mH=UQp=Qv2、题目类型与典型例题、题目类型与典型例题
(1)简单简单PVT过程热力学量计算过程热力学量计算解题要点:
直接代公式,确定公式所需物理量,可借助于解题要点:
直接代公式,确定公式所需物理量,可借助于PV图形象表示。
图形象表示。
(2)过程方向的判断:
过程方向的判断:
解题要点:
解题要点:
PVT过程用熵判据,过程用熵判据,SQ/T恒温恒压相变和化学反应用熵、吉布斯函数判据恒温恒压相变和化学反应用熵、吉布斯函数判据(3)化学反应中的应用:
化学反应中的应用:
求化学反应的反应热;求化学反应的反应热;H=Qp;U=Qv;判断化学反应方向。
判断化学反应方向。
例:
1mol双原子分子理想气体在0、101.3kPa下恒温可逆膨胀到0.224m-3,试计算此过程Q,W,U,H,S,S(环)及G。
解:
U=H=0V1=18.314273.2/(101.3103)=22.410-3m-3Q=W=18.314273.2ln(0.224/22.410-3)=5.23kJS=Q/T=5.23103/273.2=19.15J/KG=HTS=273.219.15=5.23103JS(环)=Q(可)/T=5230/273.2=19.15J/K例:
例:
1mol单原子分子理想气体,初态为25,202.6kPa:
(1)向真空膨胀至体积为原来的2倍;
(2)可逆绝热膨胀到-86.分别计算这两种过程的W,Q,U,H,S及G(已知初态时该气体的摩尔熵Sm=163.8J.K-1.mol-1).解:
(1)W=Q=U=H=0S=nRln(V2/V1)=18.314ln(2V/V)=5.76J.KG=H-TS=02985.76=-1717J=1.72kJ
(2)Q=0U=nCv(T2T1)=(3/2)8.314(187298)=1384J=1.38kJW=U=1.38kJH=nCp(T2T1)=(5/2)8.314(187298)=2307JS=0G=H(T2S2T1S1)=HST=2307163.8(187298)=15875J=15.9kJ例:
例:
1molCO(g)(设为理想气体)在设为理想气体)在298.15K、101.325kPa下下被被P(环)环)=5066.25kPa的压力压缩,直到温度的压力压缩,直到温度473.15K时才达平衡。
求过程的时才达平衡。
求过程的Q、W、U、H、S、G。
已知已知CO(g)在在298.15K、P时的时的Sm(CO,g)=197.67JK-1mo-1,Cv,m(CO,g)=20.785JK-1mo-1。
例:
在例:
在90、P下,下,1mol水蒸发水蒸发成成等温等压下的蒸气,求此过程的等温等压下的蒸气,求此过程的S、G,并判断此过程是否可能发生。
已知并判断此过程是否可能发生。
已知90时水的饱和蒸汽压为时水的饱和蒸汽压为7.012*104Pa,90时的可逆汽化热为时的可逆汽化热为41.10kJmol-1,100时的可逆汽化热为时的可逆汽化热为40.67kJmol-1,液态水和气态水的定压摩尔热容分别为液态水和气态水的定压摩尔热容分别为75.30JK-1mol-1和和33.58JK-1mol-1。
例:
101.3kPa下,1mol的100水与100的大热源相接触,经过两种不同的过程到达终态100,101.3kPa的水蒸气:
(1)保持压力不变;
(2)向真空膨胀.试分别计算这两种过程的Q,W,U,H,S,A及G并判断过程是否可逆.已知100,101.3kPa下水的气化热vapHm=40.71kJ.mol-1,Vm(l)=18.8103m3.mol-1,Vm(g)=3.02103m3.mol-1.解:
(1)W=p环境V=101.3103(3.0210318.8103)=3.06kJQ=H=40.71kJU=Q+W=40.713.06=37.65kJS=Q/T=40.71103/373=109.1J.KA=UTS=37.6540.71=3.06kJG=0在沸点下蒸发,故为可逆过程.由G=0也可判断U=37.65kJH=40.71kJS=109.1J.KA=3.06kJG=0S(环)=Q/T=(UW)/T=37.65103/373=100.9J.KS(总)=S+S(环)=109.1100.9=8.2J.K-10过程
(2)为不可逆过程
(2)向真空膨胀例:
例:
CaCO3(s)CaO(s)+CO2(g)fH-1206.8-635.09-393.51S92.940213.7fG-1128.8-604.2-394.36Cp,m37.1求:
求:
298K标准态标准态Qp,Qv500K标准态标准态Qp,Qv(rH=常数常数)判断此二状态下反应判断此二状态下反应方向?
方向?
是否有转折温度是否有转折温度?
是多少?
是多少?
解:
解:
(1)热化学计算:
)热化学计算:
298K标准态标准态Qp(298K)=rH(298K)=-Qv(298K)=Qp-RTng=rH(298K)-18.314298500K标准态标准态Qp(500K)=rH(500K)=rH(298K)+Cp,m(500-298)Qv(500K)=Qp-RTng=rH(500K)-18.314500
(2)反应方向判断:
)反应方向判断:
298K标准态标准态rG(298K)=-500K标准态标准态rS(298K)=-rG(500K)=rH(500K)-TrS(500K)rH(298K)-500rS(298K)(3)有转折温度)有转折温度多组分热力学偏摩尔量及集合公式X=nBXB化学势及表达式=*+RTlna化学势判据BB0稀溶液依数性概念1.偏摩尔量的定义及判断2.偏摩尔量的集合公式及杜亥姆公式3.化学势的定义及判断4.化学势判据及应用5.化学势的一般表达式及各种物质的化学势表达式6.稀溶液的依数性7.理想溶液的混合特征8.拉乌尔定律和亨利定律多组分系统热力学目的:
用热力学基本原理解决实际问题实际问题的提出:
纯物质B的Vm多组分系统中B的Vm偏摩尔量集合公式:
集合公式:
杜亥姆公式:
杜亥姆公式:
溶液化学势应用应用物质化学势的表达式及计算物质化学势的表达式及计算理想溶液稀溶液拉乌尔定律亨利定律稀溶液的依数性一、重要概念一、重要概念1、什么是偏摩尔量?
如何判别?
偏摩尔量意义?
满足的公式?
、什么是偏摩尔量?
如何判别?
偏摩尔量意义?
满足的公式?
2、什么是化学势?
如何用化学势判断多组分系统过程的方向?
、什么是化学势?
如何用化学势判断多组分系统过程的方向?
相平衡与化学反应在恒温、恒压、相平衡与化学反应在恒温、恒压、W=0,过程方向为化学势降低的方向。
过程方向为化学势降低的方向。
3、理想液态混合物的混合性质。
、理想液态混合物的混合性质。
4、各种物质的化学势表达式、各种物质的化学势表达式物质物质理想(混合)气体理想(混合)气体理想溶液理想溶液实际气体实际气体稀溶液稀溶液实际溶液实际溶液5、稀溶液的依数性、稀溶液的依数性
(1)蒸汽压降低;)蒸汽压降低;P=P*-P=P*XB。
(2)凝固点下降)凝固点下降;Tf=Tf*-Tf=R(Tf*)2MA/fusHm,AbB(析出固态纯溶剂)析出固态纯溶剂)=KfbB(3)沸点上升;沸点上升;Tb=Tb-Tb*=R(Tb*)2MA/vapHm,AbB(溶质不挥发)溶质不挥发)=KbbB(4)渗透压)渗透压。
=cRT(渗透平衡)渗透平衡)应用:
测定物质的分子量应用:
测定物质的分子量渗透压方法最灵敏,但只能测大分子渗透压方法最灵敏,但只能测大分子凝固点降低方法常用。
凝固点降低方法常用。
化学平衡反应的限度化学等温式G=G*+RTlnJa标准平衡常数K*活度商规则Ja/K*0化学等压式dlnK*/dT=H*/RT2概念1.化学等温方程2.化学平衡的热力学特点3.平衡常数的表达式4.气体平衡常数5.活度及活度商的概念6.活度商规则及应用7.化学平衡的影响条件8.平衡常数与温度的关系9.化学亲和式的定义及应用10.摩尔反应吉布斯函数与反应进度的关系化学平衡反应的限度化学等温式G=G*+RTlnJa标准平衡常数K*活度商规则Ja/K*0化学等压式dlnK*/dT=H*/RT2计算1.计算化学反应任意状态的摩尔吉布斯函数变且判断自发方向2.热力学方法计算标准平衡常数3.计算不同温度的平衡常数4.计算气体平衡的组成及转化率化学平衡目的:
解决过程的限度问题活度商规则平衡判据影响平衡移动的因素:
浓度、压力、温度平衡计算单一平衡反应同时平衡反应真实气体平衡反应热力学平衡平衡条件:
平衡常数:
实验测定计算化学反应等温方程一、重要概念一、重要概念1、热力学的平衡点。
、热力学的平衡点。
2、“标准标准”平衡常数中平衡常数中“标准标准”的含义。
的含义。
3、气体反应平衡中的平衡常数的关系。
、气体反应平衡中的平衡常数的关系。
4、平衡移动的方向。
(主要指惰性气体的影响)、平衡移动的方向。
(主要指惰性气体的影响)5、反应物配比对平衡转化率的影响。
、反应物配比对平衡转化率的影响。
6、平衡常数与温度的关系。
、平衡常数与温度的关系。
二、计算题类型与典型题目二、计算题类型与典型题目1、热力学量求平衡常数,即而求平衡量。
、热力学量求平衡常数,即而求平衡量。
2、已知平衡量,代入标准平衡常数表示式中,计算平衡常数,即、已知平衡量,代入标准平衡常数表示式中,计算平衡常数,即而求相应的热力学量。
而求相应的热力学量。
3、气体反应的平衡计算。
、气体反应的平衡计算。
例:
试求反应例:
试求反应CO(g)+H2O(g)=CO2(g)H2(g)在在298.15K和和1000K时的时的K。
解解:
1、计算温度、计算温度T时的标准平衡常数时的标准平衡常数例:
已知乙苯脱氢制苯乙烯反应例:
已知乙苯脱氢制苯乙烯反应C6H5C2H5=C6H5C2H5+H2,在在527时,时,Kp=4.750KPa,试计算乙苯在试计算乙苯在101.325KPa压力下的理论转化率和苯乙烯的摩尔分数压力下的理论转化率和苯乙烯的摩尔分数。
解:
解:
C6H5C2H5