连城一中学年上学期半期考高二化学试题Word文件下载.docx
《连城一中学年上学期半期考高二化学试题Word文件下载.docx》由会员分享,可在线阅读,更多相关《连城一中学年上学期半期考高二化学试题Word文件下载.docx(16页珍藏版)》请在冰豆网上搜索。
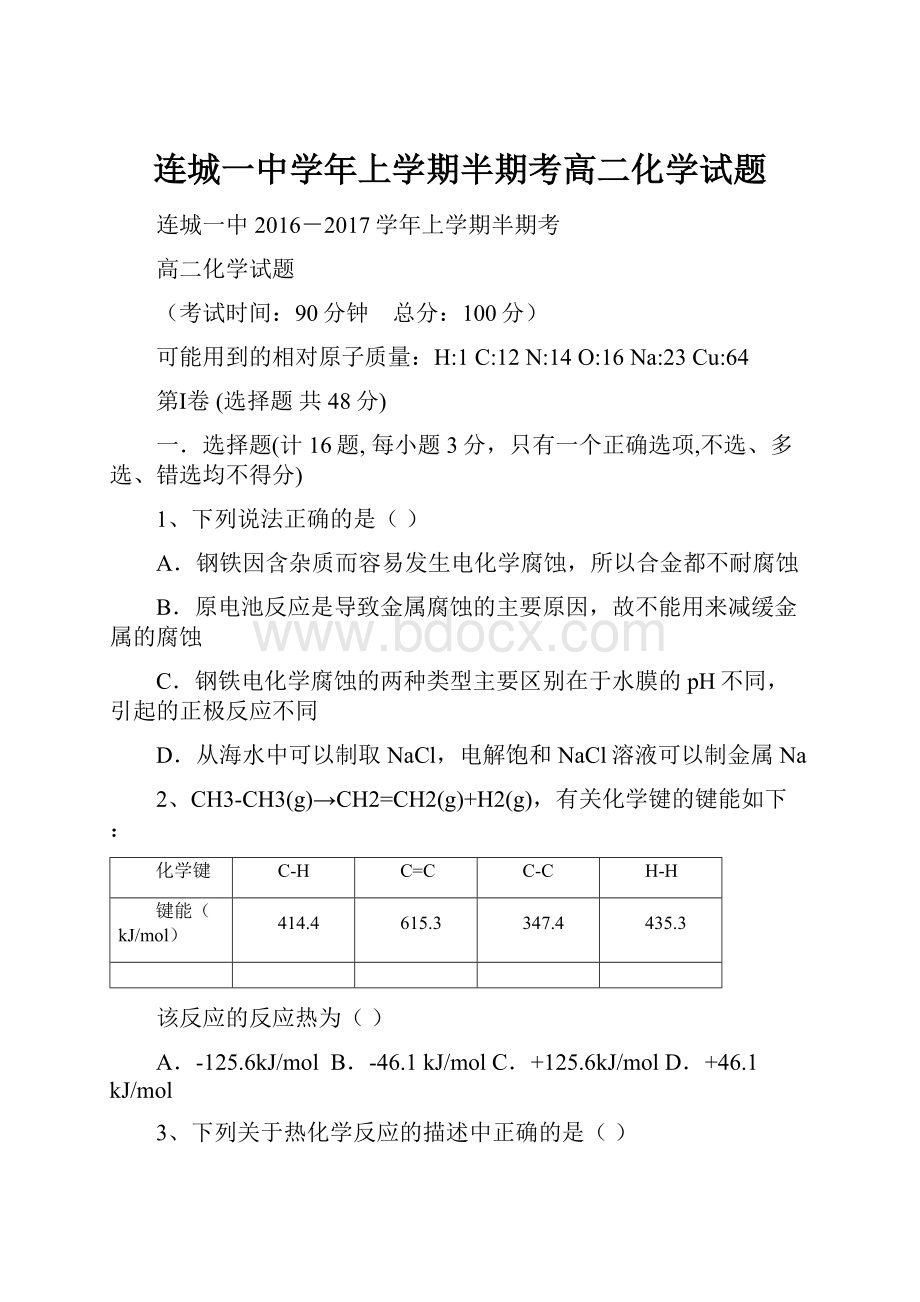
347.4
435.3
该反应的反应热为()
A.-125.6kJ/molB.-46.1kJ/molC.+125.6kJ/molD.+46.1kJ/mol
3、下列关于热化学反应的描述中正确的是()
A.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=2×
283.0kJ/mol
B.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×
(-57.
3)kJ/mol
C.由C(石墨)→C(金刚石)ΔH>
0,可知等量金刚石和石墨完全燃烧,后者放出的热量多
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
4、将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
5、下列实验装置,其中按要求设计正确的是()
6、最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2。
下列有关说法中正确的是()
A.该装置只有化学能转化为电能
B.导线中经过4mol的电子,氮化镓电极生成22.4LO2
C.氮化镓电极是阴极
D.铜电极表面的电极反应式:
CO2+8e-+8H+===CH4+2H2O
7、用惰性电极电解一定量的硫酸铜溶液,实验装置如下图甲。
电解过程中的实验数据如下图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。
则下列说法不正确的是()
A.电解过程中,a电极表面先有红色物质析出,后有气泡产生
B.b电极上发生的反应方程式为4OH-一4e-=2H2O+O2↑
C.曲线O一P段表示H2的体积变化
D.Q点时收集到的混合气体中H2和O2体积比为1:
1
8、锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是()
A.铜电极上发生氧化反应
B.电池工作一段时间后,乙池溶液的总质量增加
C.电池工作一段时间后,甲池的c(SO42-)减小
D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
9、在一定条件下,2L密闭容器中发生反应N2+3H2
2NH3,在2min内测得N2的物质的量变化了1mol,下列表示其化学反应速率正确的是( )
A.v(H2)=0.75mol·
L-1·
min-1B.v(N2)=0.5mol·
min-1
C.v(NH3)=1mol·
min-1D.v(NH3)=0.5mol·
s-1
10、硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3+H2SO4===Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·
L-1)
A
25
5
0.1
10
B
0.2
C
35
D
11、下列事实不能用勒夏特列原理解释的是()
A.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
B.增大压强可加快SO2转化为SO3的速率
C.黄绿色的氯水光照后颜色变浅
D.在含有Fe(SCN)3的红色溶
液中加铁粉,振荡静置,溶液颜色变浅或褪去
12、在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,则()
温度/℃
80
230
平衡常数
×
104
2
1.9×
10﹣5
A.上述生成Ni(CO)4(g)的逆反应为吸热反应
B.25℃时反应Ni(CO)4(g)
Ni(s)+4CO(g)的平衡常数为0.5(mol•L﹣1)3
C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol/L,则此时温度高于80℃
D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数增大
13、一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)
2CO2(g)+S(s)若反应在恒容的密闭容器中进行,下列有关说法正确的是()
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,逆反应速率减慢
C.平衡时,若升高温度,CO转化率减小,则该反应
的ΔH<0
D.其他条件不变,增加CO2的量,该反应平衡常数增大
14、已知2SO2(g)+O2(g)
2SO
3(g)ΔH
=-198.0
kJ·
mol-1。
若在500℃和催化剂的作用下,反应在容积固定的密闭容器中进行,下列有关说法正确的是()
A.该反应条件下,初始时向容器中充入2molSO2和1molO2,反应平衡时,可以释放198.0
kJ的热量
B.增大压强和升高温度有利于加快反应速率,但升高温度对平衡转化率不利
C.反应体系中,当混合物的密度保持不变,反应达到平衡
D.达到平衡时,SO2和SO3的浓度一定相等
15、对于可逆反应:
2A(g)+B(g)
2C(g)△H<0,下列各图中正确的是()
16、可逆反应aX+2Y(g)⇌2Z(g)在一定条件下达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如图.则下列说法正确的是( )
A.若X是固体,则t1时一定是增大了容器的压强
B.若X是气体,则t2时可能是增大了容器的压强
C.若X是固体,则t1时可能是增大了X的质量
D.t2时不可能是减小容器压强;
若采用了降温措施,则该反应的正反应方向△H<0
第Ⅱ卷(共52分)
二.填空题(共计52分)
17、(12分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
(1)大气臭氧层的分解反应是O3+O=2O2。
该反应的能量变化示意图如图所示。
则反应O3(g)+O(g)=2O2(g)的正反应的活化能为__________kJ·
(2)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,已知:
①CH4(g)+2O2(g)==CO2(g)+2H2O(l)△H=-akJ·
mol-1
②C(石墨)+O2(g)==CO2(g)△H=-bkJ·
③H2(g)+1/2O2(g)==H2O(l)△H=-ckJ·
写出由石墨生成甲烷的热化学方程式
又已知:
该反应为放热反应,
H-T
S可作为反应方向的判据,当
H-T
S<0时可自发进行;
则该反应在什么条件下可自发进行。
(填“低温”、“高温”)
(3)有右图所示的装置,
该装置中,b极的电极反应式为
Cu极为_________极;
当a极上消耗的O2在标准状况下的体积为11.2L时,铜片的质量变化为_________。
18、(8分)某校化学兴趣小组为了探究原电池工作原理,进行如下系列实验,请分析实验结果后回答相应
问题。
(1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小。
写出该原电池正极的电极反应式
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。
为什么锌失去的电子不能持续通过导线流向铜极给Cu2+?
________________________________________________________________________。
(3)实验三中盐桥中的K+流向溶液(填ZnSO4或CuSO4),
(4)实验四中,调节低压电源的电压到6V
,并把其正、负极分别与上图装置中的两个碳电极相连接;
接通电源,图示中的“+”连接到电源的正极上,“-”连接到电源的负极上,电解氢氧化钾溶液制取氢气、氧气,且制得的氢气与氧气的体积比为2∶1,去掉电源,该装置就成为一只氢氧燃料电池,用带有一小灯泡的导线连接a、b,灯泡即可发亮。
下列说法错误的是。
A.在电解KOH溶液制备H2和O2时,KOH的作用是增强溶液的导电性,一段时间后其浓度增大
B.当作为氢氧燃料电池时,c极发生氧化反应,d极发生还原反应
C.当作为氢氧燃料电池时,电解质溶液中的OH-向着d极移动
D.如将KOH溶液换成稀H2SO4,且作为氢氧燃料电池时,c极的电极反应为:
O2+2H2O+4e-===4OH-
19、(14分)已知NO2和N2O4可以相互转化:
N2O4(g)
2NO2(g) △H>0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
请回答下列问题:
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是
;
(2)能判断该反应是否达到化学平衡状态的依据是____________________;
A.容器中压强不变B.混合气体密度不变C.v逆(N2O4)=v正(NO2)D.c(NO2)︰c(N2O4)=2:
1E.混合气体中c(N2O4)不变
(3)a、b、c、d四个点中,表示化学反应处于平衡状态的是
,此时反应的平衡常数为
设第一次平衡常数为K1,第二次平衡常数为K2,则K1K2(填“>”“<”或“=”)
(4)若该容器中含有1molNO2、1.5molN2O4,这状态______
__(“是”或“否”)处于平衡状态?
若不是,反应向哪个方向进行?
__________________。
(选填“向正反应方向”、“向逆反应方向”)。
20、(6分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)
Si3N4(s)+6CO(g)
(1)上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。
(2)该反应的平衡常数表达式为K=。
升高温度,其平衡常数(选填“增大”、“减小”或“不变”)。
21、(4分)将1molI2(g)和2molH2置于2L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g)
2HI(g);
△H<0,并达平衡。
HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅲ)所示,在乙条件下w(HI)的变化如曲线(Ⅰ)所示。
则甲条件可能是,则乙条件可能是。
(填入下列条件的序号)
①恒容条件下,升高温度;
②恒温恒容条件下,加入适当催化剂;
③恒温条件下,扩大反应容器体积;
④恒温条件下,缩小反应容器体积;
⑤恒容条件下,降低温度。
22、(8分)现有反应:
mA(s)+nB(g)
pC(g)
,达到平衡后,当升高温度时,B的转化率变小;
当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应为________反应,且气体系数和的关系是。
(2)若容积不变加入B,则A的转化率__________,B的转化率__________。
(填“增大”、“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;
而维持容器内压强不变,充入氖气时,混合物颜色
。
(填“变深”、“变浅”或“不变”)
(4)若加入催化剂,平衡时气体混合物的总物质的量__________。
(5)若降低温度,则平衡时B、C的浓度之比将__________。
高二化学试题答题卷
第Ⅰ卷(共48分)
一、单项选择题(每小题3分,共48分)
题号
3
4
6
7
8
答案
9
11
12
13
14
15
16
第Ⅱ卷(共52分)
二、填空题:
17、(12分)
(1)
(2)(3分)(1分)
(3)
18、(8分)(每空各2分)
(1)
(2)
(3)
(4)
19、(14分)(每空各2分)
(4)
20、(6分,每空各2分)
(1)
(2)
21、(4分,每空各2分)
22、(8分,每空各1分)
(1)
(2)
(3)
(4)
(5)
高二化学试题参考答案
一、选择题(本大题共16小题,每小题3分,共48分)
D
(1)E1-E2(2分)
(2)C(石墨)+2H2(g)=CH4(g)△H=(-2c-b+a)kJ·
mol-1(3分),低温(1分)
(3)H2+
2OH-+2e-===2H2O(2分);
阳(2分),64g(2分)
18、(8分)
(1)Cu2++2e-===Cu
(2)未形成闭合的回路
(3)CuSO4 (4)BD(每空各2分)
(1)X
(2)AE(3)b;
0.9mol·
L-1;
=(4)否;
向正反应方向
20、(6分)(每空各2分)
(1)
(2)
减小
21、(4分)(每空各2分)③;
②④
22、(8分)(每空各1分)
(1)放n>p
(2)增大减小(3)变深变浅(4)不变(5)减小