15金属的电化学腐蚀与防护Word文档格式.docx
《15金属的电化学腐蚀与防护Word文档格式.docx》由会员分享,可在线阅读,更多相关《15金属的电化学腐蚀与防护Word文档格式.docx(17页珍藏版)》请在冰豆网上搜索。
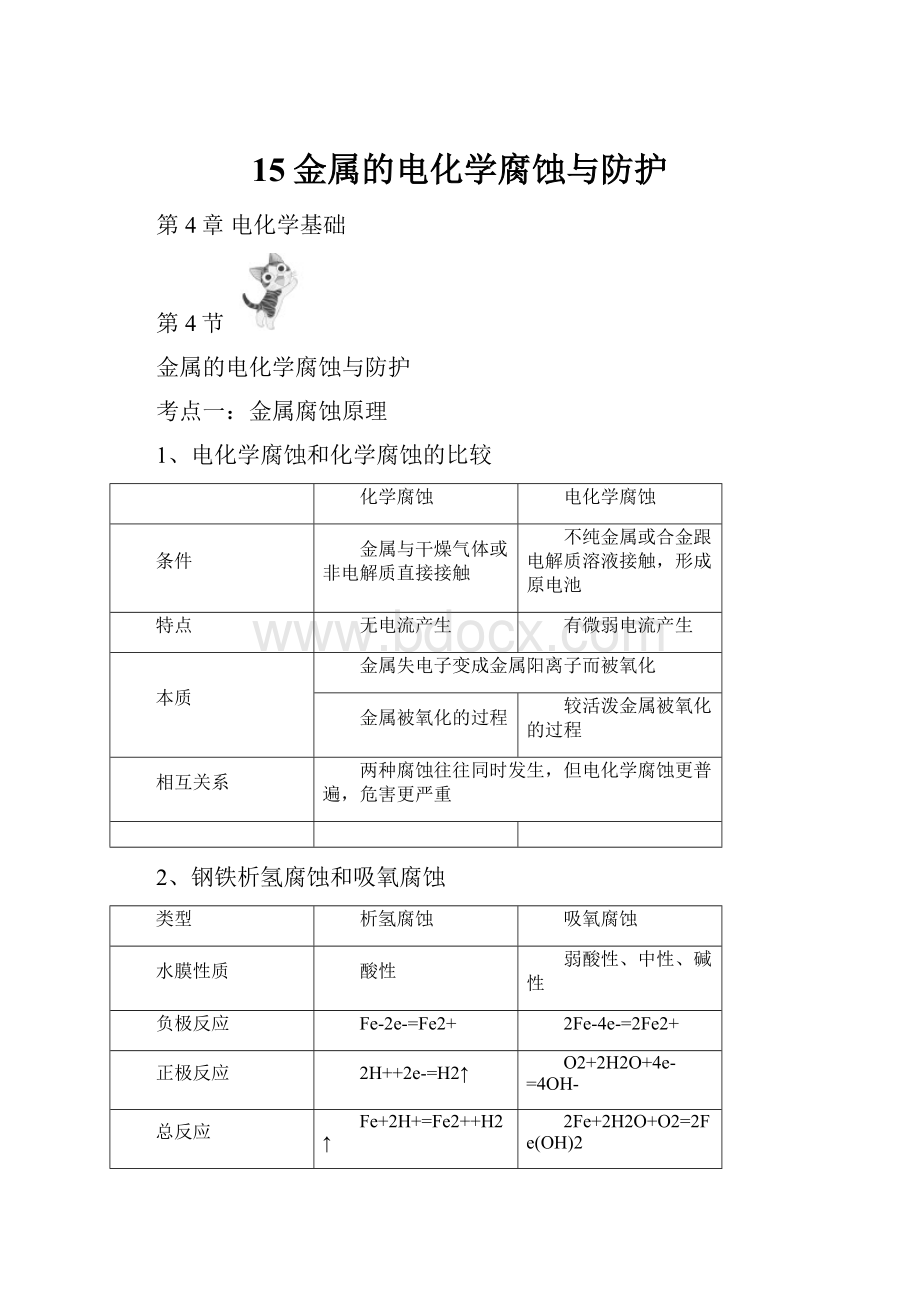
弱酸性、中性、碱性
负极反应
Fe-2e-=Fe2+
2Fe-4e-=2Fe2+
正极反应
2H++2e-=H2↑
O2+2H2O+4e-=4OH-
总反应
Fe+2H+=Fe2++H2↑
2Fe+2H2O+O2=2Fe(OH)2
联系
吸氧腐蚀更普遍
典型例题:
例1:
下列有关金属腐蚀的说法中正确的是( )
A.金属腐蚀指不纯的金属与接触到的电解质溶液进行电化学反应而损耗的过程
B.电化学腐蚀指在外加电流的作用下,不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,铁最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
考点二:
金属腐蚀快慢比较
1、影响金属腐蚀快慢的因素
(1)构成原电池的材料:
两极材料活动性相差越大,活泼金属被腐蚀的速率就越快
(2)金属所接触的溶液:
金属在电解质溶液中腐蚀速率快于在非金属中的腐蚀速率
金属在强电解质中的腐蚀速率快于在弱电解质中的腐蚀速率
2、金属腐蚀一般规律
(1)同种金属:
比较电解质溶液
(2)同种电解质:
较活泼金属被腐蚀
(3)电解原理腐蚀>
原电池腐蚀>
化学腐蚀>
有保护措施的腐蚀
(4)有防护措施:
外接电源阴极保护法>
牺牲阳极保护法>
一般防护保护法>
无防护
如图所示的各烧杯中盛有海水,铁在其中被腐蚀,腐蚀速率由快到慢的顺序为( )
A.⑤②①③④B.④③①②⑤C.⑤④②①③D.③②④①⑤
考点三:
金属腐蚀的防护方法
1、电化学防护法
(1)牺牲阳极的阴极保护法
(2)外加电源的阴极保护法
2、改变金属内部结构
3、涂防护层
(1)在钢铁表面涂矿物性油脂、油漆或覆盖搪瓷、塑料等。
(2)用电镀、热镀、喷镀的方法,在钢铁表面镀一层金属。
(3)用化学方法使钢铁表面生成一层致密而稳定的氧化膜。
下列各种方法中,能对金属起到阻止或减缓腐蚀作用的措施是()
①金属表面喷油漆
②改变金属的内部结构
③保持金属表面清洁干燥
④在金属表面进行电镀
⑤使金属表面形成致密的氧化物薄膜
A.①②③④B.①③④⑤C.①②④⑤D.全部
综合练习:
1、下列与金属腐蚀有关的说法中,不正确的是( )
A.钢铁在潮湿空气中生锈属于电化学腐蚀
B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀
C.金属腐蚀的本质是金属原子失去电子被氧化
D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应
2、如图所示是实验室研究海水对铁闸不同部位腐蚀情况的剖面图。
下列说法正确的是()
A.该电化学腐蚀为析氢腐蚀
B.图中生成铁锈最多的是C区域
C.A区域比B区域更易腐蚀
D.铁闸中负极的电极反应为Fe-2e-
Fe2+
3、下列关于金属腐蚀的说法正确的是( )
A.金属在潮湿空气中腐蚀的实质是:
M+nH2O
M(OH)n+
H2↑
B.金属的化学腐蚀的实质是:
M-ne-
Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀
4、为探究钢铁的吸氧腐蚀原理设计了如图所示的装置,下列有关说法中错误的是( )
A.正极的电极反应式为O2+2H2O+4e-
4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.分别向铁、石墨电极附近吹入O2,前者铁锈出现得快
5、对于下列各装置中产生的现象与原因的说法中正确的是()
6、一定条件下,碳钢腐蚀与溶液pH的关系如下:
下列说法不正确的是( )
A.在pH<
4的溶液中,碳钢主要发生析氢腐蚀
B.在pH>
6的溶液中,碳钢主要发生吸氧腐蚀
C.在pH>
14的溶液中,碳钢腐蚀的正极反应为O2+4OH-+4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢
7、下列与金属腐蚀有关的说法正确的是()
图a
图b
图c
图d
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
8、相同材质的铁在下图中各情形下最不易被腐蚀的是( )
A.B.
C.D.
9、
下列装置中电解质溶液均为稀硫酸。
对铁而言,体现的是外加电流的阴极保护法的是( )
A.B.C.D.
10、
埋在地下的钢管常用如图所示方法加以保护,使其免受腐蚀。
关于此方法,下列说法正确的是( )
A.金属棒X的材料可能为铜
B.金属棒X的材料可能为钠
C.钢管附近土壤的pH增大
D.这种方法称为外加电流的阴极保护法
11、
(1)图一、图二是铁钉在水中被腐蚀的实验。
①图一说明原溶液呈
,铁钉发生了
腐蚀。
②图二说明原溶液呈
(2)为了进一步探究图一实验中的腐蚀原理,某探究小组又设计了如下实验:
a.向100mL烧杯中加入约50mL饱和食盐水后,插入两个玻璃筒(无底);
b.将一枚无锈铁钉和一支碳棒分别用导线与电流表连接后,再分别插入两个玻璃筒中(装置如图所示);
C.1min后,向插入铁钉的玻璃筒内滴入2滴黄色的K3[Fe(CN)6](铁氰化钾)溶液;
d.向插入碳棒的玻璃筒内滴入几滴酚酞溶液。
请回答下列问题:
①b步骤中可观察到电流表指针发生了偏转,原因是
。
②c步骤中观察到的现象是
,表明
③d步骤中观察到的现象是
12、甲、乙、丙的电极材料都是铁棒与石墨棒,电解质溶液均为饱和NaCl溶液。
试回答下列问题:
(1)甲中石墨棒上的电极反应式为 。
(2)甲、乙、丙中铁棒腐蚀的速率由大到小的顺序为________________。
(3)将湿润的淀粉-KI试纸放在乙池附近,发现试纸先变蓝,一段时间后蓝色褪去,这是因为过量的Cl2将生成的I2氧化了。
若参加反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸,则该反应的化学方程式为__________________________。
若乙池转移0.02mol电子后停止实验,此时电解质溶液的体积是200mL(忽略气体在溶液中的溶解),则在常温下所得溶液的pH=________。
课后作业:
1、下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A.水中的钢闸门连接电源的负极
B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜
D.地下钢管连接镁块
2、将一根生铁棒垂直浸入水中,由于深水处溶解氧气量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是()
A.铁棒AB段发生反应为O2
+4e-
+2H2O
B.腐蚀过程中在铁棒上会产生微电流
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象是因为铁棒发生了电化学腐蚀
3、用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生腐蚀的装置及得到的图像如下。
分析图像,以下结论错误的是( )
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为Fe-2e-
4、下列有关金属腐蚀与防护的说法正确的是( )
A.在酸性环境下,钢铁只能发生析氢腐蚀
B.金属腐蚀的实质是金属失去电子被还原
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法
D.铜铁交接处,在潮湿的空气中直接发生反应:
Fe-3e-
Fe3+,继而形成铁锈
5、如图所示装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸,并使a、b两端液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( )
A.铁丝在两处的腐蚀速率:
a<
b
B.a、b两端相同的电极反应式为Fe-2e-
C.一段时间后,a端液面高于b端液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极
6、如图所示是探究铁发生腐蚀的装置。
发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。
下列说法不正确的是()
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-
D.析氢腐蚀的总反应式为2Fe+O2+2H2O
2Fe(OH)2
本章高考真题集锦:
1、(2014天津理综,6,6分)已知:
锂离子电池的总反应为:
LixC+Li1-xCoO2
C+LiCoO2
锂硫电池的总反应为:
2Li+S
Li2S
有关上述两种电池说法正确的是( )
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.下图表示用锂离子电池给锂硫电池充电
2、(2013课标Ⅱ,11,6分,)“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误的是 ( )
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为:
NiCl2+2e-
Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
3、(2015浙江理综,11,6分)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。
A.X是电源的负极
B.阴极的电极反应式是:
H2O+2e-
H2+O2-
CO2+2e-
CO+O2-
C.总反应可表示为:
H2O+CO2
H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1∶1
4、(2015四川理综,4,6分)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体。
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式:
Cl-+2OH--2e-
ClO-+H2O
C.阴极的电极反应式:
2H2O+2e-
H2↑+2OH-
D.除去CN-的反应:
2CN-+5ClO-+2H+
N2↑+2CO2↑+5Cl-+H2O
5、(2015重庆理综)我国古代青铜器工艺精湛,有很高的艺术价值和历史价值。
但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第________周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为________。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。
关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是________。
A.降低了反应的活化能B.增大了反应的速率
C.降低了反应的焓变D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。
如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为__________________________。
(5)如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是________(填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为________________________________________;
③若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为________L(标准状况)。