分析化学习题解答57页精选文档Word文档格式.docx
《分析化学习题解答57页精选文档Word文档格式.docx》由会员分享,可在线阅读,更多相关《分析化学习题解答57页精选文档Word文档格式.docx(51页珍藏版)》请在冰豆网上搜索。
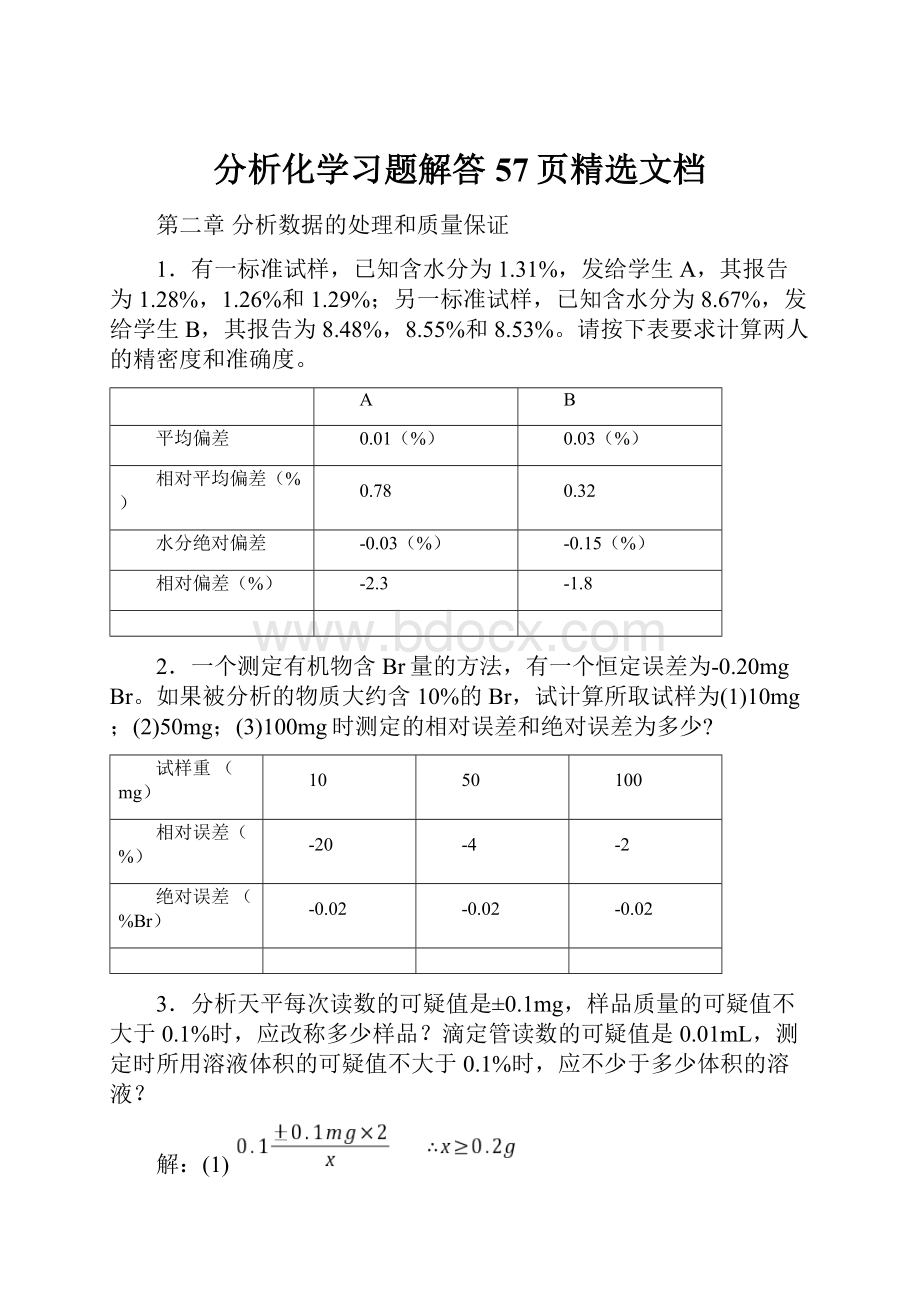
如测量的误差为10km,此数值应如何表示。
(1)准确度为±
0.1km
(2)表示为7.90×
103km
6.用基准Na2CO3标定0.1mol/LHCl溶液,欲消耗HCl溶液25mL左右,应称取多少克
Na2CO3。
从称量误差考虑能否达到相对误差小于0.1%的要求?
若改用硼砂(Na2B4O7·
10H2O)为基准物,应称多少?
称量的相对误差是多少?
若每次消耗HCl溶液为25ml,则:
F(Na2CO3)=106.0,
25×
10-3×
0.1×
106/2=0.13(g)
称量误差:
±
0.1mg×
2/0.13(g)×
100%=0.15%>
0.1%
F(Na2B4O7·
10H2O)=381.4
381.4/2=0.48(g)
2(mg)/0.48(g)×
100%=0.042%<
7.托盘天平读数误差为±
0.1g,分析样品应称至多少,才能保证可疑值不大于1%?
8.测定固体氯化物中氯的百分含量,结果为59.83,60.04;
60.45;
59.88;
60.33;
60.24;
60.28;
59.77。
计算
(1)分析结果的平均值;
(2)平均偏差和相对平均偏差;
(3)标准偏差和相对标准偏差。
(1)n=8
=60.10
=0.22
=0.37%
(3)s=
=0.26
CV=0.43%
9.若上题中试样为纯的氯化钠,平均结果的相对误差为多少?
纯NaClCl%=60.63%Er=-0.87%
10.第8题中,当置信度为95%时,平均值的置信区间为多少?
f=7t0.05,7=2.36
11.碳的原子量,经多次测定分别为12.0080,12.0095,12.0097,12.0101,12.0102,12.0106,12.0111,12.0113,12.0118和12.0120。
计算:
(1)平均值;
(2)标准偏差;
(3)99%置信度时平均值的置信区间。
12.已知某种测定锰的方法的标准偏差σ=0.12,用此法测锰的百分含量为9.56%。
假设此结果是由一次测定,四次测定和九次测定而得到的,分别计算95%置信度时平均值的置信区间。
计算结果说明什么?
13.分析工作者制定了测定氯的新方法。
用此法测定标准试样(含氯16.62%)中氯的百分含量,四次测定结果的平均值为16.72%,标准偏差S=0.08%,问测定结果与标准值之间是否存在显著性差异(95%置信度水平)?
14.分析者必须最少进行多少次的平行测定,才能使测得的平均值与真实值之差(
)有95%的概率不超过其单次测定的标准偏差?
如果把置信度定为99%,则测定次数又该是多少?
15.为了鉴定一个新光度法的精密度,通过多次测定的数据求得其透光度的标准偏差为0.15%T,试考虑由于仪器变动性的误差,需进行多少次的读数来求平均值才能达到下面的要求:
(1)95%置信区间为0.20%T;
;
(2)99%置信区间为0.10%T。
16.铁矿石标准试样的标准值为54.46%,某分析人员分析4次,得平均值54.26%,标准偏差为0.05%,问置信度为95%时,分析结果是否存在系统误差?
17.某汽车有车祸嫌疑,在事故现场发现有剥落的汽车油漆,对此进行了油漆中含Ti量的分析,结果为Ti%:
4.5,5.3,5.5,5.0,4.9。
调查了该汽车生产厂,了解到该汽车油漆的含Ti%量为4.3%,从含Ti量判断两油漆是否属同一样品,以此能否消除对该汽车肇事的嫌疑?
18.某学生标定HCl溶液的浓度,得到下列数据:
0.1011,0.1010,0.1012,0.1016mol/L。
根据
法,问有否可疑值需舍弃,然后报出平均值与平均值的置信区间(95%置信度)。
19.某试样中氯的百分含量经测定为30.54,30.52,30.60和30.12。
根据Q检验法,最后一个数据能否舍弃?
20.某学生测定矿石中铜的百分含量时,得到下列结果:
2.50,2.53,2.55,问再测定一次所得结果不应舍去的界限是多少?
(用
法估计)?
j
21.按有效数字计算下列结果:
22.将0.089gBaSO4换算为Ba,问计算时下列换算因素取何数较为恰当:
0.5884,0.588,0.59?
计算结果应以几位有效数字报出?
0.588恰当3位有效数字报出
23.用比色法测酚得到以下数据:
酚含量c(mg)
0.005
0.010
0.020
0.030
0.040
0.050
吸光度A
0.046
0.100
0.120
0.140
0.180
试求直线回归方程,并检验所确定的回归方程是否有意义。
与表中γ值比较:
95%置信度时:
n=6,γ0.95,6=0.811<γ计有意义。
24.用所给质量控制样品的测定数据,作
控制图,并说明其使用方法。
n
1
2
3
4
5
6
7
8
9
xi
5.00
4.98
4.92
4.94
4.97
4.99
5.02
4.96
5.08
4.95
11
12
13
14
15
16
17
18
19
20
5.04
5.03
497
`
x
5.01
0.04
0.02
0.08
0.06
0.03
0.09
0.05
图:
中心线
=4.99
U/LCL(控制上、下限)=
A2
=4.991.88×
0.04=4.990.075
U/LWL(警戒上、下限)=
A2
=4.99
×
1.88×
0.04=4.990.050
U/LAL(辅助上、下限)=
=4.99
0.04=4.990.025
R图:
中心线
=0.04
UCL(上控制限)=D4
=3.27×
0.04=0.13
LCL(下控制限)=D3
=0×
0.04=0
UWL(上警戒限)=
+=0.04+
(3.27×
0.04–0.04)
=0.11
控制图
使用方法:
由x图上可知,在20对双联数据中,有一对数据超出了下警戒线,但都在上、下控制线之内;
由R图可知,有二对数据落在下控制线上;
说明分析数据测定有失控的倾向,要引起重视;
必要时要查找失控的原因。
第三章分析科学中的溶液平衡
1.写出下列酸碱水溶液的质子恒等式
(1)NH4CN[HCN]+[H+]=[OH-]+[NH3]
(2)Na3PO4[HPO
]+2[H2PO
]+3[H3PO4]+[H+]=[OH]
(3)NaNH4HPO4[H2PO
]+2[H3PO4]+[H+]=[OH-]+[PO
]+[NH3]
(4)NH4H2PO4[H3PO4]+[H+]=[OH-]+[NH3]+[HPO2
]+2[PO
]
(5)NH3+NaOH[NH
]+[H+]=[OH-]-CNaOH
(6)(C1)HAc+NaAc(C2)[Ac-]+[OH-]–C2=[H+][HAc]+[H+]–C1=[OH-]
(7)H2SO4+H3BO3[H+]=[H2BO
]+[SO
]+[OH-]+CH2SO4
(8)NaH2PO4+HCl[H+]+[H3PO4]–CHCl=[HPO
]+[OH-]
2.计算pH=3.0时,0.050mol/L酒石酸钾溶液中的[C4H4O
]。
3.计算0.010mol/LH2C2O4溶液中的[C2O
]、[HC2O
]、[H2C2O4]。
4.计算下列溶液的`pH值
(1)0.0020mol/LH2SO4
(2)0.10mol/LHNO2
(3)0.200mol/LH3PO4
(4)0.100mol/L三乙醇胺
(5)0.0017mol/LHCOOH
(6)5.00×
10-8mol/LHCl
(7)0.0100mol/LH2O2
(8)0.0500mol/L氨基乙酸盐(+NHCHCOOH)
(9)0.100mol/LNa2S
(10)0.0100mol/LNaH2BO3
6.计算下列溶液的`pH值
(1)pH1.00的强酸溶液和pH14.00的强碱溶液等体积混合
(2)0.100mol/LNH4CN
(3)0.0500mol/L氨基乙酸
(4)0.0100mol/L硼砂
(5)0.0500mol/L邻苯二甲酸氢钾
(6)含有0.10mol/LHAc和0.0020mol/LNaAc的溶液
(7)0.200mol/LNaAc和0.1000mol/LHCl溶液等体积混合
(8)0.20mol/L乙二胺和0.10mol/L氨水的混合溶液
(9)与空气平衡的蒸馏水(含有1.35×
10-5mol/L的CO2)
7.1.0升0.10mol/LNH3溶液中,若溶解0.10mol固体NH4Cl(设体积不变),此NH3溶液的pH值改变多少?
8.100mL0.50mol/LNaOH中加入5.35gNH4Cl(假设体积不变),计算溶液的pH值。
9.配制氨基乙酸总浓度为0.1000mol/L的缓冲溶液(pH=2.00)100mL,需要氨基乙酸多少克?
还需加多少1mol/L的HCl或NaOH?
10.甲基红指示剂加入一未知pH的缓冲溶液,使用分光光度法测量出甲基红的碱式和酸式的比例是2.15∶1,计算溶液的pH值。
11.向0.10mol/LHAc和0.10mol/LH3BO3的混合物中加入与两酸之一等量的NaOH,计算加入碱后溶液pH值。
12.求下列混合溶液的pH值
(1)0.10mol/L甲酸和0.10mol/L醋酸
(2)0.10mol/L甲酸和0.10mol/L苯酚
13.计算含有0.08mol/L二氯乙酸和0.12mol/L二氯乙酸钠溶液的pH值。
14.25.0mL0.400mol/LH3PO4和30.0mLNa3PO4相混合稀释至100.0mL,计算此缓冲溶液的pH值及缓冲容量,准确吸取上述混合溶液25.00mL,需加入多少毫升1.00mol/LNaOH溶液,才能使溶液的pH值等于9.00。
15.从不同资料上查得Cu(Ⅱ)配位化合物的常数如下:
试按总形成常数(lgK形)从大到小,把他们排列起来。
16.某含Zn溶液中在pH=10.00时[NH3]为0.17mol/L,CCN-为0.03mol/L(除掉CN-与Zn2+配位以外的总浓度)。
(1)计算
(2)若CZn=1.0×
10-2mol/L,则[Zn2+]为多少?
有没有Zn(OH)2沉淀生成?
17.试计算在pH=5.0的0.10mol/LAlF
溶液中含有0.10mol/L游离的F-时
为多大?
18.在pH=7的溶液中,含有0.020mol/LZn2+、0.20mol/LCd2+,游离酒石酸根(Tart)浓度为0.20mol/L,加入等体积的0.20mol/LEDTA,计算
值。
已知Cd2+-Tart的lgβ1=2.8,Zn2+-Tart的lgβ2=8.32
19.50mL0.05000mol/L的金属离子M用0.05000mol/L的EDTA溶液滴定,当加入49,95mLEDTA溶液反应完全后,再加入0.10mLEDTA溶液试液的批pM值变化1个单位,计算MY配位化合物的条件形成常数。
20.计算0.10mol/LNH3·
H2O–NH4Cl溶液中的ZnY2-的
。
如果将溶液的pH调节到pH=10.0时,
等于多少?
21.将0.10mol/LZn–EDTA配位化合物溶解于1LNH3·
H2O–NH4Cl混合溶液中,已知溶解后的溶液中[NH
]=[NH3]=0.1mol/L,求[Zn2+]的浓度。
22.忽略离子强度影响,计算当[NH3]=1.0mol/L时的
已知
=0.80V,Ag+-NH3配位化合物的
23.计算在pH=3.0,CEDTA=0.01mol/L(未与铁配位的EDTA浓度)时Fe3+/Fe2+电对的条件电位。
24.试证明:
氧化还原反应中有H+参加,或者有不对称电对参加时,平衡常数计算公式(3–65)及(3-66)都是正确的。
25.分别推导KMnO4,K2Cr2O7滴定Fe(Ⅱ)时化学计量点电位的计算公式。
26.计算条件电位,判断反应方向,Hg能否溶于1mol/LHI溶液中?
27.于0.100mol/LFe3+和0.250mol/LHCl混合溶液中,通入H2S气体使之达到平衡,求此时溶液中Fe3+的浓度。
已知H2S饱和溶液的浓度为0.100mol/L,
28.50mL0.06mol/LK2CrO4溶液与50mL0.080mol/LAgNO3溶液混合,试计算Ag2CrO4的溶解度(只考虑同离子效应)。
29.计算CaF2在pH=2.00溶液中的溶解度。
30.考虑S2-的水解,计算MnS在水中的溶解度。
31.计算CaF2在pH=3.00的0.05mol/L的NH4HF2溶液中的溶解度。
32.计算AgBr在2.0mol/LNH3溶液中的溶解度。
33.计算AgCl在pH=8的配位剂B总浓度CB=0.10mol/L溶液中的溶解度。
已知BH+的Ka=1.0×
10-1,Ag(B)
的
34.计算CdS在pH3=9.0,NH3–NH
总浓度为0.3mol/L的缓冲溶液中的溶解度(忽略离子强度和Cd2+的氢氧基配位化合物的影响)。
35.考虑生成氢氧基配位化合物的影响,计算Zn(OH)2在pH=10时的溶解度。
此时溶液中Zn2+的主要存在形式是什么?
36.有1mmolAgCl,溶于500mL氨水后,氨水的平衡浓度为0.50mol/L,计算溶液中未配位的Ag+离子浓度。
若将20mmolAgCl放入上述氨水溶液中。
若[NH3]仍为0.50mol/L,[Ag+]又是多少?
37.为了防止由0.010mol/LAgNO3和0.010mol/LNaCk的混合液中产生AgCl沉淀,计算:
(1)混合溶液中游离NH3的最低浓度;
(2)混合溶液中所需NH3的最低总浓度。
38.将固体AgBr和AgCl加入到50.0mL纯水中,不断搅拌使其达到平衡,计算溶液中Ag+的浓度。
39.计算CaCO3在纯水中的溶解度和平衡时溶液的pH值。
40.计算100mL氨的游离浓度为0.2mol/L,pH=9.7的NH3–NH4Cl缓冲溶液中,可溶解多少克Ag2S
第四章滴定分析
1.用0.10mol/LHCl滴定0.10mol/LNa2CO3至甲基红变红色(或甲基橙刚变橙,即pH=4.4)时,溶液中还有多少HCO
未被滴定?
若此时把溶液加热煮沸赶去CO2,冷却后溶液的pH值为多少?
继续用HCl滴定时,化学计量点的pH为多少?
由计算结果说明用Na2CO3标定HCl时,近终点时加热溶液的必要性。
若不采用加热方法除去反应产物碳酸,则其滴定突跃很小,不能满足滴定准确度为0.1%要求。
2.两个一元弱酸HA1和HA2的混合溶液中
能否用0.3000mol/L的NaOH溶液分别滴定这两个一元弱酸?
若能分别滴定,计算滴定之前和第一、第二化学计量点的pH值。
如果测定HA1时的终点控制为pH=5.0,测定HA1的终点误差为多少?
3.用0.1000mol/LHCl溶液滴定20.00mL0.1000mol/LNaOH,若NaOH溶液中同时含有0.1000mol/LNaAc,计算化学计量点以及化学计量点前后±
0.1%时的pH值。
若滴定到pH=7.0,终点误差有多大?
4.下列酸碱能否用酸碱滴定法测定?
用什么滴定剂?
可选什么指示剂?
若不能直接滴定,可用什么方法使之适合用酸碱滴定法进行滴定?
(1)0.1mol/L盐酸羟氨
(2)0.1mol/L六次甲基四胺盐((CH2)6N4H+)
(3)0.1mol/LNaHS
(4)0.1mol/LNH4Cl
5.下列酸碱能否准确进行分步滴定与分别滴定,或准确滴定其中一个?
(1)0.1mol/L柠檬酸
(2)0.1mol/LH3AsO4
(3)0.1mol/LHAc+0.1mol/LH3BO3
(4)0.1mol/LHCOOH+0.1mol/LCH3COOH
(5)0.1mol/LNaOH+0.1mol/L(CH2)6N4
6.设计下列化合物的酸碱滴定方案,并写出计算式
(1)HCl和NH4Cl混合液
(2)H2SO4和H3PO4混合液
(3)NH4HCO3和NaHCO3混合液
(4)NaH2PO4和H3PO4混合液
7.有一含Na2CO3与NaOH的混合物。
现称取0.5898g溶于水中,用0.3000mol/LHCl滴定至酚酞变色时,用去HCl24.08mL,加甲基橙后继续用HCl滴定,又消耗HCl12.02mL。
试计算试样中Na2CO3与NaOH的百分含量。
8.将0.900g试样(内含一种弱酸HX,其摩尔质量为75.00)溶解于25.00mLH2O中,用0.1000mol/LNaOH溶液滴定,当一半酸被中和时pH=5.00,在化学计量点时溶液pH=8.85,计算试样中HX的百分含量。
9.某一元弱酸(HA)试样1.250g,用水溶解稀释至50mL,可用41.20mL0.090001mol/LNaOH滴定至酚酞变色,加入8.24mLNaOH时,溶液的pH=4.30。
(1)求此弱酸的摩尔质量
(2)计算弱酸的离解常数Ka。
(3)计算化学计量点时的pH值。
10.阿斯匹林(乙酰水杨酸)在胃中以游离酸形式被吸收。
一个病人事先服用了一种抗酸药,胃液中和到pH=2.95,然后服用5粒阿斯匹林药片(含乙酰水杨酸共0.65g)。
假定药片立即溶解并且不改变胃液的pH值,问将有多少阿斯匹林能马上被胃吸收?
(阿斯匹林的pKa=3.50,摩尔质量为180.2)
11用K氏定氮法测定血浆中蛋白质含量。
取2.00mL血浆经过硝解,产生的氨被蒸馏到硼酸溶液中,需用15.0mL标准HCl溶液滴定到甲基红终点。
此HCl溶液用(NH4)2SO4以同样方式标化,0.330g纯(NH4)2SO4需33.3mLHCl。
求血浆中蛋白质的含量g%(W/V)。
(由氮的质量换算蛋白质的质量时换算因子是6.25)
12.取25.00mL苯甲酸溶液,用0.1000mol/LNaOH溶液滴定到甲基红的变色点为终点,消耗20.70mL。
(1)求苯甲酸溶液的浓度。
(2)化学计量点的pH值。
(3)化学滴定误差。
已知:
苯甲酸的Ka=6.31×
10-5,甲基红的pKa=5.20
13.求用EDTA滴定Pb2+时的最高酸度。
14.铬蓝黑R指示剂H2In-是红色,HIn2-是蓝色,In3-是橙色,它的
,它与金属离子生成的MIn是红色的配合物。
(1)试问指示剂在不同pH时,呈现什么颜色,变色点的pH值是多少?
(2)它在多大pH范围内能用作金属指示剂?
15.用EDTA滴定5.0×
10-3mol/LCa2+(忽略稀释),在pH=12.00时,αCa(OH)=1.2。
(1)计算化学计量点时[Ca2+],pCasp。
(2)用铬蓝B作指示剂滴定到转变点为终点,已知lgKCaIn=5.7,指示剂的质子化常数lgKHIn=12.5,计算上述滴定终点的pCa。
(3)计算此滴定的终点误差。
(3)
16.溶液均为0.01000mol/L的Zn2+和Cd2+混合液加入过量KI,使终点时游离I-浓度为0.5mol/L。
在pH=5.0时,以二甲酚橙作指示剂,用等浓度的EDTA滴定Zn2+,计算终点误差。
17.将一份24小时尿样品,准确地稀释到2.00升,用EDTA滴定法滴定Ca2+和Mg2+百分含量。
(1)吸收10.