化学实验常见物质的检验.docx
《化学实验常见物质的检验.docx》由会员分享,可在线阅读,更多相关《化学实验常见物质的检验.docx(21页珍藏版)》请在冰豆网上搜索。
化学实验常见物质的检验
常见物质的检验
物质的检验可以是选择题,也可溶于推断、实验、简答题当中。
这部分内容以离子的检验、气体的制备和检验、元素及其化合物性质为知识基础,考查学生对材料的组织水平和语言表达能力。
重要知识点解析
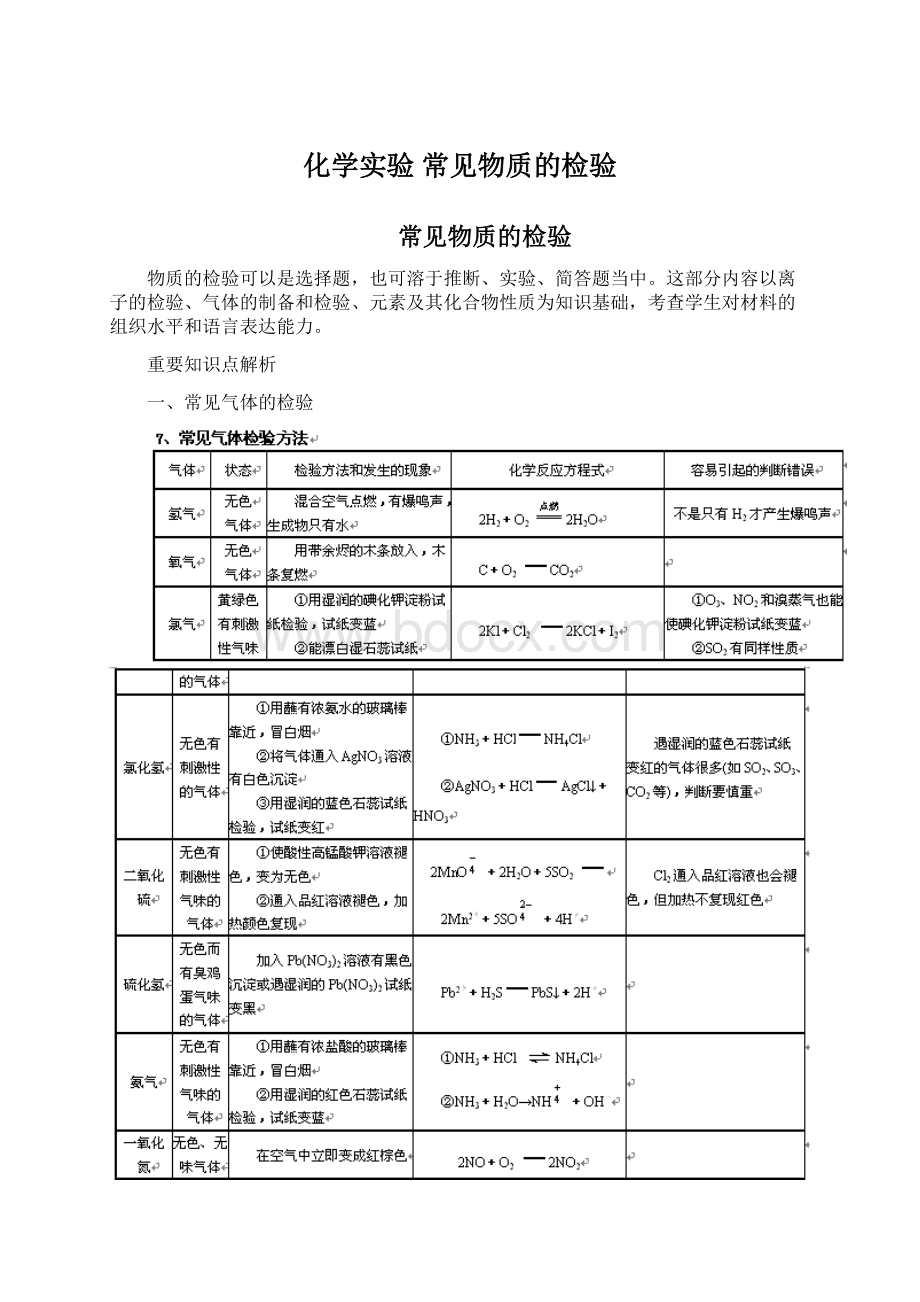
一、常见气体的检验
二、常见离子的检验
离子
试剂
现象
注意
沉淀法
Cl-、Br-、I-、
AgNO3+HNO3
AgCl↓白、AgBr↓淡黄、AgI↓黄
SO42-
稀HCl和BaCl2
白色沉淀
须先用HCl酸化
Fe2+
NaOH溶液
白色沉淀→灰绿色→红褐色沉淀
Fe3+
NaOH溶液
红褐色沉淀
Al3+
NaOH溶液
白色沉淀→溶解
不一定是Al3+
气体法
NH4+
浓NaOH溶液和湿润的红色石蕊试纸
产生刺激性气体,使试纸变蓝
要加热
CO32-
稀盐酸+石灰水
石灰水变浑浊
SO32-也有此现象
SO32-
稀H2SO4和品红溶液
品红溶液褪色
显色法
I-
Cl2水(少量),CCl4
下层为紫色
Fe2+
KSCN溶液,再滴Cl2水
先是无变化,滴Cl2水后变红色
Fe3+
①KSCN溶液
红色
②苯酚溶液
紫色
Na+、K+
Pt丝+HCl
火焰为黄色、浅紫色
K+要透过蓝色钴玻璃片
H+
能使紫色石蕊试液或橙色的甲基橙试液变为红色
Ba2+
能与稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸
Mg2+
能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液
Ag+
能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+
Cu2+
蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的CuO沉淀。
含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成
OH-
能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色
S2-
能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀
HCO3-
取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊。
或向HCO3-盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀MgCO3生成,同时放出CO2气体
PO43-
含磷酸根的中性溶液,能与AgNO3反应,生成黄色Ag3PO4沉淀,该沉淀溶于硝酸
NO3-
浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体
2.重要有机物及官能团的检验
有机物或官能团
检验方法
碳碳双键
碳碳三键
溴水、酸性KMnO4溶液:
褪色
卤原子
与NaOH溶液共热;加稀HNO3使溶液呈酸性;滴加AgNO3,看沉淀颜色来区分何种卤原子
酚羟基
加浓溴水,出白色沉淀,加FeCl3溶液,溶液呈紫色
醛基
加银氨溶液,水浴加热,出银镜
加Cu(OH)2悬浊液,加热,出红色沉淀
羧基
用指示剂,或加NaHCO3溶液,出无色气体
淀粉
加碘水或碘的四氯化碳溶液,溶液变蓝色
蛋白质
灼烧,有烧焦羽毛气味,加浓HNO3,变黄色(含苯环)
几种重要有机物的检验
(1)苯能与纯溴、铁屑反应,产生HBr白雾。
能与浓硫酸、浓硝酸的混合物反应,生成黄色的苦杏仁气味的油状(密度大于1)难溶于水的硝基苯。
(2)乙醇能够与灼热的螺旋状铜丝反应,使其表面上黑色CuO变为光亮的铜,并产生有刺激性气味的乙醛。
乙醇与乙酸、浓硫酸混合物加热反应,将生成的气体通入饱和Na2CO3溶液,有透明油状、水果香味的乙酸乙酯液体浮在水面上。
(3)苯酚能与浓溴水反应生成白色的三溴苯酚沉淀。
能与FeCl3溶液反应,生成紫色溶液。
(4)乙醛能发生银镜反应,或能与新制的蓝色Cu(OH)2加热反应,生成红色的Cu2O沉淀。
三、物质鉴别的几种主要类型
1.任意选择试剂的物质鉴别
这是指一般类型鉴别题。
它不限所用鉴别试剂的多少,只要求能简明扼要,一一区别开来即可。
比如,鉴别下列六种气体:
O2、Cl2、NH3、CO2、N2、空气。
对于此题可先观色,即黄绿色者为Cl2,后闻气味,即有刺激性气味的是NH3,其余再点燃,火焰无明显变化的是空气,燃烧更旺的是O2,火焰熄灭的是CO2和N2,再将CO2和N2分别通入石灰水,石灰水变浑浊的是CO2,不变的为N2。
2.限用一种试剂的鉴别题
这类题较前者更复杂,它要求只允许用一种试剂加以一一区别。
为此,我们所选用的那种试剂须能分别与被鉴别物反应,产生各种不同的现象才行,即被检物有几种就应产生几种不同的现象(包括没有明显变化也是一种现象)。
3.不用任何试剂的鉴别题
①利用某些物质的特殊性质(如颜色、气味、溶解性等),首先鉴别出来,然后再用该试剂去鉴别其他物质。
②采用一种试剂与其他物质相互反应的现象不同,进行综合分析鉴别。
它要求不准用任何外来试剂去参与物质鉴别。
为此,须掌握待鉴物之间相互鉴别之功能,或先加热或先观察所给物质颜色,或先水溶然后再相互滴加鉴别之。
如不用任何试剂,将HCl、BaCl2、NaOH、CuSO4四种溶液鉴别出来。
经观察,四种溶液中只有CuSO4溶液显蓝色,其余为无色。
把CuSO4溶液分别滴入另三种溶液中,有白色沉淀产生的原溶液为BaCl2溶液;有白蓝色沉淀产生的原溶液为NaOH溶液,剩余的为HCl溶液。
四、物质检验、鉴别、验证题的解题方法与技巧
物质的检验、鉴别与验证,既有相似之处,又有不同之处。
1.物质的检验:
要求从两种或两种以上的物质中检验出其中的某一种或几种物质。
常通过该物质的特殊性质予以确定。
2.物质的鉴别:
为两种或两种以上的物质组合,通过实验予以区别、区分。
常通过各种不同物质与某一种物质反应的不同现象予以区别。
3.物质的验证:
为一种或一种以上的物质组合,通过实验予以确证,并能回答是还是否。
对众多物质的组合,还要考虑验证的先后顺序。
4.关于未知溶液两两混合的推断题,一般采用列表法解比较简捷,若未知溶液较多,则注意从现象最明显,最容易推断的物质为突破口,然后再顺藤摸瓜推断出其他未知物质。
5.只允许用一种试剂鉴别的题目,由于限制了试剂的种类,因而也就增加了题目的难度。
要熟练解答这类习题,不但要熟练地掌握各类物质的性质和它们与某物质相互反应的规律及实验现象,而且还必须有科学的解题思路。
常见的解题思路有以下几种:
若几种溶液的酸碱性不同时,可选适当的指示剂或pH试纸鉴别。
②若几种溶液含有不同的阳离子,可考虑用强碱溶液与它们分别反应,根据生成物的颜色、稳定性,及在过量碱液中的溶解情况而加以鉴别。
③若几种溶液中含有不同的阴离子,可考虑使用强酸,根据生成物的状态、颜色、气味等差别加以鉴别。
④若几种物质间有的含有相同的阴离子,可考虑用既与相同的阳离子反应,又与相同的阴离子反应的试剂来鉴别。
⑤若被鉴别物质中有能强烈水解的盐,可考虑用与之能发生双水解反应且与该组中其他物质发生不同反应的盐溶液鉴别。
⑥鉴别有机物时,若被鉴别物质中含有醛基、羧基,应先考虑用新制得的Cu(OH)2悬浊液鉴别。
被鉴别物质中含有酚的,可考虑用Fe3+利用显色反应鉴别。
考点/易错点1评价型实验题
评价型实验题包括的题型很多,其中比较典型的有物质性质探究型、组成成分探究型、物质制备和应用探究型等,该类试题一般以实验装置图的形式给出实验的流程,其实验流程与考查内容一般为
1.气体制备装置的选择及注意事项
装置选择
注意事项
固体与固体
加热装置
①试管口应稍向下倾斜,防止产生的水蒸气在试管口冷凝后倒流而引起试管炸裂;②铁夹应夹在距试管口约1/3处;③胶塞中的导管伸入试管里面不能太长,否则会阻碍气体的导出
固体与液体
不加热装置
①块状固体与液体在常温下反应制备气体时可用启普发生器,如图甲,当制取气体的量不多时,也可采用简易装置,如图乙;②装置乙、丁、戊、己中长颈漏斗的下端应伸入液面以下,否则起不到液封的作用;③加入的液体反应物(如酸)要适当;④粉末状固体与液体反应或产物为糊状物时常采用装置丙
固体与液体液体与液体加热装置
①先把固体药品加入烧瓶中,然后滴加液体药品,要注意液体滴加的速度,保证产气速率平稳,易于收集;②若使用分液漏斗,则需要在滴液的过程中,打开漏斗活塞,以保证液体能够顺利滴下;③分液漏斗中的液体滴完后,要关闭漏斗活塞,防止气体经漏斗逸出;④装置乙中的温度计必须插在反应液中;⑤烧瓶加热需要垫石棉网
2.气体的干燥方法与干燥装置
气
体
的
干
燥
方
法
气体干燥选择干燥剂的原则
①不减原则:
即通过干燥操作之后,目标气体的量不能减少;②不反应原则:
干燥剂不能与目标气体反应
酸性
干燥剂
浓H2SO4
可以干燥H2、O2、N2、CO2、CO、Cl2、HCl、SO2、CH4和C2H4等气体
碱性
干燥剂
碱石灰
主要用于干燥NH3,但也可干燥H2、O2、N2、CO和CH4等
中性
干燥剂
CaCl2
可以干燥H2、O2、N2、CO2、Cl2、HCl和H2S等,但不能干燥NH3
气
体
的
干
燥
装
置
盛装液态干燥剂,用于干燥气体;也可以盛装其他液体试剂,用来对酸性或中性气体进行除杂
盛装碱石灰和CaCl2等固体干燥剂
甲装置可以盛装液体干燥剂或固体干燥剂,乙和丙装置只能盛装固体干燥剂
3.气体的收集装置及方法
排水法
①难溶或微溶于水,且与水不发生化学反应的气体,都可用排水集气法收集;②用排水集气法收集气体时,导管不伸入试管(或集气瓶)底部
向上排空气法
①比空气密度大的气体可用向上排空气法收集;②用排空气法收集气体时,导管一定要伸入集气瓶(或试管)底部,目的是把集气瓶(或试管)中的空气尽量排出;③为防止外界空气向集气瓶内扩散,集气瓶口可盖上毛玻璃片,若用试管收集时,可在试管口塞上一小团疏松的棉花
向下排空气法
比空气密度小的气体可用向下排空气法收集,如H2、NH3和CH4等气体
排特殊溶液法
①氯气可用排饱和食盐水的方法收集;②二氧化碳可用排饱和碳酸氢钠溶液的方法收集
4.常见尾气处理装置及方法
处理方法
液体吸收法
点燃法
收集法
处理装置
适用气体
装置A适用于吸收溶解度小的气体,如Cl2、CO2等;装置B、C可吸收溶解度大的气体,如HCl、HBr、NH3等
CH4、CH2===CH2、H2、CO等
CO、NH3、H2S等
高考热点题型评析
知识点:
溶液中的离子检验鉴别
例1(2011重庆理综,11)不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑他们间的相互反应)的试剂组是
A.盐酸、硫酸B.盐酸、氢氧化钠溶液
C.氨水、硫酸D.氨水、氢氧化钠溶液
【能力考查】
本题所考查的能力主要是分析、推断的能力,离子检验的识记能力。
【解析技巧——寻找解题思路】
鉴别的基本思路——
(1)鉴别主要是寻找各物质现象的不同,包括颜色、状态、气味、反应情况等。
(2)如果要加入试剂进行鉴别,一定要先取样,不能直接对样品进行鉴别。
(3)选用鉴别方法时先简单后复杂,先考虑物理方法后化学方法。
本题的解题要点,是要清楚地推断出当混合溶液先后加入各种试剂时,一是试剂与溶液中的离子会发生什么化学反应;二是先加入的试剂对后加入的试剂是否有影响;三是生成物与溶液形成的是怎样的不同状态。
物质的鉴别一般可用其性质包括物理性质如颜色、状态、气味及溶解性等。
四种物质均属于无色无味的溶液,