酸 碱 盐的定义及组成文档格式.docx
《酸 碱 盐的定义及组成文档格式.docx》由会员分享,可在线阅读,更多相关《酸 碱 盐的定义及组成文档格式.docx(8页珍藏版)》请在冰豆网上搜索。
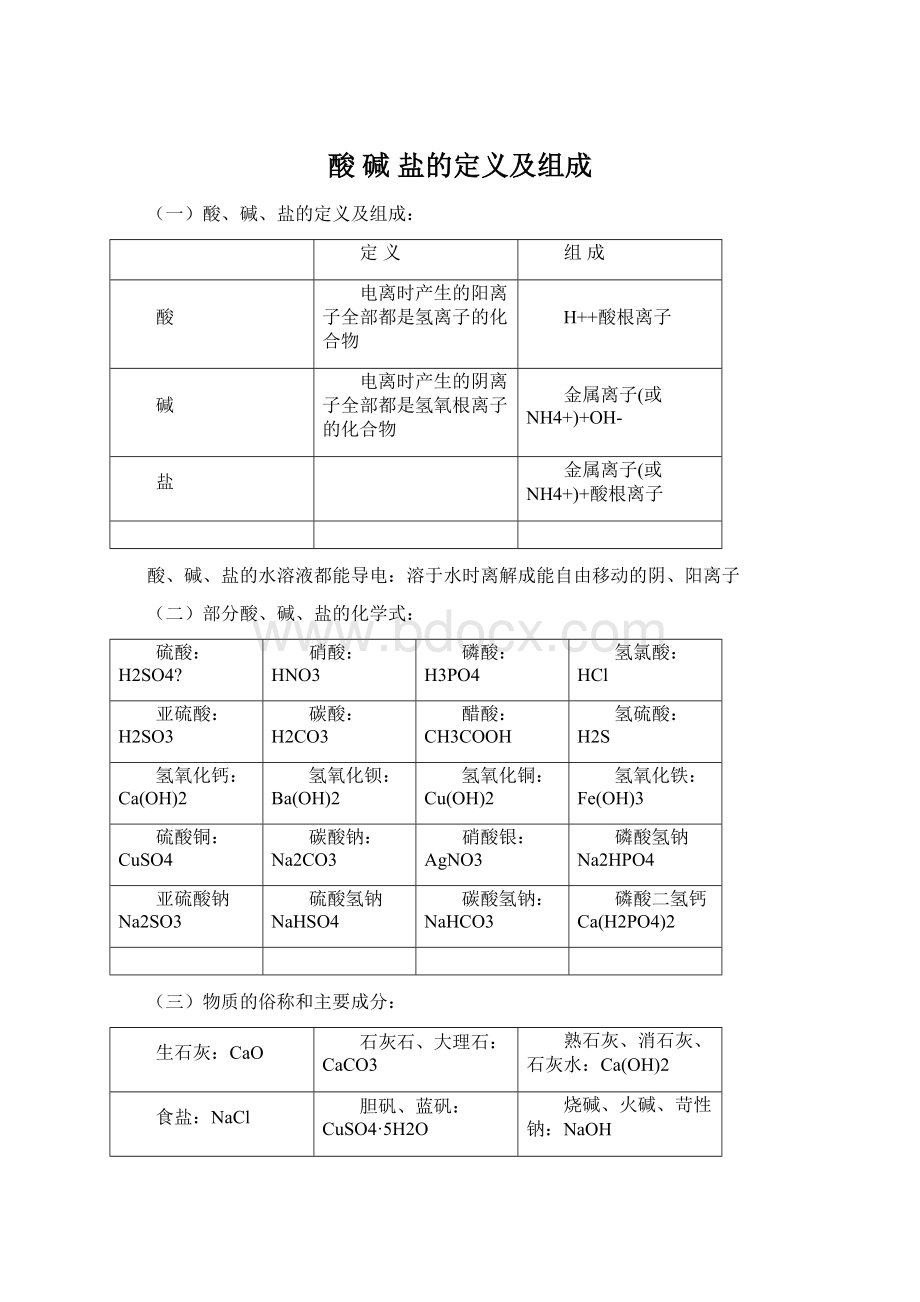
氢氧化钙:
Ca(OH)2
氢氧化钡:
Ba(OH)2
氢氧化铜:
Cu(OH)2
氢氧化铁:
Fe(OH)3
硫酸铜:
CuSO4
碳酸钠:
Na2CO3
硝酸银:
AgNO3
磷酸氢钠Na2HPO4
亚硫酸钠Na2SO3
硫酸氢钠NaHSO4
碳酸氢钠:
NaHCO3
磷酸二氢钙Ca(H2PO4)2
(三)物质的俗称和主要成分:
生石灰:
CaO
石灰石、大理石:
CaCO3
熟石灰、消石灰、石灰水:
食盐:
NaCl
胆矾、蓝矾:
CuSO4·
5H2O
烧碱、火碱、苛性钠:
NaOH
小苏打:
氨水:
NH3·
H2O(NH4OH)
纯碱:
Na2CO3(晶体Na2CO3·
10H2O)
工业用盐:
NaNO2
尿素:
CO(NH2)2
(四)物质的颜色:
固体
(多为白色)
白色:
CuSO4、BaSO4、AgCl、CaCO3?
?
BaCO3、KClO3、KCl
黑色:
CuO、C粉、MnO2、Fe3O4、Fe粉末
紫黑色:
KMnO4(溶液为紫红色)
红色:
Cu
红棕色:
Fe2O3
红褐色:
蓝色:
Cu(OH)2CuSO4·
绿色:
Cu2(OH)2CO3
溶液
(多为无色)
浅绿色溶液:
FeCl2溶液、FeSO4溶液、Fe(NO3)2溶液(即Fe2+溶液)
黄色溶液:
FeCl3溶液、Fe2(SO4)3溶液、Fe(NO3)3溶液(即Fe3+的溶液)
蓝色溶液:
CuCl2溶液、CuSO4溶液、Cu(NO3)2溶液(Cu2+的溶液)
蓝绿色溶液:
CuCl2溶液(较浓)
(五)离子的检验:
离子
物质类别
试剂
现象与结论
H+
酸液
紫色石蕊试液
OH-
碱液
紫色石蕊试液和无色酚酞
Cl-
盐酸可溶性盐酸盐
AgNO3溶液和稀HNO3
如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
SO42-
硫酸可溶性硫酸盐
BaCl2溶液和稀HNO3
如果生成不溶于硝酸(或盐酸)的白色沉淀,则原被测液中含硫酸根离子。
CO32-
可溶性碳酸盐
盐酸和石灰水
如果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸根离子。
鉴别鉴别Cl-和SO42-时须知:
①检验SO42-:
最好用Ba(NO3)2、Ba(OH)2溶液;
②在未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含Ag+或SO42-;
③鉴别Cl-和SO42-:
只能用BaCl2溶液,不能用AgNO3溶液;
④检验SO42-的另外方法:
先加过量的HCl(排除干扰),再滴加BaCl2溶液;
⑤Cl-和SO42-共存时检验:
应先检验SO42-[加过量Ba(NO3)2或Ba(OH)2,不能用BaCl2溶液],再检验Cl-(加AgNO3溶液)。
(六)酸、碱、盐的溶解性:
钾钠铵硝都能溶,硫酸除钡氯除银,碳酸只溶钾钠铵,溶碱钾钠钡和铵。
微溶:
Ca(OH)2:
石灰水注明“澄清”的原因;
CaSO4:
实验室制二氧化碳时不用稀硫酸的原因;
Ag2SO4:
鉴别SO42-和Cl-时,不用硝酸银的原因。
常见沉淀物:
氯化银、硫酸钡、(硫酸银):
不溶于稀硝酸
碳酸盐:
碳酸钙、碳酸钡、碳酸银
碱:
氢氧化镁、氢氧化铜、氢氧化铁
(七)两类反应:
置
换
反
应
金属活动性顺序:
KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu
意义:
在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
应用
“金属+酸”:
①排在氢前的金属能置换出酸里的氢元素;
②浓硫酸、硝酸不宜。
“金属+盐”:
前置后,盐需溶;
钾钠钙,排除外。
复
分
解
条件
生成物条件:
反应后有气体、水或沉淀生成。
反应物条件:
“碱+盐”、“盐+盐”之间的反应:
碱和盐都须可溶
反应类型:
①酸+碱;
②酸+盐;
③碱+盐;
④盐+盐;
⑤酸+金属氧化物(发生在酸、碱、盐和氧化物之间)
反应规律:
AB+CD→AD+CB(即内内结合、外外结合,生成H2CO3需分解为CO2和H2O)
KNO3、NaNO3、AgCl、BaSO4不参加复分解反应
(八)溶液的酸碱性与酸碱度的测定:
试纸
试液
定性测量溶液酸碱性
红、蓝石蕊试纸;
广泛pH试纸
酸碱指示剂(石蕊试液、酚酞试液)
定量测定溶液酸碱度
精密pH试纸
(酸度计、pH计)
说明:
①酸碱度的表示方法;
②pH与溶液酸碱性的关系;
③测定溶液的pH的方法。
(九)生活中的酸和碱性质比较:
(1)浓盐酸、浓硫酸的物理性质、特性、用途
浓盐酸
浓硫酸
颜色、状态
“纯净”:
无色透明液体
工业用盐酸:
黄色(含FeCl3)
无色粘稠、油状液体
气味
有刺激性气味
无
特性
挥发性(敞口置于空气中,瓶口有白雾)
吸水性、脱水性、腐蚀性、强氧化性
用途
①金属除锈
②制造药物
③人体中含有少量盐酸,助消化
②浓硫酸作干燥剂
③生产化肥、精炼石油
(2)氢氧化钠、氢氧化钙的物理性质、用途
氢氧化钠
氢氧化钙
白色固体,极易溶于水(溶解放热)
白色粉末,微溶于水
俗名
烧碱、火碱、苛性钠(具有强腐蚀性)
熟石灰、消石灰
制法
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
CaO+H2O=Ca(OH)2(放热)
①氢氧化钠固体作干燥剂
②化工原料:
制肥皂、造纸
③去除油污:
清洁剂中含氢氧化钠
①工业:
制漂白粉
②农业:
改良酸性土壤、配波尔多液
③建筑:
①“白雾”形成的机理;
②稀释浓硫酸的方法;
③皮肤沾上浓硫酸、浓碱的处理方法;
(十)酸、碱、盐的性质(通性):
类别
性质
说明
酸的通性
①酸溶液能使紫色的石蕊试液变红,使无色的酚酞试液不变色
②酸能与活泼金属反应生成盐和氢气
③酸能与金属氧化物反应生成盐和水
④酸能与碱反应生成盐和水
⑤酸能与某些盐反应生成新的盐和新的酸
具有通性的原因:
酸的水溶液中只有一种阳离子-H+
碱的通性
①碱溶液能使紫色的石蕊试液变蓝,使无色的酚酞试液变红色
②碱能与非金属氧化物反应生成盐和水
③碱能与酸反应生成盐和水
④某些碱能与某些盐反应生成新的盐和新的碱
碱的水溶液中只有一种阴离子-OH-
盐的通性
①某些盐能与较活泼的金属反应生成新的盐和金属
②某些盐能与酸反应生成新的盐和新的酸
③某些盐能与某些碱反应生成新的盐和新的碱
④有些不同的盐之间能反应生成两种新的盐
要求:
记住每个反应式的实验现象,可从以下几方面来记忆:
考虑角度
各种情况
方程式举例
反应物
①若为固体:
则固体逐渐消失(或颗粒逐渐变小)
②若为有色溶液:
则溶液的颜色消失(或发生变化)
Zn+HCl→
CuSO4+NaOH→
生成物
①有气体产生:
则产生(大量)气泡
②有沉淀生成:
则要说明沉淀的颜色
③有有色溶液形成:
则说明溶液变色情况
Zn+HCl→Na2CO3+HCl→
FeCl3+NaOH→
Fe2O3+HCl→
(十一)其他注意点:
1.浓盐酸、浓硫酸、氢氧化钠、生石灰、纯碱晶体、硫酸铜粉末等露置在空气中:
①质量如何变化?
②质量分数如何变化?
③是否变质?
2.NaOH固体密封保存的原因:
易吸收水蒸气而潮解,易吸收二氧化碳而变质。
检验是否变质:
可用盐酸(酸)、Ba(OH)2(碱)、BaCl2(盐)检验。
3.对于反应“Ca(OH)2+CO2→CaCO3↓+H2O”可用于解释:
①检验CO2;
②白膜形成(思考:
如何除去白膜?
);
③新彻的墙壁会出“汗”。
4.酸溶液≠酸性溶液;
碱溶液≠碱性溶液。
如Na2CO3溶液是盐溶液,但溶液显碱性,可使酚酞试液变红。
5.不溶性碱与指示剂无作用,如Cu(OH)2放入水中,不显碱性,不能使指示剂变色。
6.判断反应是否发生,应从实验现象来考虑。
无实验现象时,可考虑滴加指示剂。