人教版化学高二选修4第三章第一节弱电解质的电离同步练习I卷文档格式.docx
《人教版化学高二选修4第三章第一节弱电解质的电离同步练习I卷文档格式.docx》由会员分享,可在线阅读,更多相关《人教版化学高二选修4第三章第一节弱电解质的电离同步练习I卷文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
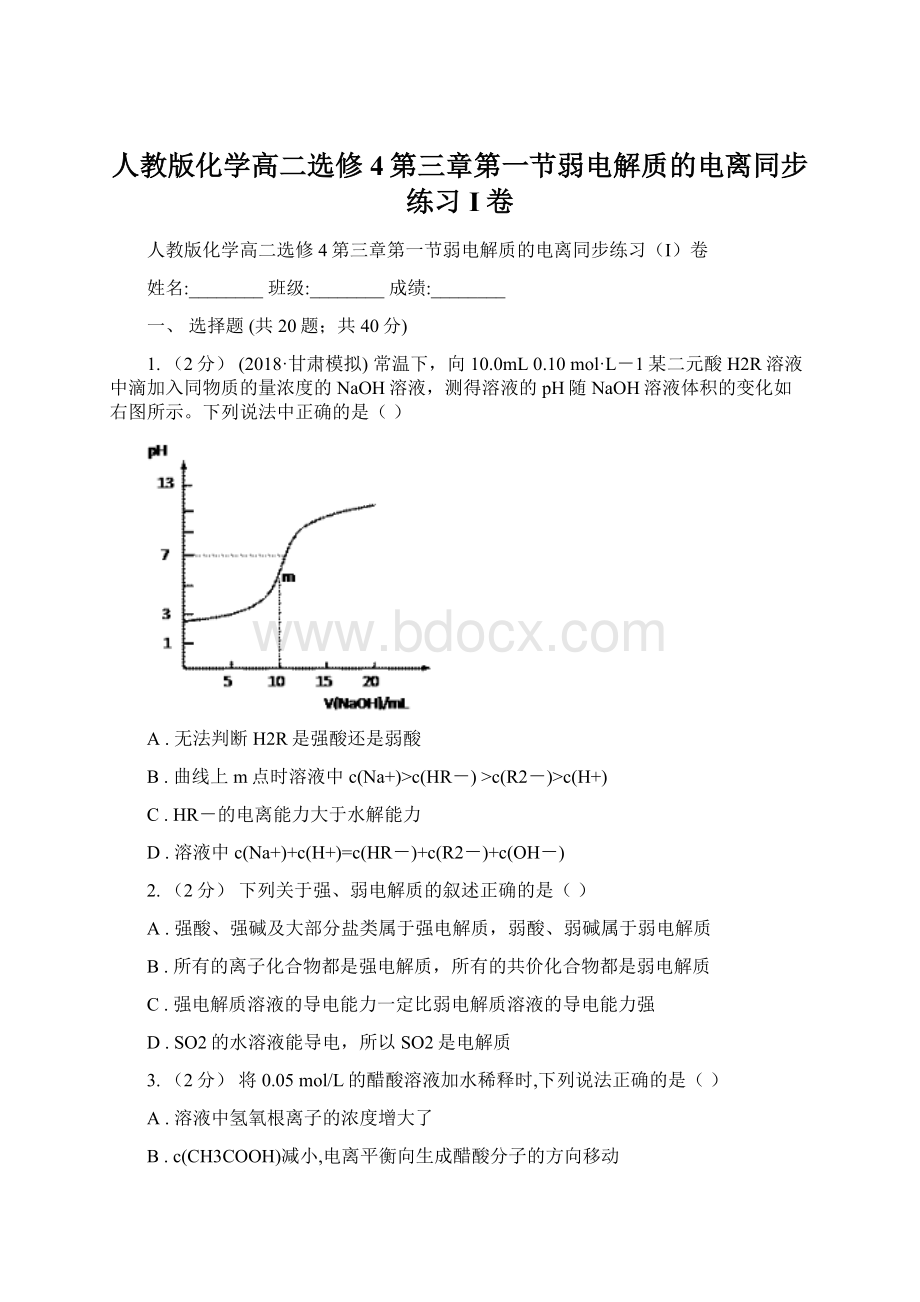
汉台期末)体积相同、pH=3的HCl溶液和CH3COOH溶液分别跟足量的镁充分反应,下列判断正确的是()
A.HCl溶液产生较多的氢气
B.CH3COOH溶液产生较多的氢气
C.两者产生等量的氢气
D.无法比较两者产生氢气的量
5.(2分)(2018高二上·
天津期末)常温下0.1mol/L氨水pH为11,则下列说法中错误的是()
A.此溶液中NH3∙H2O在常温下的电离度约为1%
B.若向此溶液中通入少量氨气,NH3∙H2O电离平衡正向移动,水的电离平衡逆向移动
C.若向其中加入pH为11的NaOH溶液,NH3∙H2O电离平衡不移动,但n(NH4+)减小
D.若向其中加入少量水,溶液中n(H+)增大
6.(2分)(2016高二上·
湖北期中)在甲烧杯中放入盐酸,乙烧杯中放入某一元酸HA,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气,则下列事实或叙述能说明一元酸HA是弱酸的是()
A.两烧杯中参加反应的锌粒等量
B.反应开始时产生H2的速率相等
C.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大
D.甲烧杯中放入锌的质量一定比乙烧杯中放入锌的质量大
7.(2分)(2016高二上·
娄底期末)下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是()
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
C12H22O11(蔗糖)
BaSO4
C2H5OH
H2O
A.A
B.B
C.C
D.D
8.(2分)下列电离方程式中正确的是()
A.NaHCO3=Na++HCO3-
B.Na2SO4=2Na++SO4-2
C.Ca(NO3)2=Ca2++2(NO3)2-
D.KClO3=K++Cl-+3O2-
9.(2分)(2018高三上·
北京期中)下列化学用语表述正确的是()
A.二氧化碳的电子式:
B.氯化氢的电子式:
C.CH4分子的比例模型:
D.水的电离方程式:
H2O=H++OH-
10.(2分)(2017高二上·
延安期中)下列各电离方程式中,书写正确的是()
A.CH3COOH═H++CH3COO﹣
B.KHSO4⇌K++H++SO42﹣
C.Al(OH)3⇌Al3++3OH﹣
D.NaH2PO4⇌Na++H2PO42﹣
11.(2分)(2017高一上·
绍兴期中)下列物质在水中的电离方程式书写正确的是()
A.NaHSO4═Na++HSO4﹣
B.NaHCO3═Na++H++CO32﹣
C.KClO3═K++Cl﹣+3O2﹣
D.Al2(SO4)3═2Al3++3SO42﹣
12.(2分)下列性质中,不能说明乙酸是弱电解质的是
A.乙酸钠溶液显碱性
B.常温时,0.1mol·
L-1乙酸溶液的pH约为3
C.10mL1mol·
L-1乙酸溶液与10mL1mol·
L-1的NaOH溶液恰好完全反应
D.在相同温度下,同物质的量浓度的乙酸溶液的导电性比甲酸(为弱酸)溶液的弱
13.(2分)(2018·
新疆模拟)下列图示与对应的叙述相符的是()
A.图1表示向氨水中通入HCl气体,溶液的导电能力变化
B.图2表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>
T1
C.图3可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
14.(2分)(2018高二下·
邯郸开学考)下列化学用语正确的是()
A.NaHCO3的水解:
HCO3-+H2O
H3O++CO32-
B.醋酸铵的电离:
CH3COONH4
CH3COO-+NH4+
C.汽车尾气净化反应:
2NO+2CO=2CO2+N2能够自发进行,则该反应的△H>0
D.碳在高温下还原二氧化硅:
SiO2+2C
Si+2CO↑
15.(2分)(2018高二上·
北京期中)醋酸的下列性质中,可以证明它是弱电解质的是()
A.0.1mol/L醋酸溶液的c(H+)约为1×
10-3mol/L
B.醋酸能与水以任何比例互溶
C.10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应
D.醋酸溶液的导电性比盐酸溶液的弱
16.(2分)下列关于物质的分类或变化说法正确的是()
A.稀硫酸、NaCl溶液是实验室常见的强电解质
B.二氧化氮经加压凝成无色液体为物理变化
C.Na2O•SiO2是一种简单的硅酸盐,可溶于水
D.溴水滴入植物油中振荡褪色,说明溴被植物油从溴水中萃取出来
17.(2分)可以证明次氯酸是弱酸的事实是()
A.可与碱反应
B.有漂白性
C.见光能分解
D.次氯酸钙溶液可与碳酸反应生成次氯酸
18.(2分)下列事实能说明碳酸的酸性比乙酸弱的是()
A.乙酸能发生酯化反应,而碳酸不能
B.碳酸和乙酸都能与碱反应
C.乙酸易挥发,而碳酸不稳定易分解
D.乙酸和Na2CO3反应可放出CO2
19.(2分)(2020高二上·
荆州期末)用蒸馏水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是()
A.c(OH-)/c(NH3·
H2O)
B.n(OH-)
C.c(NH3·
H2O)/c(H+)
D.c(H﹢)
20.(2分)(2016高二上·
丰县月考)相同温度下,根据三种酸的电离常数,下列判断正确的是()
酸
HX
HY
HZ
电常数
9×
10﹣7
10﹣6
10﹣2
A.三种酸的强弱关系:
HX>HY>HZ
B.反应HZ+Y﹣═HY+Z﹣够发生
C.相同温度下,0.1mol•L﹣1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1mol•L﹣1HX溶液的电离常数大于0.1mol•L﹣1HX
二、非选择题(共5题;
共41分)
21.(13分)(2016·
上海)随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点.
完成下列填空:
(1)
目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
v正
v逆
平衡常数K
转化率α
(2)
相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol•L﹣1
[H2]/mol•L﹣1
[CH4]/mol•L﹣1
[H2O]/mol•L﹣1
平衡Ⅰ
a
b
c
d
平衡Ⅱ
m
n
x
y
a、b、c、d与m、n、x、y之间的关系式为________.
(3)
碳酸:
H2CO3,Ki1=4.3×
10﹣7,Ki2=5.6×
10﹣11
草酸:
H2C2O4,Ki1=5.9×
10﹣2,Ki2=6.4×
10﹣5
0.1mol/LNa2CO3溶液的pH________0.1mol/LNa2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是________.若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是________.(选填编号)
a.[H+]>[HC2O4﹣]>[HCO3﹣]>[CO32﹣]
b.[HCO3﹣]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]
c.[H+]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]
d.[H2CO3]>[HCO3﹣]>[HC2O4﹣]>[CO32﹣]
(4)
人体血液中的碳酸和碳酸氢盐存在平衡:
H++HCO3﹣⇌H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象.
22.(7分)常温下,下列四种溶液:
①0.1mol/LNH3•H2O,②0.1mol/L(NH4)2SO4③0.1mol/LNH4HSO4④0.1mol/LCH3COONH4,请根据要求填空:
(1)当盐酸与①等体积等浓度混合,混合溶液呈________
(填“酸性、碱性、中性”)
(2)溶液②呈酸性的原因是(用离子方程式表示)________
,且溶液中各离子浓度大小关系为________
;
(3)实验测定溶液④的pH=7,则c(CH3COO﹣)________
c(NH4+)(填“>、<、=”);
(4)上述四种溶液中,pH最小的是(填序号________
(5)上述四种溶液中,c(NH4+)由大到小的顺序为(填序号)________
(6)将溶液①③混合,写出反应的离子方程式:
________
.
23.(10分)(2016·
三亚模拟)研究氮及其化合物对化工生产有重要意义.
(1)工业合成氨的原理为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1.
下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为n)对该平衡的影响
①已知图甲中0~t1min内,v(H2)=0.03mol•L﹣1•min﹣1,则t1=________;
若从t2min起仅改变一个反应条件,则所改变的条件可能是________(填一种即可);
图乙中,b点时n=________.
②已知某温度下该反应的K=10,该温度下向容器中同时加入下列浓度的混合气体:
c(H2)=0.1mol•L﹣1,c(N2)=0.5mol•L﹣1,c(NH3)=0.1mol•L﹣1,则在平衡建立过程中NH3的浓度变化趋势是________(填“逐渐增大”“逐渐减小”或“恒定不变”).
(2)已知肼(N2H4)是二元弱碱,其电离是分步的,电离方程式为________、________.
(3)中国航天科技集团公司计划在2015年完成20次宇航发射任务.肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:
①N2(g)+2O2(g)═N2O4(l)
△H1=﹣195kJ•mol﹣1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)
△H2=﹣534.2kJ•mol﹣1
写出肼和N2O4反应的热化学方程式:
________.
(4)以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图丙所示,两端是石墨电极,中间隔板只允许离子通过,不允许水分子通过.
①已知两室加入的试剂分别是:
a.硝酸溶液;
b.N2O4和无水硝酸,则左室加入的试剂应为________(填代号),其电极反应式为________.
②若以甲醇燃料电池为电源进行上述电解,已知:
CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H=﹣651kJ•mol﹣1,又知甲醇和水的汽化热分别为11kJ•mol﹣1、44kJ•mol﹣1,标准状况下,该燃料电池消耗0.5molCH3OH产生的最大电能为345.8kJ,则该电池的能量效率为________(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
24.(2分)(2017高二上·
莆田期末)现有NH4Cl和NH3•H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)________c(Cl﹣);
若pH>7,则该溶液中c(NH4+)________c(Cl﹣).(填“>”、“<”、“=”).
25.(9分)(2017·
自贡模拟)已知二元酸H2A在水中存在以下电离:
H2A═H++HA﹣,HA﹣═H++A2﹣,回答下列问题:
(1)Na2A溶液呈________性,理由是________(用离子方程式表示).
(2)NaHA溶液呈________性,理由是________.
(3)0.1mol/L的NaHA溶液的pH=3,则Ka(HA﹣)=________.
(4)某温度下,向10mL0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至溶液中水的离子积常数Ka=c2(OH﹣),此时溶液呈________性,V________10(填“<”“>”或“=”)c(K+)/c(Na+)________1(填“<”“>”或“=”),溶液中电荷守恒等式为________.
参考答案
1-1、
2-1、
3-1、
4-1、
5-1、
6-1、
7-1、
8-1、
9-1、
10-1、
11-1、
12-1、
13-1、
14-1、
15-1、
16-1、
17-1、
18-1、
19-1、
20-1、
21-1、
21-2、
21-3、
21-4、
22-1、
22-2、
22-3、
22-4、
22-5、
22-6、
23-1、
23-2、
23-3、
23-4、
24-1、
25-1、
25-2、
25-3、
25-4、