版高考化学方程式练习.docx
《版高考化学方程式练习.docx》由会员分享,可在线阅读,更多相关《版高考化学方程式练习.docx(32页珍藏版)》请在冰豆网上搜索。
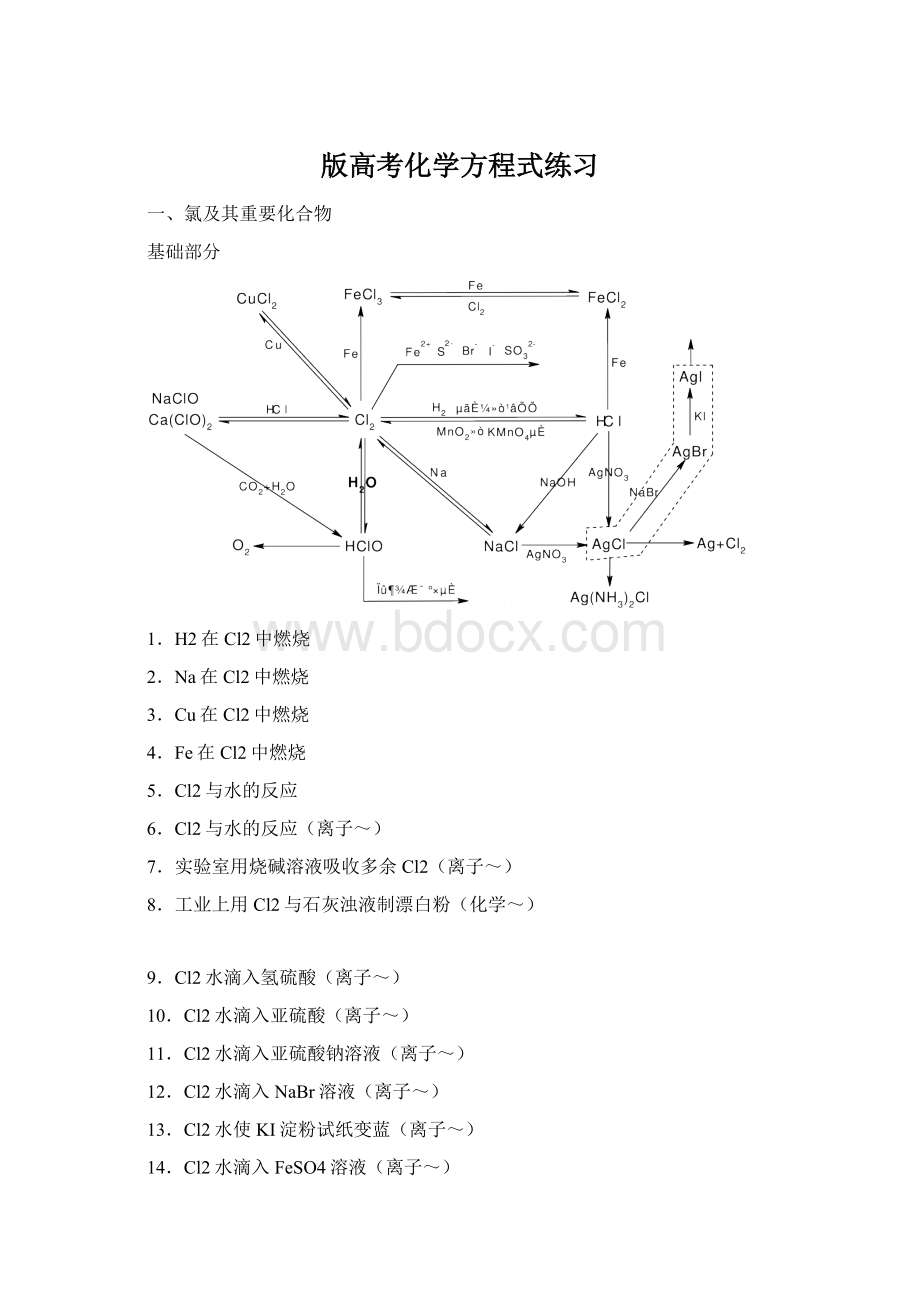
版高考化学方程式练习
一、氯及其重要化合物
基础部分
1.H2在Cl2中燃烧
2.Na在Cl2中燃烧
3.Cu在Cl2中燃烧
4.Fe在Cl2中燃烧
5.Cl2与水的反应
6.Cl2与水的反应(离子~)
7.实验室用烧碱溶液吸收多余Cl2(离子~)
8.工业上用Cl2与石灰浊液制漂白粉(化学~)
9.Cl2水滴入氢硫酸(离子~)
10.Cl2水滴入亚硫酸(离子~)
11.Cl2水滴入亚硫酸钠溶液(离子~)
12.Cl2水滴入NaBr溶液(离子~)
13.Cl2水使KI淀粉试纸变蓝(离子~)
14.Cl2水滴入FeSO4溶液(离子~)
15.MnO2氧化浓盐酸
16.过量CO2通入漂白粉溶液(离子~)
17.HClO见光分解
18.AgX(X为Cl、Br或I)见光分解
19.AgCl浊液中滴入NaBr溶液
20.AgBr浊液中滴入NaI溶液(离子~)
21.AgNO3溶液中滴入氨水直至沉淀恰好溶解(离子~)
22.氯碱工业反应原理
提高部分
1.氨与氯气混合产生白烟
2.Fe(OH)3溶于氢碘酸(离子~)
3.少量氯气通入FeBr2溶液中(离子~)
4.过量氯气通入FeI2溶液中(离子~)
5.甲苯与氯气混合光照
6.氯气通入FeBr2溶液将其中2/3的Br-氧化(离子~)
7.Cl2与热、浓KOH反应(产物之一可用于实验室制O2)
8.KMnO4常温下可将盐酸氧化成氯气(离子~)
9.葡萄糖可将用硫酸酸化的氯酸钠溶液还原为ClO2气体
二、氮及其重要化合物
基础部分
1.N2与O2反应
2.工业上合成氨
3.Mg在N2中燃烧
4.Mg3N2与少量水反应
5.Mg3N2与过量水反应
6.氨与水反应(离子~)
7.浓氨水与浓盐酸靠近产生白烟
8.工业上制硝酸的3个反应
9.实验室制取氨
10.碳铵受热分解
11.将生石灰加入浓氨水
12.NH4Cl溶液与烧碱溶液混合(离子~)
13.NH4Cl溶液与烧碱溶液混合加热(离子~)
14.NH4Cl浓溶液与烧碱浓溶液混合(离子~)
15.NO2变成N2O4
16.硝酸见光或受热分解
17.灼热的C在浓硝酸中燃烧
18.铜与浓硝酸反应
19.铜与稀硝酸反应
20.过量铁与稀硝酸反应(假设还原产物为NO)(离子~)
21.银溶于稀硝酸(离子~)
22.Fe2+溶于稀硝酸(离子~)
23.SO2通入稀硝酸(离子~)
24.稀硝酸使KI淀粉试纸变蓝(离子~)
25.H2S气体通入稀硝酸(离子~)
26.NO、O2混合气体(体积比4∶3)溶于水
27.NO2、O2混合气体(体积比4∶1)溶于水
提高部分
1.氨与氯气混合产生白烟
2.加热条件下用氨还原CuO
3.在催化剂条件下用氨清除有毒的NO
4.在催化剂条件下用汽车尾气(NO和CO等)转化为无毒气体
5.氨在纯氧中燃烧
6.请将5种物质:
N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个配平的化学方程式。
_______+_______→_______+_______+_______+H2O
7.NO2与SO2混合
8.NH4HCO3溶液与足量热Ba(OH)2溶液反应(离子~)
9.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合(离子~)
10.少量NH4HS固体与浓烧碱溶液混合(离子~)
11.SO2通入BaCl2和HNO3的混合溶液
三、硫及其重要化合物
基础部分
1.S的燃烧
2.S与H2化合
3.用硫粉处理洒落地面的液态汞
4.铁粉与硫粉混合加热
5.铜丝在硫蒸气中燃烧
6.H2S的不完全燃烧
7.H2S的完全燃烧
8.H2S通入CuSO4溶液(离子~,此反应可用于H2S的检验与吸收)
9.实验室用FeS溶于稀硫酸或稀盐酸制备H2S气体(离子~)
10.工业上制硫酸的3个反应
11.实验室用Na2SO3粉末与浓硫酸制备SO2
12.SO2溶于过量烧碱(离子~)
13.SO2溶于水
14.SO2与CaO化合
15.Na2SO3溶液(或亚硫酸)暴露空气中变质(离子~)
16.少量Mg在SO2中燃烧
17.过量Mg在SO2中燃烧
18.SO2使氯水褪色(离子~)
19.SO2与H2O2反应
20.SO2使酸性KMnO4溶液褪色(离子~)
21.SO2与H2S混合
22.工业上用氨水吸收SO2防止污染空气
23.工业上用石灰石吸收SO2防止污染空气(生成石膏)
24.灼热的C与浓硫酸反应
25.铜与浓硫酸反应
26.Na2S2O3溶液与稀硫酸混合
提高部分
1.SO2通过Na2O2
2.将Na2O2投入Na2S溶液(离子~)
3.Cu2O溶于酸性H2O2溶液(离子~)
4.Cu溶于酸性双氧水
5.NO2与SO2混合
6.O3与SO2混合
7.O3使湿润的淀粉KI试纸变蓝(离子~)
8.S溶于热的烧碱溶液
9.SO2通入BaCl2和HNO3的混合溶液
四、碳及其重要化合物
(一)碳及其重要化合物
1.C燃烧可能反应的方程式
2.C还原CuO可能的反应方程式
3.工业上用水与煤反应制备氢气
4.碳被浓硫酸氧化
5.碳在热的浓硝酸中燃烧
6.镁在CO2中燃烧
7.C与CO2化合
8.工业上用C还原SiO2制粗硅
9.工业上煅烧石灰石制生石灰
10.少量Ca(OH)2溶液与NaHCO3溶液混合(离子~)
(二)硅及其重要化合物
1.Si粉在O2中灼烧
2.Si溶于氢氟酸
3.Si溶于强碱溶液(离子~)
4.SiO2溶于强碱溶液(离子~)
5.SiO2与CaO高温下化合
6.SiO2溶于氢氟酸
7.工业上用石英、石灰石、纯碱制玻璃
8.在水玻璃中通入过量CO2生成白色胶状沉淀
9.原硅酸失水最终变成SiO2
五、钠、镁、钙及其化合物
基础部分
(一)钠及其重要化合物的相互转化关系
1.钠在氯气中燃烧
2.钠与硫化合
3.钠暴露在空气中表面变暗
4.钠在空气中燃烧
5.钠与水反应(化学~)
6.钠与水反应(离子~)
7.Na2O溶于盐酸
8.Na2O与CO2化合
9.Na2O与水化合
10.Na2O暴露空气中变色
11.CO2通过Na2O2
12.Na2O2投入水中(化学~)
13.Na2O2投入水中(离子~)
14.Na2O2投入盐酸(离子~)
15.少量CO2通入烧碱溶液(离子~)
16.少量烧碱溶液吸收CO2(离子~)
17.足量CO2通入饱和Na2CO3溶液中(离子~)
18.小苏打受热分解
19.小苏打溶液与烧碱溶液混合(离子~)
20.小苏打溶液与盐酸溶液混合(离子~)
21.盐酸逐滴加入纯碱溶液(离子~)
22.纯碱溶液逐滴加入盐酸(离子~)
23.电解饱和食盐水(化学~)
24.电解饱和食盐水(离子~)
25.电解熔融氯化钠
26.饱和食盐水中先通NH3再通CO2
27.石灰纯碱法制备烧碱
(二)镁及其重要化合物相互关系
(三)钙及其重要化合物相互关系
1.镁在空气中燃烧
2.Mg3N2与水反应
3.镁粉使溴水褪色
4.镁与水反应
5.MgO与水反应
6.MgO溶于盐酸(离子~)
7.MgO与CO2混合加热
8.Mg(OH)2溶于盐酸(离子~)
9.Mg(OH)2受热分解
10.从海水中提取镁制备金属镁所有反应的方程式(如果是离子反应写离子方程式)
11.加热MgCO3浊液
12.过量CO2通入MgCO3浊液
13.高温煅烧Mg(HCO3)2固体
14.Mg(HCO3)2溶液与过量烧碱溶液混合(离子~)
15.过量CO2通入石灰水(离子~)
16.石灰石溶于醋酸(离子~)
17.饱和CaCl2溶液中滴加足量浓烧碱溶液(离子~)
18.煅烧石灰石
19.工业上用石灰石、纯碱、石英制玻璃的主要反应
20.Cl2通入石灰浊液制备漂白粉
21.工业上用石灰石吸收有毒SO2得到石膏
提高部分
1.NaHSO4与NaHCO3溶液反应(离子~)
2.Na投入CuSO4溶液(离子~)
3.Na2O2投入足量硫酸酸化的KMnO4溶液
4.Na218O2与水反应
5.SO2通过Na2O2
6.Ba(OH)2溶液与少量NaHCO3溶液混合(离子~)
7.标况下6.72LCO2通入400mL1mol·L-1烧碱溶液(离子~)
8.等物质的量的FeSO4溶液与Na2O2充分反应(离子~)
9.将Na2O2投入Na2S溶液(离子~)
10.NaHSO4溶液与少量Ba(OH)2溶液混合
六、铝及其化合物
基础部分
铝及其重要化合物相互关系
1.Al溶于盐酸(离子~)
2.Al溶于烧碱溶液(离子~)
3.Al高温下与Fe3O4反应
4.工业电解熔融Al2O3制备Al
5.Al2O3溶于盐酸(离子~)
6.Al2O3溶于烧碱溶液(离子~)
7.AlCl3溶液与过量氨水混合(离子~)
8.往AlCl3溶液滴加烧碱溶液直至过量(离子~)
9.AlCl3溶液与过量烧碱溶液混合(离子~)
10.往NaAlO2溶液通入过量CO2(离子~)
11.往NaAlO2溶液滴加盐酸溶液直至过量(离子~)
12.NaAlO2溶液与过量盐酸溶液混合(离子~)
13.Al(OH)3受热分解
14.明矾溶于水形成净水剂(离子~)
15.AlCl3溶液与NaAlO2溶液混合(离子~)
16.泡沫灭火器工作原理[Al2(SO4)3与小苏打溶液混合](离子~)
17.NH4Cl溶液与NaAlO2溶液混合(离子~)
18.Al4C3与适量水混合
19.Al(OH)3的电离
提高部分
1.往明矾溶液中滴加Ba(OH)2溶液至Al3+完全沉淀(离子~)
2.往明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀(离子~)
3.Ba(AlO2)2溶液与少量硫酸反应(离子方程式)
4.在硫酸铝铵溶液中加入少量Ba(OH)2溶液反应
5.在硫酸铝铵溶液中加入过量Ba(OH)2溶液反应
七、铁及其重要化合物
基础部分
铁及其重要化合物相互关系
1.Fe溶于盐酸(离子~)
2.Fe棒浸入CuSO4溶液(离子~)
3.Fe粉、S粉混合加热
4.Fe在氯气中燃烧
5.Fe在氧气中燃烧
6.Fe溶于过量稀HNO3
7.过量Fe与稀HNO3作用
8.Fe粉高温下与水蒸气反应
9.FeCl2溶液中滴入氯水(离子~)
10.FeSO4溶液中滴入溴水(离子~)
11.酸性FeSO4溶液中滴入双氧水(离子~)
12.酸