第23届全国高中学生化学竞赛Word文档格式.docx
《第23届全国高中学生化学竞赛Word文档格式.docx》由会员分享,可在线阅读,更多相关《第23届全国高中学生化学竞赛Word文档格式.docx(14页珍藏版)》请在冰豆网上搜索。
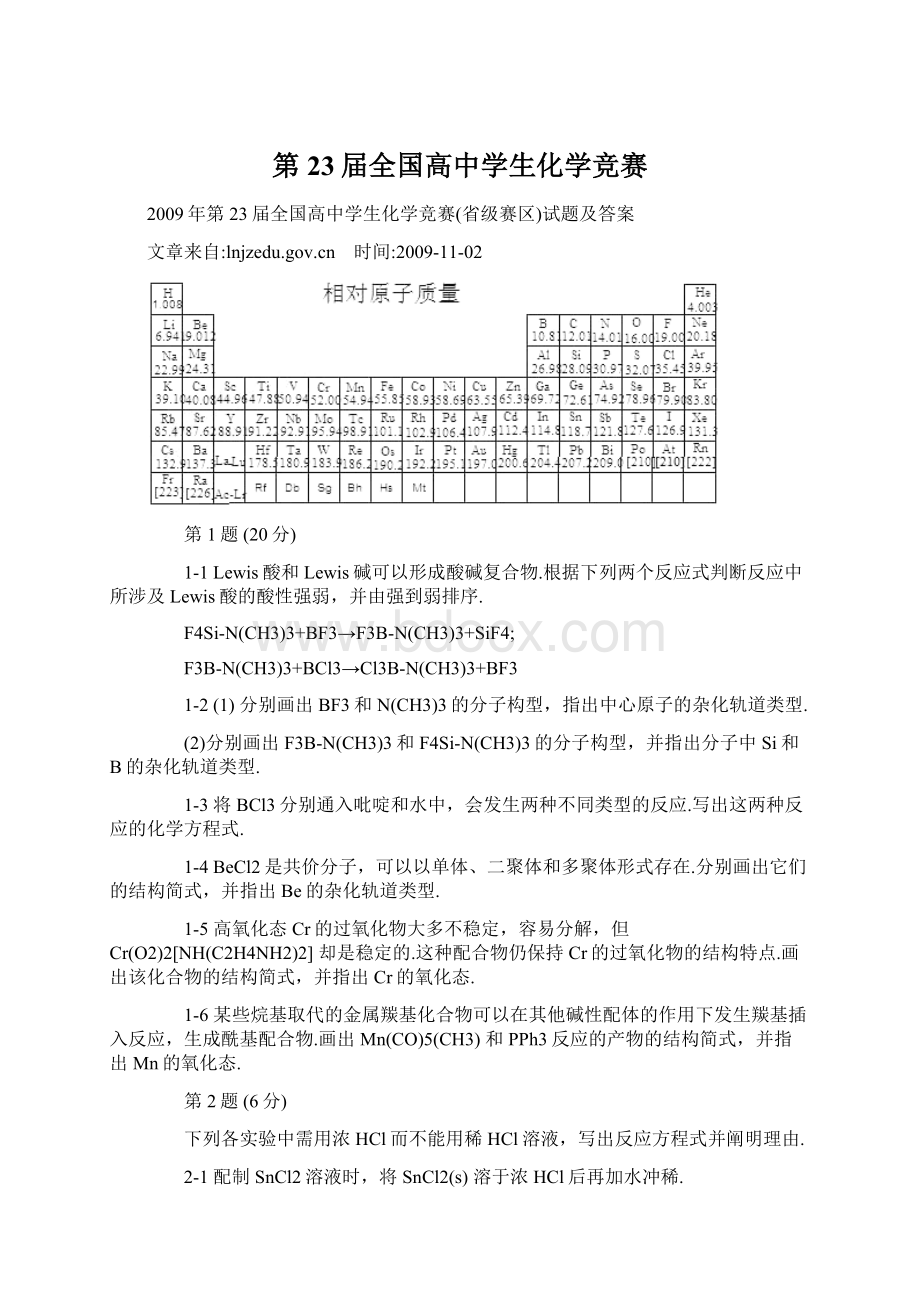
3-2在酸性介质中用锌粒还原
离子时,溶液颜色经绿色变成天蓝色,放置后溶液又变为绿色.
第4题(4分)我国石油工业一般采用恒电流库伦分析法测定汽油的溴指数.溴指数是指每100克试样消耗溴的毫克数,它反映了试样中C=C的数目.测定时将V(毫升)试样加入库伦分析池中,利用电解产生的溴与不饱和烃反应.当反应完成后,过量溴在指示电极上还原而指示终点.支持电解质为LiBr,溶剂系统仅含5%水,其余为甲醇、苯与醋酸.
设d为汽油试样密度,Q为终点时库伦计指示的溴化反应消耗的电量(库伦).
4-1导出溴指数与V、d和Q的关系式(注:
关系式中只允许有一个具体的数值).
4-2若在溶剂体系中增加苯的比例,说明其优缺点.
第5题(8分)皂化当量是指每摩尔氢氧根离子所能皂化的酯(样品)的质量(mg).可用如下方法测定皂化当量(适用范围:
皂化当量100-1000mgmol-1,样品量5-100mg):
准确称取X(mg)样品,置于皂化瓶中,加入适量0.5molL-1氢氧化钾醇溶液,接上回流冷凝管和碱石灰管,加热回流0.5-3小时;
皂化完成后,用1-2mL乙醇淋洗冷凝管内壁,拆去冷凝管,立即加入5滴酚酞,用0.5molL-1盐酸溶液酸化,使酸稍过量;
将酸化后的溶液转移到锥形瓶中,用乙醇淋洗皂化瓶数遍,洗涤完的醇溶液也均移入锥形瓶中;
向锥形瓶滴加0.5molL-1氢氧化钾醇溶液,直至溶液显浅红色;
然后用0.0250molL-1盐酸溶液滴定至刚好无色,消耗盐酸V1(mL);
再加入3滴溴酚蓝指示剂,溶液显蓝色,用0.0250molL-1盐酸溶液滴定至刚刚呈现绿色,即为滴定终点,消耗盐酸V2(mL).在没有酯存在下重复上述实验步骤,消耗标准盐酸溶液分别为V3和V4(mL).
5-1碱石灰管起什么作用?
5-2写出计算皂化当量的公式.
5-3样品中的游离羧酸将对分析结果有什么影响?
如何消除影响?
第6题(10分)
6-1文献中常用下图表达方解石的晶体结构:
图中的平行六面体是不是方解石的一个晶胞?
简述理由.
6-2文献中常用下图表达六方晶体氟磷灰石的晶体结构:
该图是c轴投影图,位于图中心的球是氟,大球是钙,四面体是磷酸根(氧原子未画出).试以此图为基础用粗线画出氟磷灰石晶胞的c轴投影图,设晶胞顶角为氟原子,其他原子可不补全.
6-3某晶体的晶胞参数为:
a=250.4pm,c=666.1pm,γ=120°
;
原子A的原子坐标为0,0,1/2和1/3,2/3,0,原子B的原子坐标为1/3,2/3,1/2和0,0,0.
(1)试画出该晶体的晶胞透视图(设晶胞底面即ab面垂直于纸面,A原子用“○”表示,B原子用“●”表示).
(2)计算上述晶体中A和B两原子间的最小核间距d(AB).
(3)共价晶体的导热是共价键的振动传递的.实验证实,该晶体垂直于c轴的导热性比平行于c轴的导热性高20倍.用上述计算结果说明该晶体的结构与导热性的关系.
第7题(8分)1964年,合成大师Woodward提出了利用化合物A(C10H10)作为前体合成一种特殊的化合物B(C10H6).化合物A有三种不同化学环境的氢,其数目比为6:
3:
1;
化合物B分子中所有氢的化学环境相同,B在质谱仪中的自由区场中寿命约为1微秒,在常温下不能分离得到.三十年后化学家们终于由A合成了第一个碗形芳香二价阴离子C,[C10H6]2-.化合物C中六个氢的化学环境相同,在一定条件下可以转化为B.化合物A转化为C的过程如下所示:
7-1A的结构简式:
7-2B的结构简式:
7-3C的结构简式:
7-4B是否具有芳香性?
为什么?
第8题(16分)
8-1化合物A是一种重要化工产品,用于生产染料、光电材料和治疗疣的药物等.A由第一、二周期元素组成,白色晶体,摩尔质量114.06g/mol,熔点293℃,酸常数pKa1=1.5,pKa2=3.4;
酸根离子A2-中同种化学键是等长的,存在一根四重旋转轴.
(1)画出A的结构简式.
(2)为什么A2-离子中同种化学键是等长的?
(3)A2-离子有几个镜面?
8-2顺反丁烯二酸的四个酸常数为1.17×
10-2,9.3×
10-4,2.9×
10-5和2.60×
10-7.指出这些常数分别是哪个酸的几级酸常数,并从结构与性质的角度简述你做出判断的理由.
8-3氨基磺酸是一种重要的无机酸,用途广泛,全球年产量逾40万吨,分子量为97.09.晶体结构测定证实分子中有三种化学键,键长分别为102、144和176pm.氨基磺酸易溶于水,在水中的酸常数Ka=1.01×
10-1,其酸根离子中也有三种键长,分别为100、146和167pm.
(1)计算0.10molL-1氨基磺酸水溶液的pH值;
(2)从结构与性质的关系解释为什么氨基磺酸是强酸?
(3)氨基磺酸可用作游泳池消毒剂氯水的稳定剂,这是因为氨基磺酸与Cl2的反应产物一氯代物能缓慢释放次氯酸.写出形成一氯代物以及一氯代物与水反应的方程式.
第9题(8分)请根据以下转换填空:
9-1
(1)的反应条件
(1)的反应类别
(2)的反应类别
9-2分子A中有____个一级碳原子,有____个二级碳原子,有____个三级碳原子,有____个四级碳原子,至少有____个氢原子共平面.
9-3B的同分异构体D的结构简式是:
9-4E是A的一种同分异构体,E含有sp、sp2、sp3杂化的碳原子,分子中没有甲基,E的结构简式是:
第10题(15分)高效低毒杀虫剂氯菊酯(I)可通过下列合成路线制备:
10-1化合物A能使溴的四氯化碳溶液褪色且不存在几何异构体.
A的结构简式
B的结构简式
10-2化合物E的系统名称
化合物I中官能团的名称
10-3由化合物E生成化合物F经历了____步反应,每步反应的反应类别分别是____.
10-4在化合物E转化成化合物F的反应中,能否用NaOH/C2H5OH代替C2H5ONa/C2H5OH溶液?
__________________.
10-5化合物G和H反应生成化合物I、N(CH2CH3)3和NaCl,由此可推断:
H的结构简式
H分子中氧原子至少与____个原子共平面.
10-6芳香化合物J比F少两个氢,J中有三种不同化学环境的氢,它们的数目比是9:
2:
1,则J可能的结构为(用结构简式表示):
2009年第23届全国高中学生化学竞赛(省级赛区)
参考答案及评分细则
1-1BCl3>BF3>SiF4顺序错误不给分(2分)
1-2
(1)
分子构型为平面三角形,不画成平面形不给分(0.5分)
sp2(0.5分)
分子构型为三角锥形,不画成三角锥形不给分(0.5分)
sp3(0.5分)
(2)
B:
sp3(1分)+(1分)
Si,sp3d(1分)+(1分)
1-3
BCl3+3H2O=B(OH)3+3HCl不配平不给分(1分)
BCl3+C5H5N=Cl3B-NC5H5或
BCl3+
=
(1分)
1-4Cl—Be—Cl
sp
结构简式和杂化轨道各0.5分(1分)
结构简式1.5分
sp2
杂化轨道0.5分(2分)
sp3
杂化轨道0.5分
画成
也得分(2分)
1-5
只有画出7配位的结构简式才能得满分,端基氮不配位得0分,二级氮不配位得1分(2分)
Cr的氧化态为+4(1分)
1-6
(1分)
Mn的氧化态为+1(1分)
第2题
2-1SnCl2+2HCl=SnCl42-+2H+不配平不给分(1分)
浓HCl的作用是形成SnCl42-,可防止Sn(OH)Cl的形成,抑制SnCl2水解.(1分)
写配平的水解方程式,加浓盐酸平衡向左移动,抑制水解也得分2分
2-2
不配平不给分(1分)
加浓HCl利于升高MnO2的氧化电位,降低Cl-的还原电位,使反应正向进行.
表述为提高MnO2氧化性,同时提高HCl还原性,也可以.二个理由各0.5分(1分)
2-3Au+HNO3+4HCl=HAuCl4+NO+2H2O(1分)
加浓HCl利于形成AuCl4-,降低Au的还原电位,提高硝酸的氧化电位,使反应正向进行.
表述为提高Au的还原性,提高硝酸的氧化性,有利于反应向右进行,也得满分.
二个理由各0.5分(1分)
第3题(5分)
3-1
(1)2NH3+3Cl2=N2+6HCl
(2)NH3+HCl=NH4Cl(白烟)每个反应式各1分,不配平不给分(2分)
合并成一个反应也得分.得到N2得1分,得到NH4Cl得1分.
(1)3Zn+Cr2O72-+14H+=3Zn2++2Cr3+(绿)+7H2O
(2)Zn+2Cr3+=Zn2++2Cr2+(天蓝)
(3)4Cr2++O2+4H+=4Cr3+(绿)+2H2O
或2Cr2++2H+=2Cr3+(绿)+H2每个反应式各1分,不配平不给分(3分)
第4题(4分)
4-1
(2分)
4-2优点:
增加汽油溶解度,有利于烯烃的加成过程;
缺点:
降低溶液电导,将使库伦仪输出电压增加.(1分)
第5题(8分)
5-1防止空气中的二氧化碳进入试样溶液,否则会在溶液中产生碳酸盐,后者不能使酯发生皂化反应却在酚酞无色时以碳酸氢根存在导致滴定结果有正误差.(2分)
5-2
(3分)
5-3样品中的游离羧酸会降低皂化当量.要消除这种影响,可另取一份样品,不必皂化,其它按上述测定步骤进行操作,然后将第二次滴定所消耗的0.025molL-1盐酸标准溶液的毫升数,自皂化样品滴定时所消耗的0.025molL-1标准盐酸溶液的毫升数中减去,以进行校正.其中空白实验(3分)
6-1不是.(1分)
晶体的平移性决定了晶胞的8个顶角必须相同,平行棱的结构必须相同,平行面的结构必须相同,而该平行六面体平行棱上的碳酸根离子的取向是不同的.(1分)
6-2
6-3
(1)
(2分)
(2)d(AB)=250.4pm×
0.5÷
cos30°
=144.6pm
只要有计算过程,得出正确的核间距
(3)因为该晶体的c=666.1pm,是AB最短核间距的4.6倍,其间不可能有共价键,只有范德华力,该晶体属层状晶体,难以通过由共价键振动传热.(2分)
第7题(8分)
7-1
其他答案不得分.(2分)
7-2
或
只要答出其中一种,得2分;
7-3
得1分
7-5B不具有芳香性.(1分)
因为不符合4n+2规则.(1分)
8-1
(1)
其他答案不得分.(2分)
(2)A2-环内的π电子数为2,符合4n+2规则,具有芳香性,π电子是离域的,可记为
,因而同种化学键是等长的.(2分)
(3)5(2分)
8-2
共4个酸常数,每个0.5分(2分)
顺式丁烯二酸发生一级电离后形成具有对称氢键的环状结构,十分稳定,既使一级电离更容易,又使二级电离更困难了,因而其K1最大,K2最小.(2分)
8-3
(1)c/K=0.1/10-1<500, K=[H+]2/(c-[H+]),
[H+]=0.062molL-1 pH=1.21(2分)
(2)N-S键中的电子由于磺酸根强大的吸电子效应使H-N键极性大大增大,而且去质子后N-S缩短,导致H-N很容易电离出氢离子.(2分)
(3)H3NSO3+Cl2=H2ClNSO3+HClH2ClNSO3+H2O=HClO+H3NSO3
每个方程式1分(2分)
第9题(8分)
9-1
加热
其他答案不得分.
(0.5分)
狄尔斯-阿尔德(Diels-Alder)反应答环加成反应、二聚反应也给分;
还原反应
答催化氢化、加成反应也给分;
(0.5分)
9-22,0,4,1,4.每空0.5分(2.5分)
9-3
只要正确表达出双键加成就可得分.其他答案不得分.(2分)
9-4
答出1个就得满分.错1个扣0.5分.(2分)
第10题(15分)
10-1
10-2化合物E的系统名称
3,3-二甲基-4,6,6-三氯-5-己烯酸乙酯.其他答案不得分.(2分)
卤原子、碳碳双键、酯基、醚键.共4种官能团,每个0.5分.写错1个扣0.5分.(2分)
10-32 其他答案不得分.(1分)
酸碱反应(亲核)取代反应.共2个反应类别,每个0.5分.(1分)
10-4不能 其他答案不得分.(1分)
因为酯会发生皂化反应、NaOH的碱性不够强(不能在酯的a位生成碳负离子)、烯丙位的氯会被取代、双键可能重排等等.答出二种或二种以上给满分.(2分)
10-5
其他答案不得分.(1分)
11其他答案不得分.(1分)
10-6
答出1个得2分,答错1个扣0.5分(2分)