上海各区中考化学二模试题分类汇编化学方程式的计算word答案版Word文档下载推荐.docx
《上海各区中考化学二模试题分类汇编化学方程式的计算word答案版Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《上海各区中考化学二模试题分类汇编化学方程式的计算word答案版Word文档下载推荐.docx(9页珍藏版)》请在冰豆网上搜索。
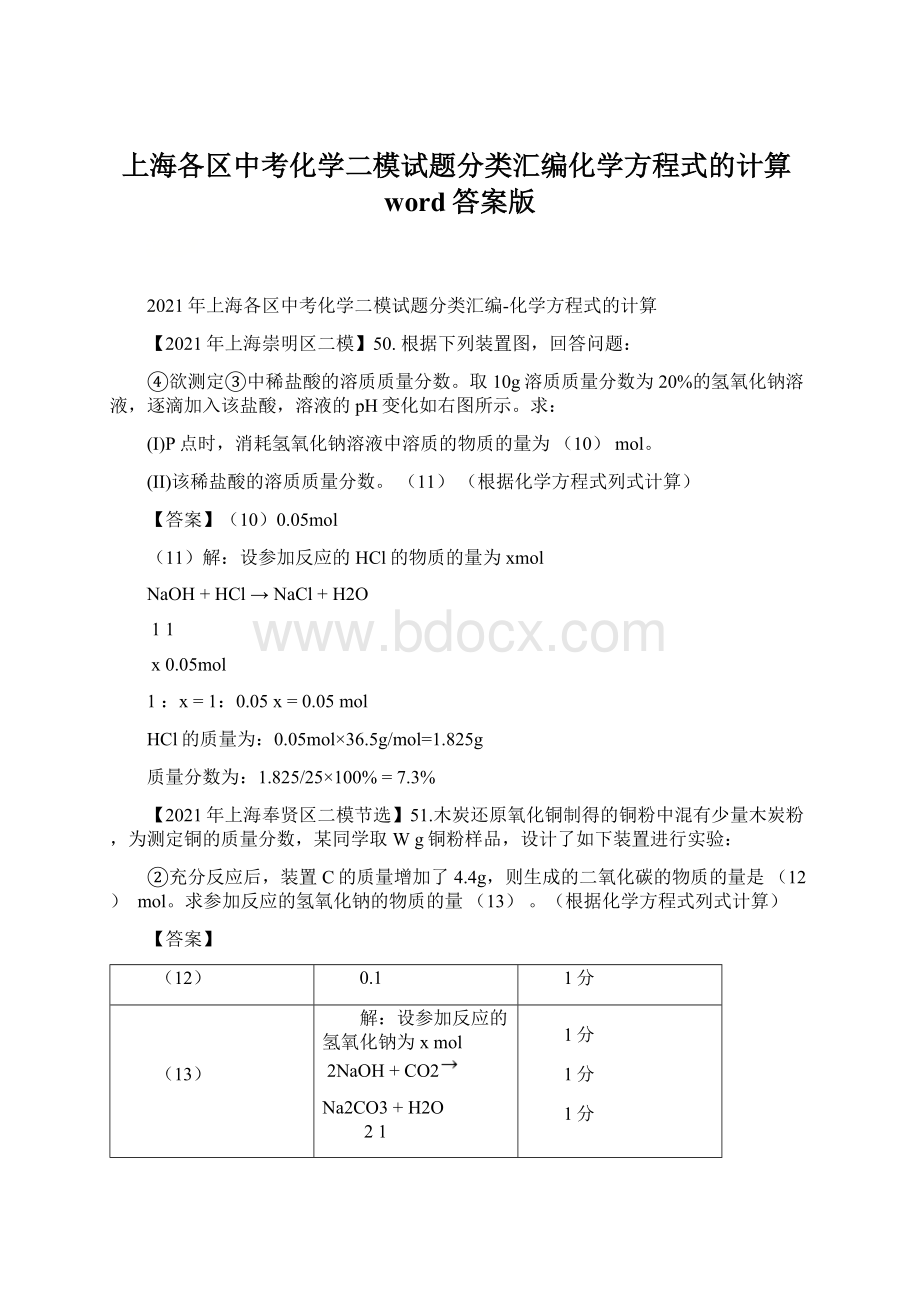
1.825/25×
100%=7.3%
【2021年上海奉贤区二模节选】51.木炭还原氧化铜制得的铜粉中混有少量木炭粉,为测定铜的质量分数,某同学取Wg铜粉样品,设计了如下装置进行实验:
②充分反应后,装置C的质量增加了4.4g,则生成的二氧化碳的物质的量是(12)mol。
求参加反应的氢氧化钠的物质的量(13)。
(根据化学方程式列式计算)
(12)
0.1
1分
(13)
解:
设参加反应的氢氧化钠为xmol
2NaOH+CO2
Na2CO3+H2O
21
x0.1
2/x=1/0.1
x=0.2(mol)
答:
参加反应的氢氧化钠0.2mol
【2021年上海虹口区二模节选】50.实验室制取气体的部分装置如下图所示。
④用稀硫酸和锌粒反应制取氢气,可以选择C作为发生装置,理由是(7)。
⑤请计算制取0.1mol氢气至少需要的锌粒的质量。
(请根据化学方程式列式计算)(8)
(7)块状固体和液体反应、不需加热
(8)解:
设需要锌粒xmol
Zn+H2SO4→ZnSO4+H2↑
x=0.1(mol)0.1mol×
65g/mol=6.5g
【2021年上海黄埔区二模节选】50.某含铁和炭的黑色粉末,为测定其中铁粉的质量分数,进行以下实验:
称量10.0g样品放入50.0g的锥形瓶中,再加入过量稀硫酸100g(如图一)立即开始记录读数(如图二),回答下列问题:
①图一中a的仪器名称是
(1)。
10.0g样品转移到锥形瓶中需要使用的仪器是
(2)。
②写出锥形瓶中发生反应的化学方程式(3)。
反应生成氢气的物质的量是(4)mol。
③样品中铁粉的质量分数是(5)。
(根据化学方程式进行列式计算)
【答案】50.
(1)电子天平
(2)药匙或纸槽(3)H2SO4+Fe→FeSO4+H2↑(4)0.15
(5)解:
设样品中铁粉的质量为x克
H2SO4+Fe→FeSO4+H2↑
x0.15
561
x=8.4g
【2021年上海金山区二模节选】50.下图装置适当组合可用于H2、O2、CO2等气体的制备和收集。
实验室制CO2,若有0.4mol碳酸钙完全反应,求生成二氧化碳的质量。
(根据化学方程式列式计算)(9)
【答案】
(9)
设生成CO2xmol
CaCO3+2HCl→CaCl2+CO2↑+H2O
0.4x
1/0.4=1/x
x=0.4mol
CO2的质量=0.4mol*44g/mol=17.6g
生成CO2的质量为17.6g
3分
【2021年上海静安区二模】51.为测定碳酸钙粉末与稀盐酸反应生成二氧化碳的质量(假设二氧化碳全部从溶液中逸出,不考虑试剂的挥发),实验如下:
将小烧杯中的稀盐酸倒入盛有5g碳酸钙粉末的大烧杯中,记录天平的示数直至充分反应(如图二),天平示数与反应时间的关系如图三所示。
①分析图三可知t3时反应已停止,理由是(7);
②如果5g碳酸钙粉末完全反应,产生多少摩尔的二氧化碳?
(根据化学方程式列式计算)(8);
③天平示数m的范围是(9)(用“>
“、“=”、“<
”、“≤”、“≥”等符号表示)。
【答案】51.(7)质量不再变化
(8)解5/100=0.05mol
CaCO3+2HCl→CaCl2+H2O+CO2↑
0.05X
x=0.05mol
(9)140.00g≤m<142.20g
【2021年上海闵行区二模节选】50.实验室制取气体的常见装置如下,请回答有关问题。
B
⑤用过氧化氢溶液和少量二氧化锰混合制取氧气,选择B装置,为使反应较平稳的进行,对应的操作是(7)。
若用68g过氧化氢溶液完全反应共收集得到氧气0.05mol,则过氧化氢溶液溶质质量分数是(8)(根据化学方程式计算)。
【答案】⑺调节(分液漏斗)活塞,控制滴加双氧水的速率
⑻解:
设过氧化氢的物质的量为xmol
2H2O2
2H2O+O2↑ …………(1分)
21
x0.05
2:
x=1:
0.05…………(1分)
x=0.1mol…………(1分)
H2O2%=0.1mol×
34g/mol/68g×
100%=5%…………(1分)
【2021年上海普陀区二模节选】④实验室利用大理石与稀盐酸反应制取CO2,反应中共消耗了3.65%的稀盐酸100g,计算该盐酸溶液中含HCl的物质的量是多少?
可以得到CO2气体的质量是多少?
(请列式计算)
(7)计算HCl的物质的量:
(8)计算CO2气体的质量:
④
(7)
3.65%×
100/36.5=0.1mol
2
(8)
设得到CO2为xmol
CaCO3+2HCl→CaCl2+H2O+CO2↑
0.1x
x=0.05质量为0.05×
44=2.2g
略
1
【2021年上海青浦区二模】50.某大理石样品(所含杂质不溶于水且不与酸反应)与足量的盐酸充分反应,过滤后将滤液蒸干,冷却后称量所得氯化钙固体。
相关实验数据如下图所示(不计损耗):
氯化钙的质量为
(1)g。
②计算该大理石样品中碳酸钙的物质的量(根据化学方程式列式计算)。
(2)
50
(4分)
(1)
11.1
(2)
该大理石样品中碳酸钙的物质的量xmol
CaCO3+2HCl→CaCl2+CO2↑+H2O
11
x0.1
1/x=1/0.1
x=0.1mol
该大理石样品中碳酸钙的物质的量0,1mol
【2021年上海松江区二模节选】50.根据下图回答问题
上述实验中4.4克二氧化碳与40克氢氧化钠溶液恰好完全反应。
I.二氧化碳物质的量为(7)mol。
II.氢氧化钠溶液的溶质质量分数(根据化学方程式计算)
(8)。
(7)0.1
(8)CO2+2NaOH→Na2CO3+H2O
12
0.1x
x=0.2mol
0.2×
40/40=0.2(或20%)
【2021年上海徐汇区二模】50.草木灰的主要成分是碳酸钾。
某化学兴趣小组取100g草木灰样品于烧杯中,不断滴入稀盐酸,当烧杯中的残余混合物质量为137.8g时,反应充分。
反应过程放出的气体质量与加入盐酸的关系曲线如右图表示,(假设草木灰的其他成分不与酸反应)
请计算回答:
Ⅰ.图中纵坐标上a点数值:
a=
(1)g;
放出气体的物质的量为
(2)mol。
Ⅱ.草木灰样品中碳酸钾的质量分数(要求写出计算过程)。
(3)。
【答案】50.
(1)2.2
(2)0.05
(3)解:
设草木灰中K2CO3的物质的量xmol。
2HCl+K2CO3→2KCl+H2O+CO2↑
x0.05
x=0.05(mol)
m(K2CO3)=138×
0.05=6.9(g)
K2CO3的质量分数=6.9/100=6.9%
略。
【2021年上海杨浦区二模】
34.(5分)向盛有一定质量稀盐酸的烧杯中逐渐加入石灰石,产生气体质量与石灰石质量的关系如图所示。
恰好完全反应后称得烧杯中剩余物质的质量为108.1g,根据关系图分析并计算:
(1)稀盐酸完全反应时,产生CO2气体的物质的量为________。
(2)该稀盐酸溶质的质量分数。
(写出计算过程)
(1)0.1mol
(2)设稀盐酸中溶质质量为xg。
CaCO3+2HCl→CaCl2+H2O+CO2↑
7344
xg4.4g
x=7.3g
m稀盐酸=108.1+4.4-12.5=100g
HCl%=
【2021年上海长宁区二模节选】50.利用下图装置探究物质的性质(部分固定装置略)。
⑤把装置A中换成酒精灯,可用于氯酸钾与二氧化锰混合制取氧气。
试管中固体的质量随反应时间变化的数据见下表。
反应时间/min
t1
t2
t3
固体质量/g
26.0
20.2
16.4
Ⅰ.共制得氧气的质量是(27)g;
Ⅱ.参加反应的氯酸钾的物质的量是(28)mol(通过化学方程式列式计算)。
(27)
9.6
(28)
设参加反应的氯酸钾为xmol
n(O2)=9.6/32=0.3mol
23
x0.3
2/x=3/0.3
x=0.2mol
参加反应的氯酸钾为0.2mol
【2021年上海宝山&
嘉定区二模节选】51.利用下列提供的仪器装置回答问题:
小刚用制得的氢气还原氧化铜,得到0.1mol铜,则理论上参与反应的氢气的质量为
(9)(根据化学方程式计算)。
【答案】设参加反应的氢气的物质的量为X
H2+CuO→Cu+H2O
X0.1
X=0.1(mol)
m(H2)=0.1×
2=0.2g
参加反应的氢气为0.1mol。
【2021年上海浦东新区二模节选】51.请根据装置回答。
②实验室制取二氧化碳,若需控制反应的发生与停止,所选装置组合是(22),若制取0.01molCO2,需要(23)mol碳酸钙与稀盐酸反应?
(根据化学方程式计算)
③很多反应均能产生CO2,例如
a.2NaHCO3
Na2CO3+H2O+CO2↑b.NH4HCO3
NH3↑+H2O+CO2↑
在实验室制取CO2,以上两个反应哪个更合适?
理由是(24);
(23)0.01mol;
(24)a合适,只有生成的气体是CO2才便于区别和收集。