北京北大附中学年第二学期化学五月周测2试题word版Word格式.docx
《北京北大附中学年第二学期化学五月周测2试题word版Word格式.docx》由会员分享,可在线阅读,更多相关《北京北大附中学年第二学期化学五月周测2试题word版Word格式.docx(12页珍藏版)》请在冰豆网上搜索。
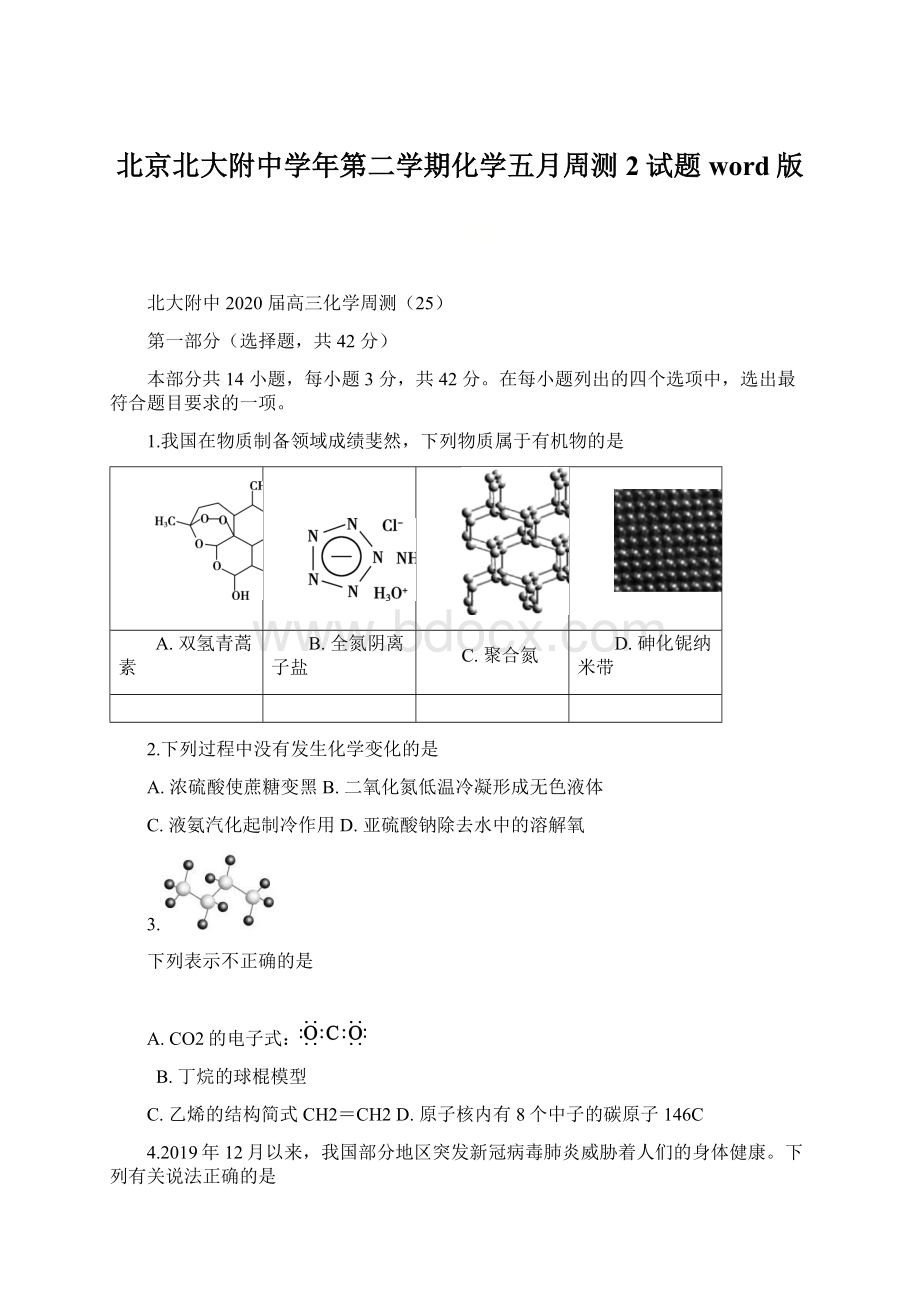
A.原子半径:
r(X)<r(Y)<r(Z)<r(W)
B.W的最高价氧化物的水化物是一种弱碱
C.Y的单质的氧化性比Z的强
D.X、Y、Z三种元素可以组成共价化合物和离子化合物
6.下列实验方案中不.能.达到相应实验目的的是
A
B
C
D
方案
已知溶解度(20℃)
NaHCO3:
9.6gNa2CO3:
21.8g
将NO2球浸泡在冷水和热水中
目的
探究浓度对化学反应速率的影响
制备氨气
室温下比较
NaHCO3和
Na2CO3的溶解度
探究温度对化学平衡的影响
7.
高能LiFePO4电池,多应用于公共交通。
电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过,结构示意如图所示。
原理如下:
(1−x)LiFePO4+xFePO4+LixCn==LiFePO4+nC
下列说法不正确的是
A.放电时,正极电极反应式:
xFePO4+xLi++xe−==xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:
xLi++xe−+nC==LixCn
D.充电时,Li+向左移动
8.下列解释事实的方程式不.正.确.的是
A.用过量氨水除去烟气中的二氧化硫:
SO2+2NH3·
H2O==(NH4)2SO3+H2O
B.呼吸面具中用过氧化钠吸收二氧化碳产生氧气:
2Na2O2+2CO2==2Na2CO3+O2
C.电解饱和氯化钠溶液产生气体:
2NaCl+2H2O电解2NaOH+H2↑+Cl2↑
D.用浓硝酸除去试管内壁上附着的铜:
8H++2NO3−+3Cu==3Cu2++2NO↑+4H2O
9.氮及其化合物的转化过程如下图所示:
下列分析合理的是
A.催化剂a表面发生了极性共价键的断裂和形成
B.N2与H2反应生成NH3的原子利用率为100%
C.在催化剂b表面形成氮氧键时,不涉及电子转移
D.催化剂a、b能提高反应的平衡转化率
10.
乙烯气相直接水合反应制备乙醇:
C2H4(g)+H2O(g)C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1mol,容器体积为1L)。
下列分析不正确的是
A.乙烯气相直接水合反应的∆H<0
B.图中压强的大小关系为:
p1>p2>p3
C.
图中a点对应的平衡常数K=5
16
D.达到平衡状态a、b所需要的时间:
a>b
11.线型PAA(
)具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。
网状PAA的制备方法是:
将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。
其部分结构片段如
右图所示。
下列说法不.正.确.的是
A.线型PAA的单体不存在顺反异构现象
B.形成网状结构的过程发生了加聚反应
C.交联剂a的结构简式是CHCH2
D.
PAA的高吸水性与—COONa有关
12.高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
下列叙述不.正.确.的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应Ⅰ中尾气后可再利用
C.反应Ⅱ中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:
Na2FeO4<K2FeO4
13.已知:
[FeCl4(H2O)2]−为黄色,下列实验所得结论不.正.确.的是
①
②
③
④
0.1mol/LFe2(SO4)3溶液
酸化的0.1mol/LFe2(SO4)3溶液
少量NaCl
固体
0.1mol/LFeCl3溶液
加热前溶液为浅黄色,加热后颜色变深
加热前溶液接近无色,加热后溶液颜色无明显变化
加入NaCl后,溶液立即变为黄色,加热后溶液颜色变深
加热前溶液为黄色,加热后溶液颜色变深
注:
加热为微热,忽略体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在可逆反应:
Fe3++4Cl−+2H2O[FeCl4(H2O)2]−
D.实验④中,加热后颜色变深可证明升高温度,Fe3+水解平衡正向移动
14.常温下,在HA和NaA的混合溶液中c(HA)+c(A−)=0.1mol·
L−1,溶液中c(HA)和c(A−)的大小随着pH变化的关系如图所示。
下列有关叙述不正确的是
A.常温下,HA的电离平衡常数为10−4.75
B.在pH=3.75溶液中:
c(Na+)+c(H+)+c(HA)=c(OH−)+0.1mol·
L−1
C.在pH=5.75溶液中:
c(OH−)<c(H+)<c(A−)<c(HA)
D.在K点的溶液中,HA的电离程度大于A−的水解程度
第二部分(非选择题,5个小题,共58分)
本部分共5大题。
请用黑色字迹签字笔在答题卡上各题的答题区域内作答,在试卷上作答无效。
15.(10分)将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ
克劳斯法
Ⅱ
铁盐氧化法
Ⅲ
光分解法
①反应Ⅰ的化学方程式是。
②反应Ⅱ:
+1H2S==Fe2++S↓+(将反应补充完整)。
③反应Ⅲ体现了H2S的稳定性弱于H2O。
结合原子结构解释二者稳定性差异的原因
。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。
我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如下图。
过程甲、乙中,氧化剂分别是。
(3)按照设计,科研人员研究如下:
①首先研究过程乙是否可行,装置如右图。
经检验,n极区产生了Fe3+,p极产生了H2。
n极区产生Fe3+的可能原因:
ⅰ.Fe2+−e−==Fe3+
ⅱ.2H2O−4e−==O2+4H+,(写离子方程式)。
经确认,ⅰ是产生Fe3+的原因。
过程乙可行。
②光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。
研究S产生的原因,设计如下实验方案:
经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。
过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如右图。
进一步研究发现,除了Fe3+/Fe2+外,I3−/I−也能实现上图所示循环过程。
结合化学用语,说明I3−/I−能够使S源源不断产生的原因:
16.(13分)3−四氢呋喃甲醇是合成农药呋虫胺的中间体,其合成路线如下:
请回答下列问题:
(1)A生成B的反应类型是,B中含有的官能团是。
(2)D发生酯化反应生成E的化学方程式为。
(3)3−四氢呋喃甲醇有多种同分异构体,请写出其中两种符合下列条件的有机物的结构简式:
、。
①能发生水解反应②分子中有3个甲基
(4)G的结构简式为。
(5)生成G的过程中常伴有副反应发生,请写出一定条件下生成高分子聚合物的化学方程式:
(6)
还可以利用
与K发生加成反应合成3−四氢呋喃甲醇,写出K和H的结构简式。
17.
HIO3
①白色固体,能溶于水,难溶于四氯化碳
②Ka=0.169
KIO3
①白色固体,能溶于水,难溶于乙醇
②碱性条件下易发生反应:
−−−
ClO−+IO3==IO4+Cl
(10分)碘酸钾(KIO3)是重要的食品添加剂。
某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。
制取碘酸(HIO3)的实验装置示意图和有关资料如下:
回答下列问题:
步骤Ⅰ用Cl2氧化I2制取HIO3。
(1)装置A中发生反应的化学方程式为。
(2)装置B中的CCl4可以加快反应速率,原因是。
(3)反应结束后,获取HIO3溶液的操作中,所需主要玻璃仪器的名称为。
步骤Ⅱ用KOH中和HIO3制取KIO3。
(4)该中和反应的离子方程式为。
中和之前,应将上述HIO3溶液煮沸至接近无色,否则中和时易生成(填化学式)而降低KIO3的产量。
(5)往中和后的溶液中加入适量,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量SO2饱和溶液,摇匀,再加入几滴淀粉溶液,溶液
变蓝。
若实验时,所加的SO2饱和溶液过量,则无蓝色出现,原因是。
步骤Ⅲ纯度测定
(7)取0.1000g产品于碘量瓶中,加入稀盐酸和足量KI溶液,用0.1000mol/LNa2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32−==2I−+S4O62−)。
进行平行实验后,平均消耗Na2S2O3溶液的体积为24.00mL。
则产品中KIO3的质量分数为。
(KIO3的摩尔质量为214.0g/mol)
18.(10分)金是一种用途广泛的贵重金属。
某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:
资料:
①Zn+1/2O2+H2O==Zn(OH)2
②Zn2+(aq)CN-Zn(CN)(s)CN-Zn(CN)2−(aq)
(1)步骤2中发生的反应有:
2
①2Au(s)+4CN−(aq)+2H2O(l)+O2(g)==2Au(CN)−(aq)+2OH−(aq)+H2O2(aq)
∆H=−197.61kJ·
mol−1
②2Au(s)+4CN−(aq)+H2O2(aq)==2Au(CN)−(aq)+2OH−(aq)∆H=−386.93kJ·
则2Au(s)+4CN−(aq)+H2O(l)+1/2O2(g)==2Au(CN)−(aq)+2OH−(aq)的∆H=。
(2)
右图是步骤2中金的溶解速率与温度的关系。
80℃以后溶解速率降低的原因是。
(3)步骤4的目的是。
(4)步骤5置换的总反应是:
22422
2Au(CN)−+3Zn+4CN−+2HO===2Au+2Zn(CN)2−+ZnO2−+2H↑
则以下说法正确的是(填字母序号)。
A.步骤5进行时要先脱氧,否则会增加锌的用量
B.若溶液中c(CN−)过小,会生成Zn(CN)2,减缓置换速率
C.实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN−)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。
碱性条件下,用Cl2将贫液中的CN−氧化成无毒的CO2和N2,该反应的离子方程式为
19.(15分)某小组同学对FeCl3与KI的反应进行探究。
【初步探究】室温下进行下表所列实验。
序号
操作
现象
实验Ⅰ
取5mL0.1mol·
L−1KI溶液,滴加0.1mol·
L−1FeCl3溶液5~6滴
(混合溶液pH=5)
溶液变为棕黄色
实验Ⅱ
取2mL实验Ⅰ反应后的溶液,滴加2滴0.1mol·
L−1KSCN溶液
溶液呈红色
(1)证明实验Ⅰ中有I2生成,加入的试剂为。
(2)写出实验Ⅰ反应的离子方程式。
(3)结合上述实验现象可以证明Fe3+与I−发生可逆反应,原因是。
【深入探究】20min后继续观察实验现象:
实验Ⅰ溶液棕黄色变深;
实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I−可被空气氧化为I2,故甲同学提出假设:
该反应条件下空气将I−氧化为
I2,使实验Ⅰ中溶液棕黄色变深。
甲同学设计实验:
,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因.素.可能是(写出两条)。
(5)乙同学查阅资料可知:
FeCl3与KI的反应体系中还存在I−+I2I3−,I3−呈棕褐色。
依据资料从平衡移动原理解释实验Ⅱ中20min后溶液红色变浅的原因:
。
(6)丙同学针对20min后的实验现象继续提出假设:
FeCl3与KI的反应、I−与I2的反应达到平衡需要一段时间,有可能20min之前并未达到平衡。
为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为