华东师大版度九年级上学期期中科学试题D卷Word下载.docx
《华东师大版度九年级上学期期中科学试题D卷Word下载.docx》由会员分享,可在线阅读,更多相关《华东师大版度九年级上学期期中科学试题D卷Word下载.docx(16页珍藏版)》请在冰豆网上搜索。
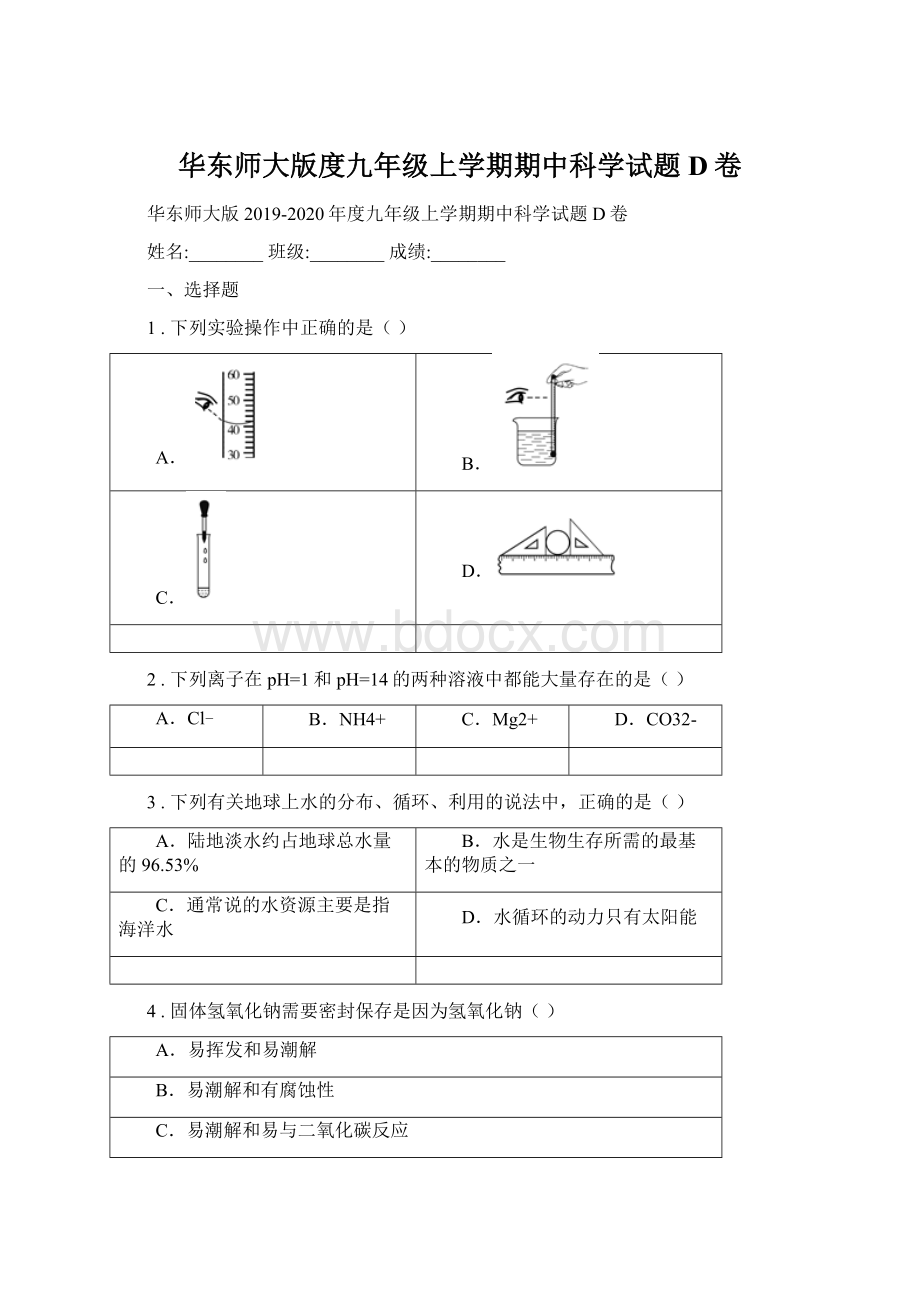
下列说法正确的是()
A.滤渣中一定有Ag、Cu、Fe
B.滤液中一定没有AgNO3
C.滤液中一定含有Zn(NO3)2、Fe(NO3)2
D.该过程至少发生了三个化学反应
7.下列金属中,金属活动性最强的是()
A.钾
B.铁
C.铜
D.金
8.实验室常用加热氯酸钾和二氧化锰的混合物来制取O2,下列说法错误的是()
A.该反应属于分解反应
B.固体减少的质量等于生成O2的质量
C.MnO2加快了反应速率
D.反应前后氯元素呈现的化合价分别为+3价和﹣1价
9.向一定质量的稀盐酸中加入镁粉至过量,若下图中横坐标表示镁粉的质量,则纵坐标表示()
A.溶液的质量
B.稀盐酸的质量
C.氯化镁的质量
D.生成气体的质量
10.下列过程中主要只涉及物理变化的是()
A.硫酸使白纸变黑
B.灼烧法鉴别羊毛和合成纤维
C.生石灰遇水变成熟石灰
D.酒精浸泡紫罗兰花自制酸碱指示剂
11.实验室鉴别KOH、CuSO4、BaCl2、K2SO4四瓶溶液时,最少要用到的试管支数是()
A.2
B.3
C.4
D.5
12.农业生产采取的下列措施与其依据(或目的)不一致的是()
A.把农作物种子播种在湿润的土壤中——种子萌发需要水分
B.白天为大棚作物补充二氧化碳——增强光合作用
C.适时给农作物施化肥——为植物生长提供有机物
D.给农作物松土——有利于根部的呼吸
13.据新闻报道,今年4月,一辆运输浓盐的车辆发生事故,导致酸液泄露闹市,经喷水和散石灰处理后,排除了险情,对喷水和撒石灰的做法解释错误的是()
A.喷水可以减少浓盐酸挥发
B.喷水可以降低盐酸的酸性
C.撒石灰为了消除盐酸污染
D.喷水是尽快把盐敢冲进下水道
14.在盛沙的漏斗下边放一木板,让漏斗摆动起来,同时其中的细沙匀速流出,经历一段时间后,观察木板上沙子的堆积情况,则沙堆的剖面应是下图中的()
15.久置的石灰水试剂瓶的内壁有一层白膜,要除去白膜最好用()
A.氯化钠溶液
B.苛性钠溶液
C.稀盐酸
D.硫酸钠
16.制取合金常用的方法是将两种或多种金属(也可以是金属和非金属)加热到某一温度,使其全部熔化,再冷却成为合金。
试根据下表中的数据判断(其他条件均满足),下列合金不宜采用上述方法制取的是()
金属
钠
镁
铝
铜
铁
熔点(℃)
97.5
649
660
1083
1535
沸点(℃)
883
1090
2467
2567
2750
A.铁-铜合金
B.镁-铁合金
C.钠-铝合金
D.钠-铜合金
二、填空题
17.下列选项中,属于物理性质的是;
属于化学性质的是____;
属于化学变化的是____。
A.牛奶变酸
B.干冰升华
C.铁易生锈
D.石蜡熔化
E.白糖易溶于水
F.氧气是一种无色、无味的气体
18.科学家通过实验探索某一定质量的气体在体积不变的情况下压强P随温度t变化的规律,得到如下表所示的一组t和P的数据:
实验次数
1
2
3
4
5
气体温度t/℃
25
50
75
100
气体压强/(×
103pa)
110
120
130
140
(1)分析表中的实验数据可推知,一定质量的气体在体积不变的情况下,压强P随温度t的升高而________;
(2)在夏天,打足气的自行车车胎在阳光下曝晒也会爆破,这是怎么回事呢?
请你用上述表中的数据解释下。
________。
(3)当气体温度为20℃时,气体的压强是________。
19.现有甲、乙、丙三种金属,采用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系,如图。
则三种金属的活动性由弱到强的顺序是__________。
若将过量的丙金属,逐渐加入甲和乙的硫酸盐混合溶液中,充分反应后,剩余固体有__________种。
当溶液中的阳离子只有2种时,则剩余固体的组成情况有__________种。
20.高空抛物现象曾被称为“悬在城市上空的痛”。
有数据表明:
一个蛋从4楼抛下来就会让人起肿包;
从8楼抛下来就可以让人头皮破裂;
从18楼高抛下来就可以砸破行人的头骨;
从25楼抛下可使人当场死亡。
一个物体具有的能越大,所能做的功就越多。
当一枚60g鸡蛋从60米高楼落下时________能转化为动能,若不考虑空气阻力等影响,其落到地面时由于重力做功获得的动能是________焦。
21.如图是一些常见物质间互相转化的关系图(部分反应条件已省略)。
A、B均为无色气体,X为固体,Y为能使澄清石灰水变浑浊的无色气体,E、F为常见金属,试推断:
(1)乙、戊物质的化学式分别为________。
(2)写出下列转化的化学方程式(丙+X→F+Y):
22.硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料.
(1)从组成上看,两者的不同点是_____.
(2)只用一种试剂,鉴别两瓶失去标签的稀盐酸和稀硫酸溶液,你选用的试剂是_____.
23.金属材料中铜是人类应用比较广泛的金属之一,某学习小组欲测定铜的相对原子质量,设计如下实验方案,步骤如下:
①连接好装置;
②检查装置气密性;
③装入药品;
④
;
⑤D中黑色固体完全反应变成红色后,停止加热;
⑥待D中玻璃管冷却至室温,关闭分液漏斗活塞;
⑦数据处理。
(1)实验步骤④的正确操作是__________(填序号)
A.
先点燃酒精灯加热,一段时间后再打开分液漏斗活塞,滴加盐酸
B.
先打开分液漏斗活塞,滴加稀盐酸;
一段时间后点燃酒精灯加热
C.
打开活塞滴加盐酸和点燃酒精灯加热,谁先谁后都可以
(2)B装置中水的作用________,装置B中长玻璃管的作用是使装置气压平衡。
(3)已知:
CuO样品质量为m1克,E中增重为m2克,D中反应后的固体质量为m3克,A中反应产生氢气的质量为m4克,以下数据中能计算铜的相对原子质量的是(_______)
m1、m2
m2、m3
m1、m3
A.
m2、m4
(4)若使制取氢气是装置随开随用,随关随停,可选用下列装置中的________
三、探究题
24.某科学兴趣小组利用铜丝、铁丝、FeSO4溶液、CuSO4溶液、AgNO3溶液等实验药品,来探究铁、铜与银三种金属的化学活动性,并设计了如图所示的实验方案:
将铁丝与铜丝分别浸入盛有CuSO4溶液和AgNO3溶液的两支试管中,观察实验现象。
试回答下列问题:
(1)若得到铁比铜活泼的结论,实验中观察到的现象是________。
(2)本实验中取用的CuSO4溶液和AgNO3溶液的质量是否一定要相等?
________
(选填“是”或“否”)
(3)请你利用上述实验药品,设计另一种方案,来比较铁、铜、银三种金属之间的化学活动性,请在答题卷图中标注所选溶液及金属丝的名称。
25.实验室可利用碱式碳酸铜(化学式:
Cu2(OH)2CO3)制备氧化铜,并进行碳粉还原氧化铜的实验。
①制备氧化铜并检验产物,装置如图所示(省略夹持仪器):
步骤一:
连接A和B,打开活塞,通入空气。
步骤二:
关闭活塞,连上C和D,开始加热。
步骤三:
在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热。
加热时间(min)
t1
t2
t3
B中固体质量(g)
6.66
5.20
4.80
B中发生反应的化学方程式为:
Cu2(OH)2CO3═2CuO+H2O+CO2↑
A的作用是吸收空气中的
,防止对产物检验造成干扰。
②一定量碳粉还原①中制得的氧化铜并检验产物,装置如图所示:
实验过程中,观察到F中溶液变浑浊,E中的现象是
。
26.某同学将打磨过的铝箔加入到氢氧化钠溶液中,结果发现也有气泡产生,为了解该气体的成分,实验小组进行了以下探究活动:
(作出猜想)
猜想一:
氧气;
猜想二:
氢气;
猜想三:
氮气。
(1)其他同学认为猜想三是错误的,理由是_____________。
(进行实验)
分别进行实验:
(2)利用图甲装置进行实验:
反应一段时间后,观察到带火星的木条不能复燃,则猜想一错误。
(3)利用图乙装置进行实验:
反应一段时间气体验纯后,在尖嘴处点火观察到________,则猜想二正确。
(得出结论)(4)氢氧化钠、水、铝能反应生成偏铝酸钠(NaAlO2)和氢气,请写出此反应的化学方程式__________________。
27.某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂.因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究.
(提出问题)该烧杯内溶液中的溶质是什么?
(猜想)猜想一:
可能是CaCl2和Ca(OH)2;
猜想二:
可能只有CaCl2;
猜想三:
(查阅资料)氯化钙溶液呈中性.
(方案设计)
方案
方法步骤
实验现象
实验结论
方案一
取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液
猜想一不正确
方案二
取少量烧杯内的溶液于试管中,逐滴加入碳酸钠溶液至过量
猜想二不正确猜想三正确
(反思与拓展)
①在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物的用量.
②随着大家环保意识的增强,实验室产生的污染越来越受到重视,实验中产生的污染物必须无害化处理后再排放.要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的________.
28.用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置。
准确称取15g干燥样品进行实验。
装置丙
装置丁
反应前
48.8g
161.2g
反应后
46.5g
163.9g
(1)该实验中,装置乙的作用是________
(2)准确称取完全反应前后装置丙和丁的质量如表:
小明根据装置丙减少的质量就是氧元素质量,求得氧化铜的质量为___g,氧化铜的纯度为________%。
(3)小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度。
_____(写出计算过程)
(4)比较小明和小丽的计算结果,请分析导致这一结果的原因可能是______。
A.装置的气密性不好
B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足
D.空气中的二氧化碳被丁处浓硫酸吸收
29.为了探究物体动能大小的影响因素,同学们设计了如图甲、乙、丙所示的实验装置,让小球从同一斜面由静止开始下滑,撞击水平木板上的木块来进行实验。
请回答下列问题:
(1)本实验是研究动能大小与________关系。
(2)比较甲乙两次实验可以得到的结论是________。
(3)某同学改用如图丁所示装置探究小球的动能与质量的关系,为了让小球到达B点时速度相同,用质量不同的小球,每次将弹簧压缩到A位置,然后静止释放,该方案是否可行,并说明理由________。
30.某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题:
(1)小悦同学从某一欠收农田里取回一份土壤样品,如果检测结果呈酸性,从经济和可行方面考虑,那么要改良此土壤的酸性,应向农田里施加___________(填化学式)。
(2)小悦同学用下图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
I.为了验证反应①,小红将无色酚酞试液滴入NaOH溶液中,溶液由无色变成__________。
II.依据反应④说明NaOH必须密封保存,否则在空气中要变质,其化学反应方程式为:
______________。
检验NaOH是否变质,你选择的试剂是__________________。
III.为了验证反应③能够发生,你选择的试剂是_______________,对应的化学方程式是____________________。
(3)请你设计一个实验除去FeSO4溶液中少量的CuSO4,写出主要操作步骤和化学方程式。
实验主要操作步骤:
____________、_____________,化学方程式:
________________。
四、简答题
31.图甲是一种稀释瓶,用户可以根据需求用它以一定体积比对原液进行稀释,图乙是它的7种不同比列的稀释方式。
小科用该稀释瓶按1:
2的比例稀释原液,原液是密度为1.5g/mL、溶质质量分数为50%的氢氧化钠溶液。
稀释过程中,不考虑温度变化和混合前后的体积变化。
稀释得到的氢氧化钠溶液的密度为_____g/mL,溶质质量分数为_____。
(计算结果分别精确到0.1g/mL和0.1%)
32.X、Y、Z、M、Q为生活中的常见物质,Q为单质,其余为化合物,X为呼吸作用的产物,M为光合作用的产物,Z常温下为液体。
各物质之间的转化关系如图所示(部分反应物、生成物、转化关系及反应条件未标出),回答下列问题:
(1)M属于_________(填“无机物”或“有机物”)。
(2)Q的化学式为____________。
(3)若Y属于盐类物质,则X→Y可能发生的反应的化学方程式为___(举一例)。
33.某纯碱中含有少量氯化钠杂质,为检验其纯度,小周取出27g纯碱样品,平均分成五份,依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应、待气体充分溢出后,用天平称质量(如图),得到如下表数据。
请计算:
第一次
第二次
第三次
第四次
第五次
加入纯碱样品的质量/g
5.4
电子天平的示数/g
163.2
166.4
169.6
173.9
179.3
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是________g。
(2)计算纯碱样品中碳酸钠的质量分数是多少?
(精确到0.1%)_______
(3)关于所用稀盐酸的质量分数,三位同学做法各不相同(如图)。
判断谁的做法正确,并分析另两位同学的错误之处。
芳芳的解法:
明明的解法:
秀秀的解法:
_______.
参考答案
1、
2、
3、
4、
5、
6、
7、
8、
9、
10、
11、
12、
13、
14、
15、
16、