高考化学600分策略二轮讲义第1部分 板块1 专题4 氧化还原反应Word下载.docx
《高考化学600分策略二轮讲义第1部分 板块1 专题4 氧化还原反应Word下载.docx》由会员分享,可在线阅读,更多相关《高考化学600分策略二轮讲义第1部分 板块1 专题4 氧化还原反应Word下载.docx(14页珍藏版)》请在冰豆网上搜索。
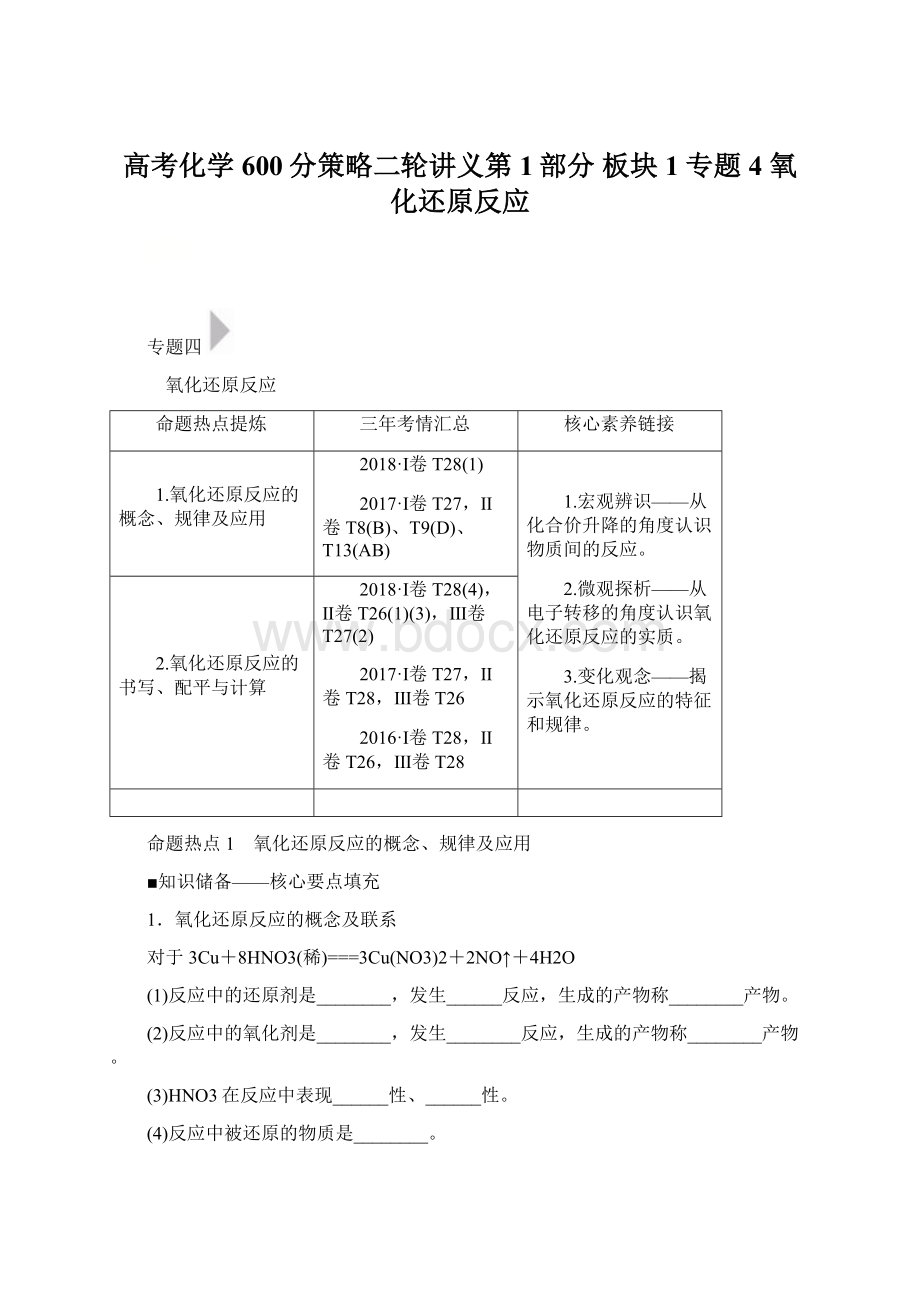
MnCl2+Cl2↑+2H2O,
Cl2+2FeCl2===2FeCl3,2FeCl3+2KI===I2+2FeCl2+2KCl。
则MnO2、Cl2、FeCl3、I2的氧化性强弱顺序为________________________,
Cl-、Mn2+、Fe2+、I-的还原性强弱顺序为__________________________。
(2)KClO3+6HCl===KCl+3Cl2↑+3H2O反应中,氧化产物为________,还原产物为________,二者的物质的量之比为________。
(3)证明还原性Fe2+比Br-强的离子方程式为_______________________
__________________________________________________________。
(4)向含有2molFeBr2的溶液中通入1.5molCl2充分反应,写出离子方程式:
___________________________________________________________。
(5)在酸性条件下,可发生如下反应:
ClO
+2M3++4H2O===M2O
+Cl-+8H+,M2O
中M的化合价是________。
【答案】
(1)MnO2>Cl2>FeCl3>I2,I->Fe2+>Cl->Mn2+
(2)Cl2 Cl2 5∶1
(3)Br2+2Fe2+===2Fe3++2Br-
(4)4Fe2++2Br-+3Cl2===4Fe3++Br2+6Cl-
(5)+6
3.正误判断(正确的打“√”,错误的打“×
”)
(1)同一元素价态越高氧化性一定越强。
( )
(2)在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原。
( )
(3)得电子难的物质,失电子一定越容易。
(4)元素由化合态变为游离态不一定被氧化,也可能被还原。
(5)在反应中,得电子越多的物质氧化性越强。
(6)浓H2SO4具有强氧化性,SO2具有还原性,二者能反应。
【答案】
(1)×
(2)√ (3)×
(4)√ (5)×
(6)×
■真题再做——感悟考法考向
1.(2018·
全国卷Ⅰ,节选)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。
该反应的氧化产物是一种气体,其分子式为________。
【解析】 氯气与硝酸银反应生成N2O5,氯气作氧化剂,还原产物为氯化银,又硝酸银中氮元素、银元素已经是最高化合价,则只能是氧元素化合价升高,所以气体氧化产物为O2。
【答案】 O2
2.
(1)(2016·
全国卷Ⅱ,节选)联氨是一种常用的还原剂。
向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_____________________________。
(2)(2015·
全国卷Ⅰ,节选)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为________。
(3)(2015·
全国卷Ⅱ,节选)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。
若要除去超标的亚氯酸盐,下列物质最适宜的是________(填标号)。
a.明矾 b.碘化钾
c.盐酸 d.硫酸亚铁
【解析】
(1)Ag+具有强氧化性,N2H4具有还原性,二者反应生成Ag和N2。
(2)还原产物是氧化剂被还原的产物,即MnO2→MnSO4。
(3)亚氯酸盐具有氧化性,要除去亚氯酸盐需加入还原剂且无毒,故应加FeSO4。
加入KI生成I2,有毒性。
【答案】
(1)固体逐渐变黑,并有气泡产生
(2)MnSO4 (3)d
3.(2014·
全国卷Ⅰ,节选)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
(1)H3PO2中,P元素的化合价为________。
(2)利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
【解析】
(1)H3PO2中P元素化合价为+1。
(2)根据H3PO2与Ag+反应中两者物质的量之比为1∶4,4molAg+在反应中得到4mole-,1molH3PO2则失去4mole-,所以磷元素将显+5价,产物为H3PO4,即氧化产物为H3PO4。
【答案】
(1)+1
(2)H3PO4
(1)两主线
(2)五规律
■模拟尝鲜——高考类题集训
1.O2F2可以发生反应:
H2S+4O2F2===SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48LHF,则转移0.8mol电子
D.还原剂与氧化剂的物质的量之比为1∶4
D [H2S中硫元素为-2价,生成的SF6中硫元素为+6价,O2F2中氧元素为+1价,生成的O2中氧元素为0价。
所以H2S是还原剂,O2F2是氧化剂,氧气是还原产物,A项、B项错误;
没有指明外界条件,所以生成4.48LHF,转移电子数无法计算,C项错误;
还原剂与氧化剂的物质的量之比为1∶4,D项正确。
]
2.(2018·
西安八校联考)CsICl2常用于化学上的分子筛技术,它既有氧化性又有还原性,下列有关说法正确的是( )
A.CsICl2有氧化性,是因为Cs显+3价
B.CsICl2有还原性,是因为含有较强还原性的I-
C.酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色
D.在CsICl2溶液中滴加HNO3,可生成Cl2
C [CsICl2中Cs为+1价,I为+1价,Cl为-1价,CsICl2具有氧化性,是因为I显+1价,A项错误;
CsICl2具有还原性,是因为含有较强还原性的Cl-,B项错误;
酸性高锰酸钾溶液具有强氧化性,滴加CsICl2溶液,Cl-与MnO
在酸性条件下发生氧化还原反应,MnO
被还原为Mn2+,溶液褪色,C项正确;
硝酸不能将Cl-氧化为Cl2,故在CsICl2溶液中滴加HNO3,无Cl2生成,D项错误。
3.(2018·
唐山质检)已知H2SO3+I2+H2O===H2SO4+2HI,将0.1molCl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法正确的是( )
A.物质的还原性:
HI>H2SO3>HCl
B.H2SO3的物质的量浓度为0.6mol·
L-1
C.若再通入0.05molCl2,则恰好能将HI和H2SO3完全氧化
D.通入0.1molCl2发生反应的离子方程式为5Cl2+4H2SO3+2I-+4H2O===4SO
+I2+10Cl-+16H+
D [由已知反应可知,还原性:
H2SO3>HI,故向混合溶液中通入Cl2后先发生反应:
Cl2+H2SO3+H2O===2HCl+H2SO4,H2SO3反应完全后发生反应:
Cl2+2HI===I2+2HCl,则还原性:
HI>HCl,故还原性:
H2SO3>HI>HCl,A项错误;
设HI和H2SO3的物质的量浓度均为xmol·
L-1,根据二者分别与Cl2反应的化学方程式并结合有一半的HI被氧化可知Cl2完全反应,则0.1x+
=0.1,解得x=0.8,B项错误;
混合溶液中还剩余0.04molHI未被氧化,故只需再通入0.02molCl2,即可恰好将HI和H2SO3完全氧化,C项错误;
通入0.1molCl2后,0.08molH2SO3和0.04molHI完全反应,即参与反应的n(Cl2)∶n(H2SO3)∶n(HI)=5∶4∶2,反应的离子方程式为5Cl2+4H2SO3+2I-+4H2O===4SO
+I2+10Cl-+16H+,D项正确。
4.(2018·
山东、安徽名校大联考)ClO2是一种橙黄色到黄绿色的气体,极易溶于水,可用于水的消毒杀菌、水体中Mn2+等重金属的除去及烟气的脱硫脱硝等。
回答下列问题:
(1)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,NaClO2中Cl元素的化合价是________,该反应中氧化剂和还原剂的物质的量之比为________。
(2)将ClO2通入MnSO4溶液,溶液中可检测到Cl-,同时有黑色MnO2沉淀生成。
①ClO2和MnO2均属于氧化物,理由是____________________________
②该反应的离子方程式为____________________________________。
【解析】
(1)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,NaClO2中Cl元素的化合价为+3价,该反应中过硫酸钠(Na2S2O8)中有两个氧原子的化合价为-1价,反应后降低为-2价,过硫酸钠为氧化剂,亚氯酸钠(NaClO2)中Cl元素的化合价由+3价升高为+4价,亚氯酸钠为还原剂,根据得失电子守恒,氧化剂与还原剂的物质的量之比为1∶2。
(2)①ClO2和MnO2均含两种元素,且其中一种为氧元素,属于氧化物。
②将ClO2通入MnSO4溶液中可检测到Cl-,同时有黑色MnO2沉淀生成,反应的离子方程式为2ClO2+5Mn2++6H2O===5MnO2↓+12H++2Cl-。
【答案】
(1)+3 1∶2
(2)①均含两种元素,且其中一种为氧元素
②2ClO2+5Mn2++6H2O===5MnO2↓+12H++2Cl-
命题热点2 氧化还原反应的书写、配平与计算
全国卷Ⅱ,节选)闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)焙烧过程中主要反应的化学方程式为___________________________。
【答案】 2ZnS+3O2
2ZnO+2SO2
2.(2017·
全国卷Ⅲ,节选)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。
工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。
写出发生反应的化学方程式_____________________
_________________________________________________________。
【解析】 书写氧化还原反应方程式步骤为:
①定“两剂”和“两物”
As2S3+O2―→H3AsO4+S;
②升降法定“两剂”和“两物”的化学计量数
10 4
↑ ↓
2As2S3+5O2―→4H3AsO4+6S;
③观察配平或补加其他物质
2As2S3+5O2+6H2O===4H3AsO4+6S;
④查守恒定答案。
根据分析,易写出化学方程式。
【答案】 2As2S3+5O2+6H2O===4H3AsO4+6S
3.
(1)(2017·
全国卷Ⅰ,节选)已知:
FePO4
LiFePO4,请写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______________________________________________________________。
(2)(2017·
全国卷Ⅱ,节选)将水样(含O2)与Mn(OH)2碱性悬浊液(含KI)混合,反应生成MnO(OH)2,实现氧的固定,写出“氧的固定”中发生反应的化学方程式____________________________________________________
【解析】
(1)煅烧过程中,FePO4中的+3价Fe降为LiFePO4中的+2价Fe,则知H2C2O4作还原剂,化合价由+3价C变为+4价C(CO2),可写出方程式。
(2)由题意可知Mn(OH)2被O2氧化为MnO(OH)2。
【答案】
(1)2FePO4+Li2CO3+H2C2O4
2LiFePO4+3CO2↑+H2O
(2)2Mn(OH)2+O2===2MnO(OH)2
4.(2016·
全国卷Ⅰ)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
(1)NaClO2中Cl的化合价为________。
(2)写出“反应”步骤中生成ClO2的化学方程式:
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:
每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
NaClO2的有效氯含量为________。
(计算结果保留两位小数)
【解析】
(1)由化合价规则知,NaClO2中Cl的化合价为+3。
(2)由工艺流程图可以看出SO2、H2SO4、NaClO3为反应物,ClO2、NaHSO4为生成物,再根据化合价升降法配平得出化学方程式为SO2+H2SO4+2NaClO3===2ClO2+2NaHSO4。
(3)粗盐水精制时除去Mg2+通常用NaOH溶液,生成氢氧化镁沉淀,过滤除去;
除去Ca2+通常用Na2CO3溶液,生成碳酸钙沉淀,过滤除去。
电解时阴极为得电子极,因此产物的化合价应降低,即生成NaClO2。
(4)由信息“尾气吸收”是吸收“电解”过程排出的少量ClO2知,反应物之一为ClO2,再由生产工艺流程图知,用的吸收试剂是NaOH、H2O2,由生产工艺流程图知产物之一为NaClO2,由ClO2生成NaClO2,Cl的化合价由+4变为+3,化合价降低,ClO2为氧化剂,则H2O2为还原剂,化合价升高,生成氧气,再由电子守恒得,此吸收反应中氧化剂与还原剂的物质的量之比为2∶1,该反应中氧化产物是O2。
(5)由信息知,要求出每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,先求得1gNaClO2变为Cl-转移的电子数为
×
4NA,再设有xgCl2变为Cl-的氧化能力与1gNaClO2的氧化能力相当,列方程得
4NA=
2NA,解得x≈1.57,即为有效氯含量。
【答案】
(1)+3
(2)2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4 (3)NaOH溶液 Na2CO3溶液 ClO
(或NaClO2) (4)2∶1 O2 (5)1.57
(1)一定背景下氧化还原方程式的书写步骤
①书写步骤
②补项原则
条件
补项原则
酸性条件下
缺H(氢)或多O(氧)补H+,少O(氧)补H2O(水)
碱性条件下
缺H(氢)或多O(氧)补H2O(水),少O(氧)补OH-
(2)利用电子守恒关系解题的思维流程
一找各物质
找出反应中的氧化剂、还原剂及相应的还原产物和氧化产物,并标出变价元素的化合价
二定得失数
找准一个原子(或离子)得失电子数目(注意化学式中粒子的个数)
三列守恒式
根据题中物质的物质的量和得失电子守恒列出等式关系:
n(氧化剂)×
变价原子个数×
化合价变化值=n(还原剂)×
化合价变化值
1.
(1)某地污水中的有机污染物主要成分是三氯乙烯(C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式:
__________________
____________________________________________________________。
(2)SO2通入FeCl3溶液中,反应的化学方程式:
_______________________
_____________________________________________________________。
(3)向盛有H2O2溶液的试管中加入几滴酸性KMnO4溶液(H2SO4酸化),溶液的紫色褪去,写出化学反应方程式:
____________________________。
(4)将NaBiO3固体(黄色,微溶)加入MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。
配平该反应的离子方程式:
NaBiO3+
Mn2++
________―→
Na++
Bi3++
________+
________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
FeO
+
H2O===
Fe(OH)3(胶体)+
O2↑+
OH-。
【解析】
(1)由题给条件知,KMnO4溶液与三氯乙烯反应产物有MnO2、CO2,根据原子守恒,产物中也有KCl、HCl,该反应中化合价的变化为KMnO4→MnO2,Mn元素由+7价→+4价,1molKMnO4得3mol电子;
C2HCl3→CO2,C元素由+1价→+4价,1molC2HCl3失去6mol电子,由得失电子守恒得,KMnO4的计量数为2,C2HCl3的计量数为1,结合原子守恒配平方程式得:
2KMnO4+C2HCl3===2KCl+2CO2↑+2MnO2+HCl。
(2)SO2在H2O的作用下被FeCl3氧化为SO
。
(3)H2O2被MnO
氧化为O2。
(4)①由溶液显紫色可推知有MnO
生成,确定变价元素物质的化学计量数:
②利用原子守恒确定缺项物质及其他物质的化学计量数。
5NaBiO3+2Mn2++
________―→5Na++5Bi3++2MnO
③据补项原则,在酸性条件下,方程式左边多O,故应补H+,而方程式右边少O,故应补H2O,再根据原子守恒配平H+和H2O之前的化学计量数分别是14和7。
(5)可利用(逆向配平)法。
【答案】
(1)2KMnO4+C2HCl3===2KCl+2CO2↑+2MnO2+HCl
(2)SO2+2H2O+2FeCl3===2FeCl2+H2SO4+2HCl
(3)5H2O2+2KMnO4+3H2SO4===K2SO4+2MnSO4+8H2O
(4)5 2 14H+ 5 5 2MnO
7H2O
(5)4 10 4 3 8
2.
(1)羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。
现用25.00mL0.049mol·
L-1的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol·
L-1的酸性KMnO4溶液完全作用。
已知(未配平):
FeSO4+KMnO4+H2SO4―→Fe2(SO4)3+K2SO4+MnSO4+H2O,则在上述反应中,羟胺的氧化产物是________。
(2)在含VO2+的溶液中加入KClO3,可使VO2+转化为VO
,则欲使3molVO2+变成VO
,需要氧化剂KClO3至少为________mol。
(3)多硫化钠Na2Sx(x>2)在碱性溶液中可被NaClO氧化为SO
,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1∶10,则x值为________。
(4)已知M2O
可与R2-作用,R2-被氧化为R单质,M2O
的还原产物中,M为+3价;
又知c(M2O
)=0.3mol·
L-1的溶液100mL可与c(R2-)=0.6mol·
L-1的溶液150mL恰好完全反应,则n值为________。
【解析】
(1)由题意知,KMnO4得到的电子数等于NH2OH失去的电子数。
设产物中N的化合价为n价。
则24.50mL×
0.020mol·
L-1×
5=25.00mL×
0.049mol·
(n+1),解得n=1。
故氧化产物为N2O。
(2)3molVO2+转变成VO
,共失去了3mol电子,而1molClO
变为Cl-得到6mol电子,所以需要0.5molKClO3。
(3)反应中氯元素的化合价由+1→-1,变化值是2,故1molNaClO在反应中得到2mol电子,根据得失电子守恒原理知,1molNa2Sx在反应中失去20mol电子。
Na2Sx中S元素显-
价,因此可得关系式:
(6+
)x=20,解得x=3。
(4)n(M2O
0.1L=0.03mol,n(R2-)=0.6mol·
0.15L=0.09mol,反应中M化合价降低到+3,R元素化合价升高到0。
设M2O
中M的化合价为x,则2x+2=2n,x=n-1,氧化还原反应中得、失电子数目相等,则有(n-1-3)×
0.03mol×
2=(2-0)×
0.09mol,n=7。
【答案】
(1)N2O
(2)0.5 (3)3 (4)7
3.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,常通过与浓硝酸或浓硫酸反应生成SeO2以回收Se。
完成下列填空。
(1)Se和浓硝酸反应的还原产物为NO和NO2,且NO和NO2的物质的