北京 高三化学总复习一轮复习 无机化学工艺流程专题训练文档格式.docx
《北京 高三化学总复习一轮复习 无机化学工艺流程专题训练文档格式.docx》由会员分享,可在线阅读,更多相关《北京 高三化学总复习一轮复习 无机化学工艺流程专题训练文档格式.docx(10页珍藏版)》请在冰豆网上搜索。
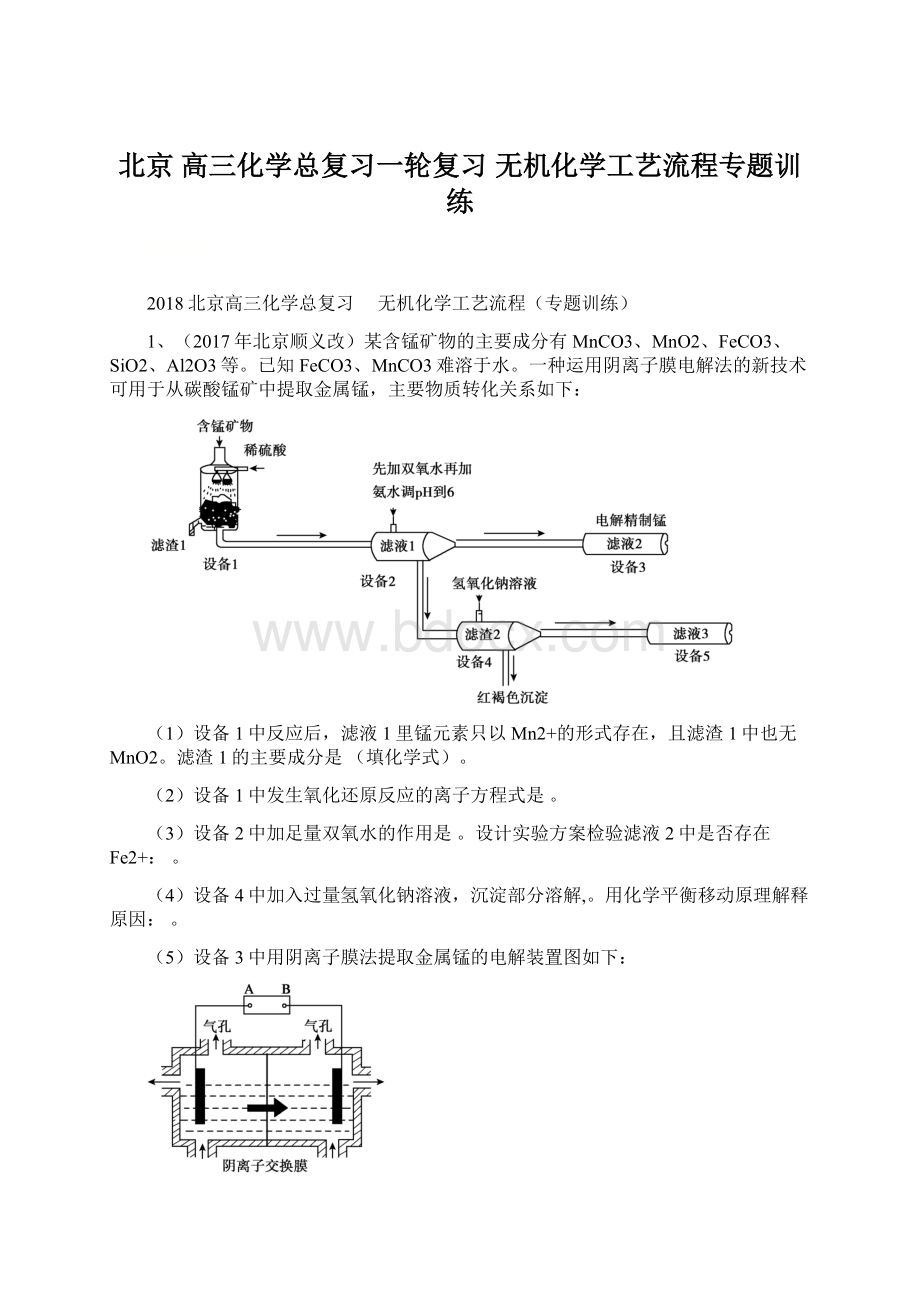
AlO2—+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解。
(5)①负极;
4OH——4e—=2H2O+O2↑②Mn2++2H2O-2e-=MnO2+4H+
2.某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:
(1)试剂a应选用________(填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、________(填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式____________________;
(4)实验室制取气体E的离子方程式是________________________,欲对气体E进行干燥和吸收,需选用下列装置中的________(填写序号);
(5)如何用化学方法检验气体E?
_______________________________。
答案
(1)稀盐酸
(2)烧杯、玻璃棒
(3)2FeCl3+Cu===2FeCl2+CuCl2
(4)MnO2+4H++2Cl-△,Mn2++Cl2↑+2H2O ②④
(5)将湿润的KI-淀粉试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl2
3、工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知:
生成氢氧化物沉淀的pH
Mn(OH)2
Fe(OH)2
Fe(OH)3
Cu(OH)2
开始沉淀时
8.3
6.3
2.7
4.7
完全沉淀时
9.8
3.7
6.7
注:
金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是。
盐酸溶解MnCO3的化学方程式是。
(2)向溶液1中加入双氧水时,反应的离子方程式是。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是。
(4)将MnCl2转化为MnO2的一种方法是氧化法。
其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:
5
2
□Mn2++□ClO3-+□____=□____+□____+□____。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
①生成MnO2的电极反应式是。
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。
检验Cl2的操作是。
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。
其原因是。
(1)增大接触面积,提高反应速率(2分)
MnCO3+2HCl=MnCl2+CO2↑+H2O(2分)
(2)2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+(1分)
(3)MnS+Cu2+=Mn2++CuS(1分)
(4)5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+(2分)
(5)①Mn2+-2e-+2H2O=MnO2+4H+(2分)
②将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成(1分)
③其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电。
)(2分,其余答案不得分)
4、(2015年北京海淀)某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。
某校研究小组尝试回收废旧正极材料中的钴。
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:
LiCoO2+4H++e-===Li++Co2++2H2O、。
阳极的电极反应式为。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。
当c(H2SO4)>
0.4mol·
L-1时,钴的浸出率下降,其原因可能为。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。
用以下步骤继续回收钴。
①写出“酸浸”过程中正极粉发生反应的化学方程式。
该步骤一般在80℃以下进行,温度不能太高的原因是。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是(填字母序号)。
a.c(NH4+)>
c(C2O42-)>
c(H+)>
c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(C2O42-)
c.c(NH4+)+c(NH3•H2O)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g·
mol-1)的质量分数为a%,则回收后得到CoC2O4•2H2O(M=183g·
mol-1)的质量不高于g。
答案
(1)①2H++2e-===H2↑
4OH--4e-===O2↑+2H2O(或2H2O-4e-===O2↑+4H+)
②H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降
(2)①2LiCoO2+H2O2+3H2SO4===Li2SO4+2CoSO4+O2↑+4H2O
防止H2O2剧烈分解(或2H2O2
2H2O+O2↑)②ac
(3)略
6.(2016·
金考卷)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉和氧化铁等涂在铝箔上制成。
由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
a.NiCl2易溶于水,Fe3+不能氧化Ni2+。
b.某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
M(OH)n
Ksp
pH
开始沉淀
沉淀完全
1.9×
10-33
3.43
4.19
3.9×
10-38
2.53
2.94
Ni(OH)2
1.6×
10-14
7.60
9.75
(1)根据表中数据判断步骤②依次析出的沉淀Ⅱ________和沉淀Ⅲ________(填化学式),则pH1________pH2(填“>
”、“=”或“<
”),控制两种沉淀析出可利用________(填序号)。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:
NiC2O4>
NiC2O4·
H2O>
2H2O,则步骤③的化学方程式是___________________。
步骤③后,过滤沉淀所需的玻璃仪器有____________。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
________________________________________________。
(3)④中阳极反应产生的气体E为________,验证该气体的试剂为_______________________。
(4)试写出步骤⑥的离子方程式:
______________________________。
答案
(1)Fe(OH)3 Al(OH)3 <
C
(2)NiCl2+Na2C2O4+2H2O===NiC2O4·
2H2O↓+2NaCl 漏斗、玻璃棒和烧杯 玻璃棒划破滤纸、滤液超过滤纸边缘
(3)Cl2 湿润的淀粉-KI试纸
(4)2Ni(OH)2+2OH-+Cl2===2Ni(OH)3+2Cl-
7.(2015·
福建理综,24)无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为_________________________________________________________。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
物质
SiCl4
AlCl3
FeCl3
FeCl2
沸点/℃
57.6
180(升华)
300(升华)
1023
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是________________(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是________________。
③已知:
Al2O3(s)+3C(s)===2Al(s)+3CO(g)
ΔH1=+1344.1kJ·
mol-1
2AlCl3(g)===2Al(s)+3Cl2(g)
ΔH2=+1169.2kJ·
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________________________。
④步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_____________________________。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是______________________________________。
答案
(1)Al3++3H2OAl(OH)3(胶体)+3H+
(2)①防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率
②Fe或铁
③Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+174.9kJ·
④NaCl、NaClO、Na2CO3
⑤除去FeCl3,提高AlCl3纯度
8.(2016·
江苏化学,16)以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
(1)氯化过程控制电石渣过量、在75℃左右进行。
氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为____________________________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。
①滤渣的主要成分为_________(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]∶n[CaCl2]________1∶5(填“>
”、“<
”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g·
L-1,从该溶液中尽可能多地析出KClO3固体的方法是________。
答案
(1)①2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O ②AB
(2)①CaCO3、Ca(OH)2 ②<
(3)蒸发浓缩、冷却结晶
9、(2018年海淀)金属镍具有较高的经济价值,工业上采用一定方法处理含镍废水使其达标排放并回收镍。
某电镀废水中的镍主要以NiR2络合物形式存在,在水溶液中存在以下平衡:
NiR2(aq)
Ni2+(aq)+2R-(aq)(R-为有机物配体,K=1.6×
10-14)
(1)传统的“硫化物沉淀法”是向废水中加入Na2S,使其中的NiR2生成NiS沉淀进而回收镍。
①该反应的离子方程式为_________。
②NiS沉淀生成的同时会有少量Ni(OH)2沉淀生成,用离子方程式解释Ni(OH)2生成的原因是_________、_________。
(2)“硫化物沉淀法”镍的回收率不高,处理后废水中的镍含量难以达标。
“铁脱络-化学沉淀法”可达到预期效果,该法将镍转化为Ni(OH)2固体进而回收镍。
工艺流程如下:
“脱络”(指镍元素由络合物NiR2转化成游离的Ni2+)过程中,R—与中间产物·
OH(羟基自由基)反应生成难以与Ni2+络合的·
R(有机物自由基),但·
OH也能与H2O2发生反应。
反应的方程式如下:
Fe2++H2O2
Fe3++OH—+·
OH…………i
R—+·
OH
OH—+·
R…………ii
H2O2+2·
O2↑+2H2O…………iii
实验测得“脱络”过程中H2O2的加入量对溶液中镍去除率的影响如右图所示:
1从平衡移动的角度解释加入Fe2+和H2O2能够实现“脱络”的原因是_________。
2分析图中曲线,可推断过氧化氢的最佳加入量为_________g·
L-1;
低于或高于这个值,废水处理效果都下降,原因是_________。
(1)①NiR2+S2-
NiS↓+2R-
②S2-+H2O
HS-+OH-NiR2+2OH-
Ni(OH)2↓+2R-
(2)①NiR2在溶液中存在以下平衡:
Ni2+(aq)+2R-(aq)。
Fe2+和H2O2通过反应i和反应ii将R—转化成难以与Ni2+络合的·
R,使c(R-)减小,平衡正向移动,实现“脱络”
②0.45低于此数值,反应i生成的·
OH过少,不足以使R—充分转化成·
R;
高于此数值,H2O2多,但反应i生成的·
OH能与H2O2发生反应iii,使H2O2转化成O2和H2O,同样不能使R—充分转化成·
R。