高考试题集训实验探究题附答案Word文件下载.docx
《高考试题集训实验探究题附答案Word文件下载.docx》由会员分享,可在线阅读,更多相关《高考试题集训实验探究题附答案Word文件下载.docx(21页珍藏版)》请在冰豆网上搜索。
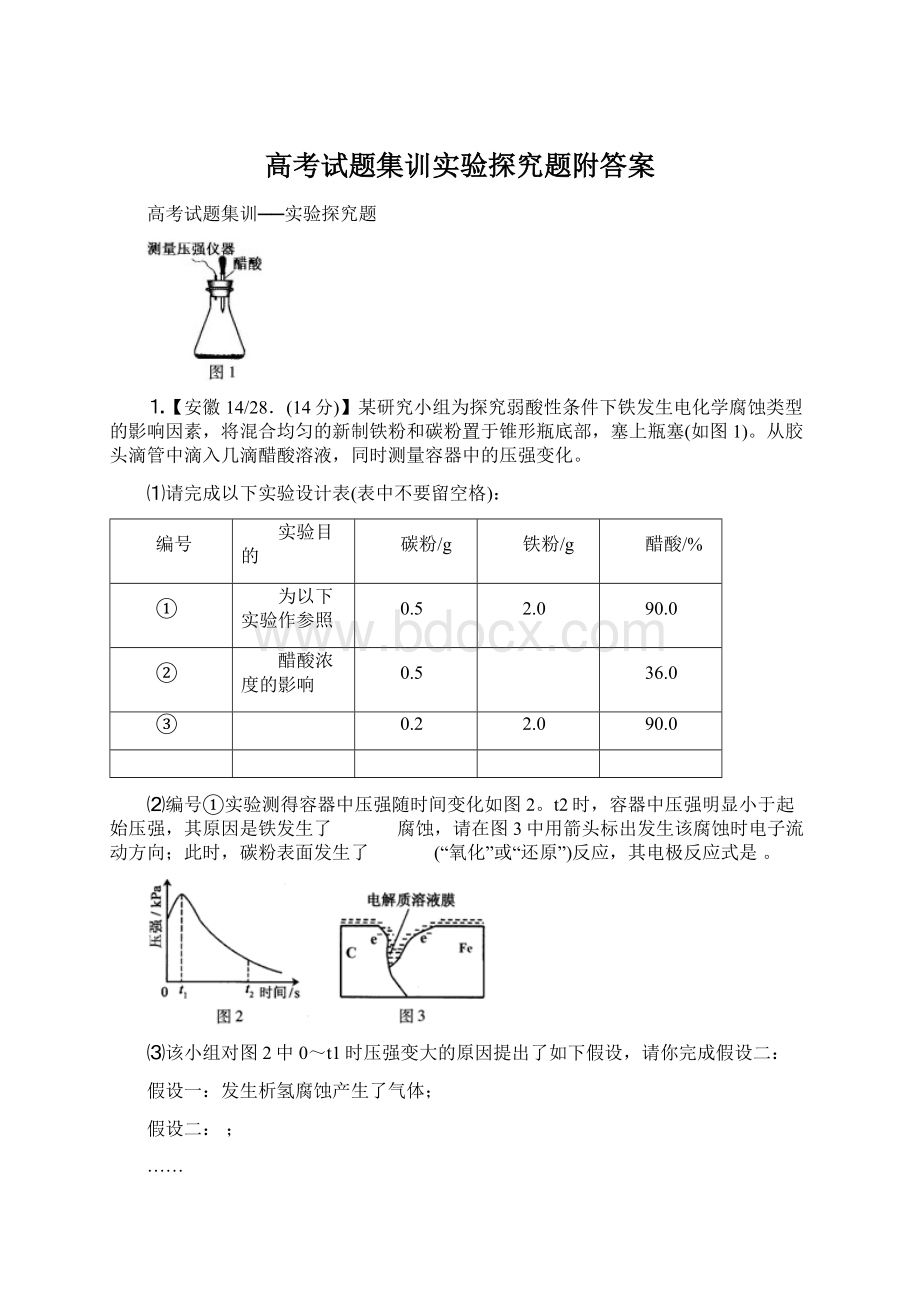
体积/mL
草酸溶液
蒸馏水
4
60
10
30
5
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
⑵上述反应后草酸被氧化为 (填化学式)。
⑶实验①和②的结果表明 ;
实验①中0~t1时间段反应速率υ(Cr3+)= mol·
L-1·
min-1(用代数式表示)。
⑷该课题组队铁明矾[Al2Fe(SO4)4·
24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
Fe2+起催化作用;
;
假设三:
⑹请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·
Al2(SO4)3·
24H2O、Al2(SO4)3等。
溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程)
预期实验结果和结论
⒊【安徽12/28.(13分)】工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理后的铅膏(主要成分为PbSO4)发生反应:
PbSO4(s)+CO32-(aq)===PbCO3(s)+SO42-(aq)。
某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
⑴上述反应的平衡常数表达式:
K= 。
⑵室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在 溶液中PbSO4转化率较大,理由是 。
⑶查阅文献:
上述反应还可能生成碱式碳酸铅[2PbCO3·
Pb(OH)2],它和PbCO3受热都易分解生成PbO。
该课题组对固体产物(不考虑PbSO4)的成分提出如下假设。
请你完成假设二和假设三。
全部为PbCO3;
;
。
⑷为验证假设一是否成立,课题组进行如下研究。
①定性研究:
请你完成下表中内容。
实验步骤(不要求写出具体操作过程)
预期的实验现象和结论
取一定量样品充分干燥,……
②定量研究:
取26.7mg的干燥样品,加热,测得固体质量随温度的变化关系如下图。
某同学由图中信息得出结论:
假设一不成立。
你是否同意该同学的结论,并简述理由:
。
⒋【安徽11/28.(13分)】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
⑴实验前:
①先用0.1mol·
L-1H2SO4洗涤Fe粉,其目的是________,然后用蒸馏水洗涤至中性;
②将KNO3溶液的pH调至2.5;
③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入________(写化学式)。
⑵下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。
请根据图中信息写出t1时刻前该反应的离子方程式____________。
t1时刻后,该反应仍在进行,溶液中NH
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是
________________________________________________________________________。
⑶该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
溶液的pH;
假设二:
;
;
⑷请你设计实验验证上述假设一,写出实验步骤及结论。
(已知:
溶液中的NO
浓度可用离子色谱仪测定)
实验步骤及结论:
⒌【安徽10/28.(13分)】某研究性学习小组在网上收集到如下信息:
Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。
他们对蚀刻银的原因进行了如下探究:
【实验】制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
⑴下列有关制备银镜过程的说法正确的是______。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1:
Fe3+具有氧化性,能氧化Ag。
假设2:
Fe(NO3)3溶液显酸性,在此酸性条件下NO
能氧化Ag。
【设计实验方案,验证假设】
⑵甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。
请写出Fe3+氧化Ag的离子方程式:
____________________。
⑶乙同学设计实验验证假设2,请帮他完成下表中内容(提示:
NO
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
实验步骤(不要求写具体操作过程)
预期现象和结论
若银镜消失,假设2成立。
若银镜不消失,假设2不成立
【思考与交流】
⑷甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:
Fe(NO3)3溶液中的Fe3+和NO
都氧化了Ag。
你是否同意丙同学的结论,并简述理由:
。
⒍【安徽09/28.(17分)】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。
现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验。
⑴请完成以下实验设计表(表中不要留空格)。
实验编号
T/K
c/10-3mol·
L-1
H2O2
Fe2+
298
3
6.0
0.30
探究温度对降解反应速率的影响
[数据处理]实验测得p-CP的浓度随时间变化的关系如上图。
⑵请根据上图实验①曲线,计算降解反应在50~150s内的反应速率:
v(p-CP)=mol·
s-1。
[解释与结论]
⑶实验①、②表明温度升高,降解反应速率增大。
但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
。
⑷实验③得出的结论是:
pH等于10时, 。
[思考与交流]
⑸实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。
根据上图中的信息,给出一种迅速停止反应的方法:
。
⒎【广东10/33】某研究小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
⑴请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH===________________。
⑵反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为________。
⑶吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-,请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设。
只存在SO32-;
既不存在SO32-,也不存在ClO-;
假设3:
________________。
②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
限选实验试剂:
3mol·
L-1H2SO4、1mol·
L-1NaOH、0.01mol·
L-1KMnO4,淀粉—KI溶液、紫色石蕊试液。
实验步骤
步骤1:
取少量吸收液于试管中,滴加3mol·
L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中
—
步骤2:
步骤3:
⒏【广东09/21】
(12分)三草酸合铁酸钾晶体K3[Fe(C2O4)3]·
3H2O可用于摄影和蓝色印刷。
某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。
请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:
浓硫酸、1.0mol·
L-1HNO3、1.0mol·
L-1盐酸、1.0mol·
L-1NaOH、3%H2O2、0.1mol·
L-1KI、0.1mol·
L-1CuSO4、20%KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是______________。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。
验证固体产物中钾元素存在的方法是______________,现象是______________________________________。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
_____________;
_____________。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
预期现象与结论
⒐【广东08/21】
(12分)某种催化剂为铁的氧化物。
化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:
将适量稀硝酸加入少许样品中,加热溶解;
取少许溶液,滴加KSCN溶液后出现红色。
一位同学由此得出该催化剂中铁元素价态为+3的结论。
(1)请指出该结论是否合理并说明理由_______________________________________。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
L-1H2SO4、3%H2O2、6mol·
L-1HNO3、0.01mol·
L-1KMnO4、NaOH稀溶液、0.1mol·
L-1KI、20%KSCN、蒸馏水。
______________________________________________________________;
______________________________________________________________。
根据②的实验方案,进行实验。
请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
实验操作
⒑【广东07/21】
(11分)已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。
请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:
烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;
1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
该混合金属粉末中除铝外还含有元素;
该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案
基于假设3,设计出实验方案(不要在答题卡上作答)。
(3)实验过程
根据
(2)的实验方案,叙述实验操作、预期现象和结论。
【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
Ⅱ.注意文字简洁,确保不超过答题卡空间。
④
⒒⑴某学习小组利用下图装置制取氯气并探究其性质。
①甲装置中反应的化学方程式是;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象);
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。
已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是。
⑵有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·
L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:
该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:
该漂白粉全部变质,含;
假设三:
该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管
若无气体放出且澄清石灰水未见浑浊,则假设一成立;
⒓草酸亚铁(FeC2O4·
2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。
已知:
CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。
回答下列问题:
Ⅰ:
兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:
________;
假设2:
FeO;
假设3:
FeO和混合物
②设计实验方案证明假设3。
1.0mol·
L-1盐酸、3%H2O2、0.1mol·
L-1CuSO4、20%KSCN、蒸馏水。
现象与结论
步骤1:
向试管中加入少量固体产物,再加入足量_________________,充分振荡
若溶液颜色明显改变,且有_______生成,则证明有铁单质存在
将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色
取步骤2得到的少量固体与试管中,滴加___________________________________
_______________________________________
__________________________________
___________________________________
Ⅱ:
某草酸亚铁样品中含有少量草酸。
现用滴定法测定该样品中FeC2O4的含量。
滴定反应是:
5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。
将滤液过滤至另一个锥形瓶中,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2mL
③重复以上实验1~2次
若某小组的一次测定数据记录如下:
V1=18.90mL,V2=6.20mL。
根据数据计算0.20g样品中:
n(Fe2+)=;
n(C2O42-)=;
FeC2O4的质量分数为(精确到0.01%)
⒔氯化亚铁溶液中滴加硫氰化钾溶液,再滴加双氧水,立即出现血红色,后红色又褪去呈黄色并伴有气泡产生,针对该实验现象,某实验小组的同学进行了探究
一、现象分析
假设A:
气泡是H2O2分解产生的O2
假设B:
气泡是KSCN被氧化为N2、SO2、CO2等
假设C:
红色褪去的原因是KSCN被氧化成了其它物质
二、实验探究
探究1
实验现象
结论
①1mL0.1mol/L的FeCl2溶液中加2滴KSCN溶液
溶液不变红
Fe2+遇SCN-不变红
②向①的溶液中加3%的H2O21滴并振荡
立即出现血红色
振荡后不褪色
加入H2O2后溶液中
出现了(离子符号)
③向②的溶液中继续加H2O2溶液
溶液中出现大量气泡
血红色褪去
④用带火星的木条检验③中的气体
木条复燃
则假设成立
探究2
①取2mlKSCN溶液向其中加入几滴BaCl2溶液和稀盐酸
无明显现象
②向①所得的溶液中滴加3%的H2O2
溶液中出现白色沉淀并有少量气泡
白色沉淀为BaSO4
③将6%的H2O2溶液加入KSCN固体中,生成的气体依次通过品红溶液,酸性KMnO4溶液和澄清的石灰水
KSCN被H2O2氧化生成了SO2和CO2气体
三、问题与讨论
(1)探究1中,H2O2分解速度很快的原因
(2)探究1中,说明还原性Fe2+SCN-
(3)探究2中,酸性KMnO4溶液的作用是能证明生成了CO2的现象是
(4)若SCN-被H2O2氧化得到N2、SO2、CO2和SO42-,且SO2与SO42-的物质的量比为1:
1,试写出该反应的离子方程式
⒕实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeCl3溶液吸收多余的SO2气体。
(1)写出SO2与FeCl3溶液反应的离子方程式:
。
(2)FeCl3溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有H+、Fe2+、Cl-、SO42-。
某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
还存在HSO3-、SO32-
还存在Fe3+
HSO3-、SO32-、Fe3+都不存在
②设计实验方案
现象和结论
取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴溶液。
现象:
结论:
假设1不成立。
假设2成立。
(3)测定空气中SO2含量的方法是:
把500L含SO2气体的空气通入20mL含0.00015molKMnO4的溶液中,充分反应后,再用0.02000mol/L的KI溶液滴定过量的KMnO4,消耗KI溶液25.00mL,则空气中的SO2含量为mg/L。
(5SO2+2MnO4—+2H2O=2Mn2++5SO42-+4H+,10I-+2MnO4—+16H+=2Mn2++5I2+8H2O)
高考试题集训──实验探究题答案
⒈【安徽14/28.(14分)】
(1)
碳粉含量的影响
(2)吸氧 还原2H2O+O2+4e—==4OH— (3)反应放热,温度升高
(4)实验步骤和结论(不要求写具体操作过程)
1.药品用量和操作同编号①实验(多孔橡皮塞增加带止水夹的进、出导管);
2.通入氩气排净瓶内空气;
3.滴入醋酸溶液,同时测量瓶内压强变化(也可测温度变化、检验Fe2+等)。
若瓶内压强增大,假设一成立。
否则假设一不成立。
(本题属于开放性试题,合理答案均可)
⒉【安徽13/28.(14分)】
(14分)
⑴
初始pH
废水样品体积/mL
草酸溶液体积/mL
蒸馏水体积/mL
20(1分)
⑵CO2(2分)
⑶溶液pH对该反应的速率有影响(2分)
(2分)
⑷Al3+起催化作用(1分)SO42-起催化作用(1分)
⑸
用等物质的量K2SO4·
Al2(SO4)3·
24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验。
反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中的c(Cr2O72-),则假设一成立;
若两溶液中的c(Cr2O72-)相同,则假设一不成立。
⒊【安徽12/28.(13分)】:
(2)Na2CO3 Na2CO3溶液中的c(
)大
(3)全部为2PbCO3·
Pb(OH)2PbCO3与2PbCO3·
Pb(OH)2
(4)①
充分加热样品,将产生的气体通入盛有无水硫酸铜的干燥管
若无水硫酸铜不变蓝,则假设一成立;
若无水硫酸铜变蓝,则假设一不成立
②同意,若全部为PbCO3时,26.7mg完