全国高考化学化学能与电能的综合高考真题汇总附详细答案文档格式.docx
《全国高考化学化学能与电能的综合高考真题汇总附详细答案文档格式.docx》由会员分享,可在线阅读,更多相关《全国高考化学化学能与电能的综合高考真题汇总附详细答案文档格式.docx(20页珍藏版)》请在冰豆网上搜索。
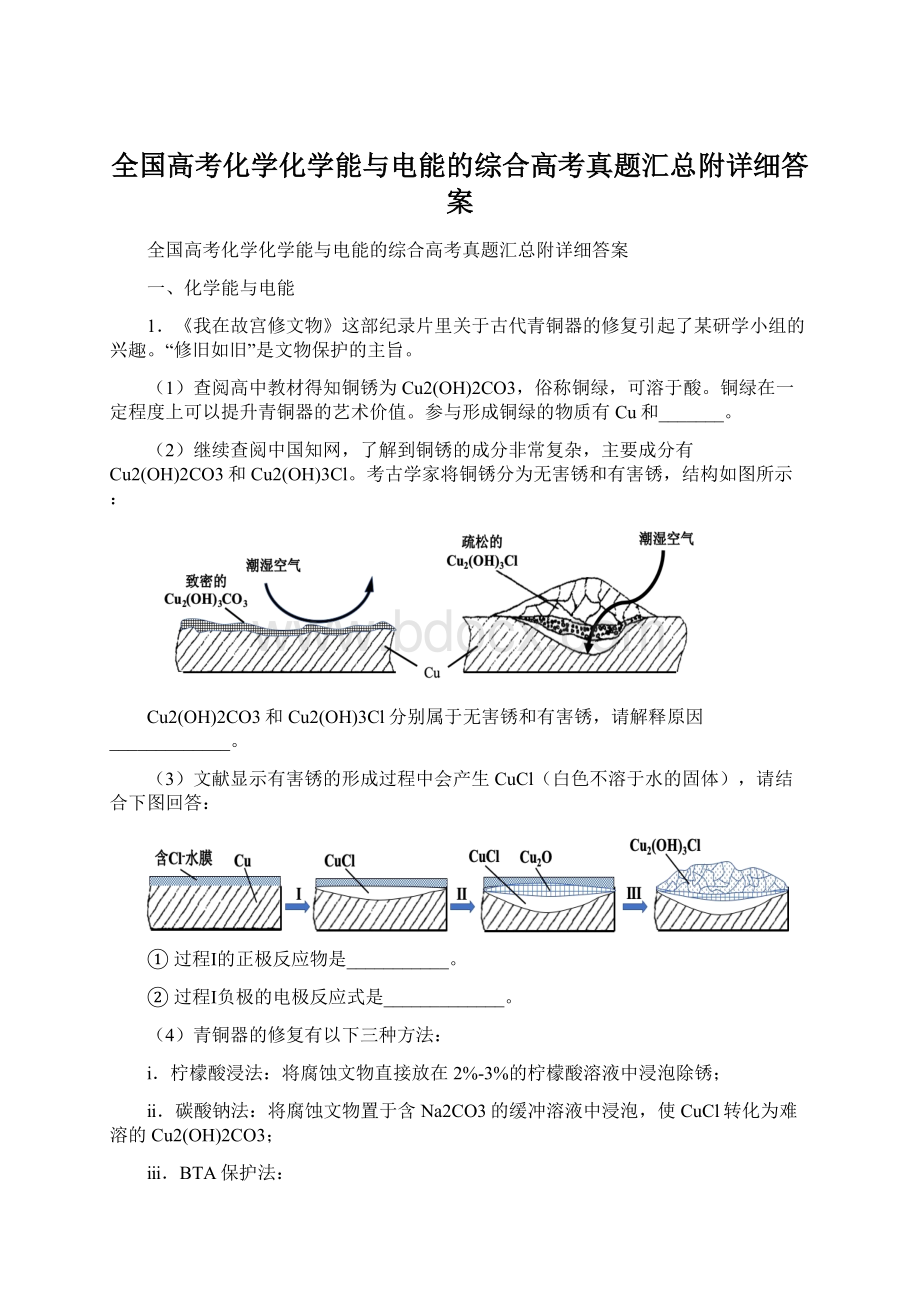
【答案】O2、H2O、CO2碱式碳酸铜为致密结构,可以阻止潮湿空气进入内部进一步腐蚀铜;
而碱式氯化铜为疏松结构,潮湿空气可以进入空隙内将内部的铜进一步腐蚀氧气(H2O)Cu-e-+Cl-=CuCl4CuCl+O2+2H2O+2CO32-=2Cu2(OH)2CO3+4Cl-ABC
【解析】
【分析】
(1)由质量守恒定律可知,反应前后元素种类不变;
(2)结合图像可知,Cu2(OH)2CO3为致密结构,Cu2(OH)3Cl为疏松结构;
(3)正极得电子发生还原反应,过程Ⅰ的正极反应物是氧气,Cu作负极;
(4)在青铜器表面形成一层致密的透明保护膜;
替换出锈层中的Cl-,能够高效的除去有害锈;
BTA保护法不破坏无害锈。
【详解】
(1)铜锈为Cu2(OH)2CO3,由质量守恒定律可知,反应前后元素种类不变,参与形成铜绿的物质有Cu和O2、H2O、CO2;
(2)结合图像可知,Cu2(OH)2CO3为致密结构,可以阻止潮湿空气进入内部进一步腐蚀铜,属于无害锈。
Cu2(OH)3Cl为疏松结构,潮湿空气可以进入空隙内将内部的铜进一步腐蚀,属于有害锈;
(3)①结合图像可知,正极得电子发生还原反应,过程Ⅰ的正极反应物是氧气,电极反应式为O2+4e-+2H2O===4OH-;
②结合图像可知,过程Ⅰ中Cu作负极,电极反应式是Cu-e-+Cl-=CuCl;
(4)①碳酸钠法中,Na2CO3的缓冲溶液使CuCl转化为难溶的Cu2(OH)2CO3,离子方程式为4CuCl+O2+2H2O+2CO32-=2Cu2(OH)2CO3+4Cl-;
②A.在青铜器表面形成一层致密的透明保护膜,能保护内部金属铜,这能使BTA保护法应用更为普遍,故A正确;
B.Cu2(OH)3Cl为疏松结构,潮湿空气可以进入空隙内将内部的铜进一步腐蚀,属于有害锈。
替换出锈层中的Cl-,能够高效的除去有害锈,这能使BTA保护法应用更为普遍,故B正确;
C.酸浸法会破坏无害锈Cu2(OH)2CO3,BTA保护法不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”,这能使BTA保护法应用更为普遍,故C正确;
答案选ABC。
2.某同学在用稀硫酸与锌制取氢气的实验中,发现反应条件不同,反应速率不同。
(1)在用稀硫酸与锌制氢的实验中,加入少量下列物质可加快氢气生成速率的是_____(填序号)
A.Na2SO4溶液B.MgSO4溶液C.SO3D.CuSO4溶液
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:
将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
请完成此实验设计,其中:
V1=____mL,V6=______mL。
该同学最后得出的结论为:
当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。
请分析速率下降的主要原因__________。
(3)该同学为探究其它因素对锌与稀硫酸反应速率的影响,又做了以下实验,记录数据如下,回答下列问题:
①由实验可推知,反应物的总能量_______产物的总能量(填“<”、“>”或“=”)。
②实验2和5表明,______对反应速率有影响。
③实验4和5表明,______对反应速率有影响,能表明同一规律的实验还有_________(填实验序号)。
④本实验中影响反应速率的其他因素还有________。
【答案】CD3010当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积>浓度固体表面积1和2温度
(1)在用稀硫酸与锌制氢气的实验中,加入Na2SO4溶液,减小了硫酸的浓度,使速率减小,故A错误;
B、加入MgSO4溶液,减小了硫酸的浓度,使速率减小,故B错误;
C、通入SO3相当于加入了硫酸,增大了硫酸的浓度,加快了化学反应速率;
D、加入CuSO4溶液,锌为活泼金属,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快;
故选CD;
(2)研究硫酸铜的量对氢气生成速率的影响要求硫酸的量不变,所以V1=30,分析可以看出为了消除硫酸的物质的量浓度不同引起的误差,所以加入的硫酸铜和水的体积和要求一样为20mL,所以V6=10,加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。
请分析氢气生成速率下降的主要原因是当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积;
(3)①从表中看出,反应后的温度高于反应前的温度,说明这是一个放热反应,即反应物的总能量大于产物的总能量;
②实验2和5表明只要硫酸的物质的量浓度不同,是为了探究浓度对反应速率的影响;
③实验4和5、1和2,都是为了探究固体表面积对反应速率的影响,粉末反应的时间短,说明固体表面积越大,反应速率越快;
④由于这是一个放热反应,所以温度也是影响本实验的反应速率的因素之一。
3.钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
钨在自然界主要以钨(+6价)酸盐的形式存在。
有开采价值的钨矿石是白钨矿和黑钨矿。
白钨矿的主要成分是钨酸钙(CaWO4);
黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(FeWO4和MnWO4),钨酸(H2WO4)酸性很弱,难溶于水。
已知:
①CaWO4与碳酸钠共热发生复分解反应。
②钨在高温下可与焦炭(C)反应生成硬质合金碳化钨(WC)。
(1)74W在周期表的位置是第_______周期。
(2)写出黑钨矿中FeWO4与氢氧化钠,空气熔融时的化学反应方程式________________________________;
白钨矿粉与碳酸钠共热的化学反应方程式_______________。
(3)工业上,可用一氧化碳、氢气或铝还原WO3冶炼W。
理论上,等物质的量的CO、H2、Al作还原剂,可得到W的质量之比为______。
用焦炭也能还原WO3,但用氢气更具有优点,其理由是_____________________________________。
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。
下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则T1时Ksp(CaWO4)=_________(mol/L)2。
将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_____________________________,T2时该反应的平衡常数为__________。
(5)工业上,可用电解法从碳化钨废料中回收钨。
碳化钨作阳极,不锈钢作阴极,盐酸为电解质溶液,阳极析出滤渣D并放出CO2。
写出阳极的电极反应式_______________。
【答案】六4FeWO4+8NaOH+O2
2Fe2O3+4Na2WO4+4H2OCaWO4+Na2CO3
CaCO3+Na2WO42∶2∶3焦炭为固体,得到的金属钨会混有固体杂质,并且用焦炭还可能产生CO等有污染的尾气1×
10-10WO42-+Ca(OH)2=CaWO4+2OH-1×
103mol/LWC-10e-+6H2O=H2WO4+CO2+10H+
(1)W为74号元素,第五周期最后一种元素为56号,第六周期最后一种元素为84号,因此74号在元素周期表的第六周期,故答案为:
六;
(2)FeWO4中的铁为+2价,与氢氧化钠在空气熔融时被空气中的氧气氧化,反应的化学反应方程式为4FeWO4+8NaOH+O2
2Fe2O3+4Na2WO4+4H2O;
白钨矿粉与碳酸钠共热的化学反应方程式为CaWO4+Na2CO3
CaCO3+Na2WO4,故答案为:
4FeWO4+8NaOH+O2
CaWO4+Na2CO3
CaCO3+Na2WO4;
理论上,1mol的CO、H2、Al作还原剂时,转移的电子分别为2mol,2mol,3mol,根据得失电子守恒,得到W的质量之比为2∶2∶3。
用焦炭也能还原WO3,但用氢气更具有优点,因为焦炭为固体,得到的金属钨会混有固体杂质,并且用焦炭还可能产生CO等有污染的尾气,故答案为:
2∶2∶3;
焦炭为固体,得到的金属钨会混有固体杂质,并且用焦炭还可能产生CO等有污染的尾气;
(4)根据图像,T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×
10-5×
1×
10-5=1×
10-10,将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:
WO42-+Ca(OH)2=CaWO4+2OH-,T2时,C(OH-)=10-2mol/L,c(WO42-)=10-7mol/L,平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=
=
=1×
103,故答案为:
10-10;
WO42-+Ca(OH)2=CaWO4+2OH-;
103;
(5)电解时,阴极是氢离子放电生成氢气,电极反应式是2H++2e-=H2↑,阳极是碳化钨失去电子,发生氧化反应:
WC+6H2O-10e-=H2WO4+CO2↑+10H+,故答案为:
WC+6H2O-10e-=H2WO4+CO2↑+10H+。
4.保险粉又称连二亚硫酸钠(Na2S2O4),可用于纺织工业的漂白剂、脱色剂,脱氯剂。
Na2S2O4是白色粉末,无味,易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。
Ⅰ.甲酸钠(
HCOONa)
法制备过程如下:
(1)连二亚硫酸钠中硫元素的化合价为______________。
(2)实验室用Na2SO3固体和某酸反应制备SO2气体,制备SO2时所选用的酸,你认为下列最适宜选用的是______________。
A.浓盐酸B.浓硝酸
C.质量分数为70%的硫酸D.质量分数为10%的硫酸
(3)步骤①中制备连二亚硫酸钠的化学方程式可表示为____________________________。
(4)上述步骤②中,加入适量乙醇水溶液的作用是______________。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_________________________。
(6)①现将0.05mol/LNa2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示。
t1时溶液中只有NaHSO3一种溶质,此时含硫元素的粒子浓度由大到小的顺序为_______________。
②t1~t2段发生化学反应的离子方程式为______________________________。
Ⅱ.电解法制备:
工业上用惰性电极电解NaHSO3溶液得到Na2S2O4。
过程如图所示
(7)
①产品在_________________(填“阳极”、“阴极”)得到。
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是__________________________________。
【答案】+3CNaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O连二亚硫酸钠难溶于乙醇,用乙醇水溶液可降低连二亚硫酸钠的在溶液中的溶解度,有利于Na2S2O4晶体析出Na2CO3为碱性物质,提高“保险粉”的稳定性c(HSO3-)>c(SO32-)>c(H2SO3)2HSO3-+O2=2H++2SO42-阴极若不加隔膜,则部分HSO3-到阳极失电子发生氧化反应生成硫酸根离子,得不到连二亚硫酸钠,使连二亚硫酸钠产率下降或部分HSO3-被阳极产生的Cl2氧化生成SO42-,使连二亚硫酸钠产率下降
【解析】Ⅰ.
(1)连二亚硫酸钠(Na2S2O4)中钠元素为+1价,氧元素为-2价,根据正负化合价的代数和为0,硫元素的化合价为+3价,故答案为:
+3;
(2)二氧化硫具有还原性,能被硝酸氧化,盐酸中的氯化氢易挥发,制得的二氧化硫不纯,70%的H2SO4产生二氧化硫的速率较快,故选C;
(3)SO2气体通入甲酸钠的碱性溶液可以生成Na2S2O4和二氧化碳,反应的化学方程式为NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O,故答案为:
NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O;
(4)根据题意,Na2S2O4易溶于水、难溶于乙醇。
加入适量乙醇水溶液可以降低连二亚硫酸钠的在溶液中的溶解度,有利于Na2S2O4晶体析出,故答案为:
连二亚硫酸钠难溶于乙醇,用乙醇水溶液可降低连二亚硫酸钠的在溶液中的溶解度,有利于Na2S2O4晶体析出;
(5)由信息可知在碱性介质中稳定,则在包装保存“保险粉”时加入少量的Na2CO3固体,目的是Na2CO3为碱性物质,提高“保险粉”的稳定性,故答案为:
Na2CO3为碱性物质,提高“保险粉”的稳定性;
(6)①NaHSO3的电离程度大于水解程度,溶液显酸性,含硫元素的粒子浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3),故答案为:
c(HSO3-)>c(SO32-)>c(H2SO3);
②Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为2S2O42-+O2+2H2O=4HSO3-,t1点是为0.1mol/L的NaHSO3,根据图像t2时pH=1,说明NaHSO3完全被氧化生成硫酸氢钠,t1~t2段发生化学反应的离子方程式为2HSO3-+O2=2H++2SO42-,故答案为:
2HSO3-+O2=2H++2SO42-;
Ⅱ.(7)
①用惰性电极电解NaHSO3溶液得到Na2S2O4,反应过程中S元素的化合降低,被还原,应该在阴极上反应得到Na2S2O4,故答案为:
阴极;
②若不加隔膜,则部分HSO3-到阳极失电子发生氧化反应,也可能被阳极产生的氯气氧化,结果都会生成硫酸根离子,得不到连二亚硫酸钠,使连二亚硫酸钠产率下降,故答案为:
若不加隔膜,则部分HSO3-到阳极失电子发生氧化反应生成硫酸根离子,得不到连二亚硫酸钠,使连二亚硫酸钠产率下降。
5.钢铁分析中常用高氯酸(HClO4)溶解矿样,某研究性学习小组欲制取少量高氯酸。
该学习小组查阅到:
a.HClO4浓度高于60%时遇含碳化合物易爆炸,浓度低于60%时比较稳定;
b.NaClO4与浓硫酸反应可制得高氯酸,若采用真空蒸馏可得纯高氯酸;
c.NaClO3在673K(400℃)分解产生NaClO4、NaCl和一种气体。
该小组同学设计实验分三步制备高氯酸:
(一)制氯气并使制得的氯气与氢氧化纳溶液反应制氯酸纳;
(二)氯酸钠分解制高氯酸钠;
(三)高氯酸纳与浓硫酸反应制高氯酸[2NaClO4+H2SO4(浓)
Na2SO4+2HClO4]。
(1)制取氯酸钠的装置连接顺序为A,___________
(2)B装置中发生反应的离子方程式为__________________________。
(3)为了制备高氯酸钠并推出氯酸钠分解制高氯酸钠的化学方程式,该小组设计了两组装置(甲,乙)如下:
该小组经过分析决定选用甲装置制备高氯酸钠,取NaClO3样品2.13g,加热充分反应后集气瓶中收集到224mL(标准状况下)气体,则该反应的化学方程式为_________________________;
不选用乙装置的原因可能为______________________。
(4)用丙裝置制备高氯酸,向烧瓶中加入高氯酸钠,然后加入浓硫酸后,加热可制取高氯酸。
实验开始前,胶塞及导管接口需要包锡箔纸,其原因是___________,仪器E的名称为___________。
该组同学发现操作中少加入一种物质,该物质的名称为___________。
发现后的正确操作为_________________。
(5)工业上大量制备NaClO4常用高电流密度电解NaClO3的方法,试写出以惰性电极电解时的阳极反应式:
_______________________________________________。
【答案】C,B,D3Cl2+6OH-
5Cl-+ClO3-+3H2O2NaClO3
NaClO4+NaCl+O2↑乙装置不能快速判断氯酸钠是否完全反应且反应后气体无法收集橡胶中含有“碳”,若生成的高氯酸浓度高时遇胶塞及导管极有可能会爆炸锥形瓶碎瓷片(或沸石)停止实验,冷却后加入碎瓷片(或沸石)再继续进行实验ClO3--2e+H2O=ClO4-+2H+
(1).装置A制取的氯气通过装置C除去氯化氢杂质,在装置B中,氯气与氢氧化钠溶液反应制得氯酸钠,用D吸收多余的氯气,防止污染环境,所以制取氯酸钠的装置连接顺序为A,C,B,D,故答案为C,B,D;
(2).在B装置中,氯气和氢氧化钠溶液在加热的条件下发生反应,生成氯化钠、氯酸钠和水,反应的离子方程式为:
3Cl2+6OH-
5Cl-+ClO3-+3H2O,故答案为3Cl2+6OH-
5Cl-+ClO3-+3H2O;
(3).用甲装置制备高氯酸钠,2.13gNaClO3样品的物质的量为0.02mol,224mL(标准状况下)气体的物质的量为0.01mol,则该反应的化学方程式为2NaClO3
NaClO4+NaCl+O2↑;
因乙装置不能快速判断氯酸钠是否完全反应且反应后气体无法收集,所以不选用乙装置,故答案为2NaClO3
乙装置不能快速判断氯酸钠是否完全反应且反应后气体无法收集;
(4).实验开始前,胶塞及导管接口需要包锡箔纸,其原因是橡胶中含有“碳”,若生成的高氯酸浓度高时遇胶塞及导管极有可能会爆炸;
仪器E的名称为锥形瓶;
该组同学发现操作中少加入一种物质,该物质的名称为碎瓷片(或沸石),发现后的正确操作为停止实验,冷却后加入碎瓷片(或沸石)再继续进行实验,故答案为橡胶中含有“碳”,若生成的高氯酸浓度高时遇胶塞及导管极有可能会爆炸;
锥形瓶;
碎瓷片(或沸石);
停止实验,冷却后加入碎瓷片(或沸石)再继续进行实验;
(5).工业上大量制备NaClO4常用高电流密度电解NaClO3的方法,以惰性电极电解时,阳极发生氧化反应,则阳极反应式为:
ClO3--2e-+H2O=ClO4-+2H+,故答案为ClO3--2e-+H2O=ClO4-+2H+。
6.
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的(填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应:
3C12+6NaOH
5NaC1+NaC1O3+3H2O先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图表1所示,图中C表示的离子是。
(填离子符号)
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。
则阳极反应式为:
。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:
准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:
从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL1.000mol/L(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:
再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/LK2Cr2O7标准溶液滴定至终点,记录消耗消耗K2Cr2O7标准溶液的体积。
步骤4:
为精确测定样品中C1O3-的质量分数,重复上述步骤2、3操作2-3次。
步骤5:
数据处理与计算。
①步骤2中反应的离子方程式为;
静置10min的目的是。
②步骤3中K2Cr2O7标准溶液应盛放在(填仪器名称)中。
③用0.0200mol/LK2Cr2O7标准溶液滴定的目的是。
在上述操作无误的情况下,所测定的结果偏高,其可能的原因是。
【答案】
(1)Na2CO3
(2)ClO-(3)Cl--6e-+6OH-=C1O3-+3H2O(4)①ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
使溶液中C1O3-与Fe2+反应充分完全②酸式滴定管③计算步骤
消耗的(NH4)2Fe(SO4)2的量(其他合理答案也给分)
溶液中的Fe2+被空气中的氧气氧化
试题分析:
(1)石灰乳与氯气反应生成氯化钙和氯酸钙,除去氯化钙后,可加入碳酸钠溶液,以生成碳酸钙沉淀,以此得到氯化钠;
(2)氯气与氢氧化钠反应低温时生成NaClO,温度高时生成NaClO3,-5℃时生成ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,同时生成H2,其反应的方程式为:
NaCl+3H2O
NaClO3+3H2↑,阳极发生氧化反应,反应式为Cl--6e-+6OH-=C1O3-+3H2O;
(4)①酸性条件下亚铁离子被ClO3-氧化未铁离子,自身被还原为氯离子,其反应的离子方程式为:
ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
静止10min可以使亚铁离子和次氯酸根离子充分反应;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以改用酸式滴定管盛放;
③步骤2中的(NH4)2Fe(SO4)2没有反应完,用K2Cr2O7溶液滴定步骤2的溶液是为了测得未反应完全的亚铁离子,所以是为了测为反应完全的硫酸亚铁铵的量;
亚铁离子容易被空气中的氧气氧化,测得结果偏高的原因为溶液中的Fe2+被空气中的氧气氧化。
考点:
探究物质的组成及测定物质的含量
7.高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂。
其生产流程如下:
(1)配制KOH溶液时,是在每100mL水中溶解61.6