学年高中化学专题2化学反应速率与化学平衡第一单元第1课时化学反应速率的表示方法学案Word下载.docx
《学年高中化学专题2化学反应速率与化学平衡第一单元第1课时化学反应速率的表示方法学案Word下载.docx》由会员分享,可在线阅读,更多相关《学年高中化学专题2化学反应速率与化学平衡第一单元第1课时化学反应速率的表示方法学案Word下载.docx(25页珍藏版)》请在冰豆网上搜索。
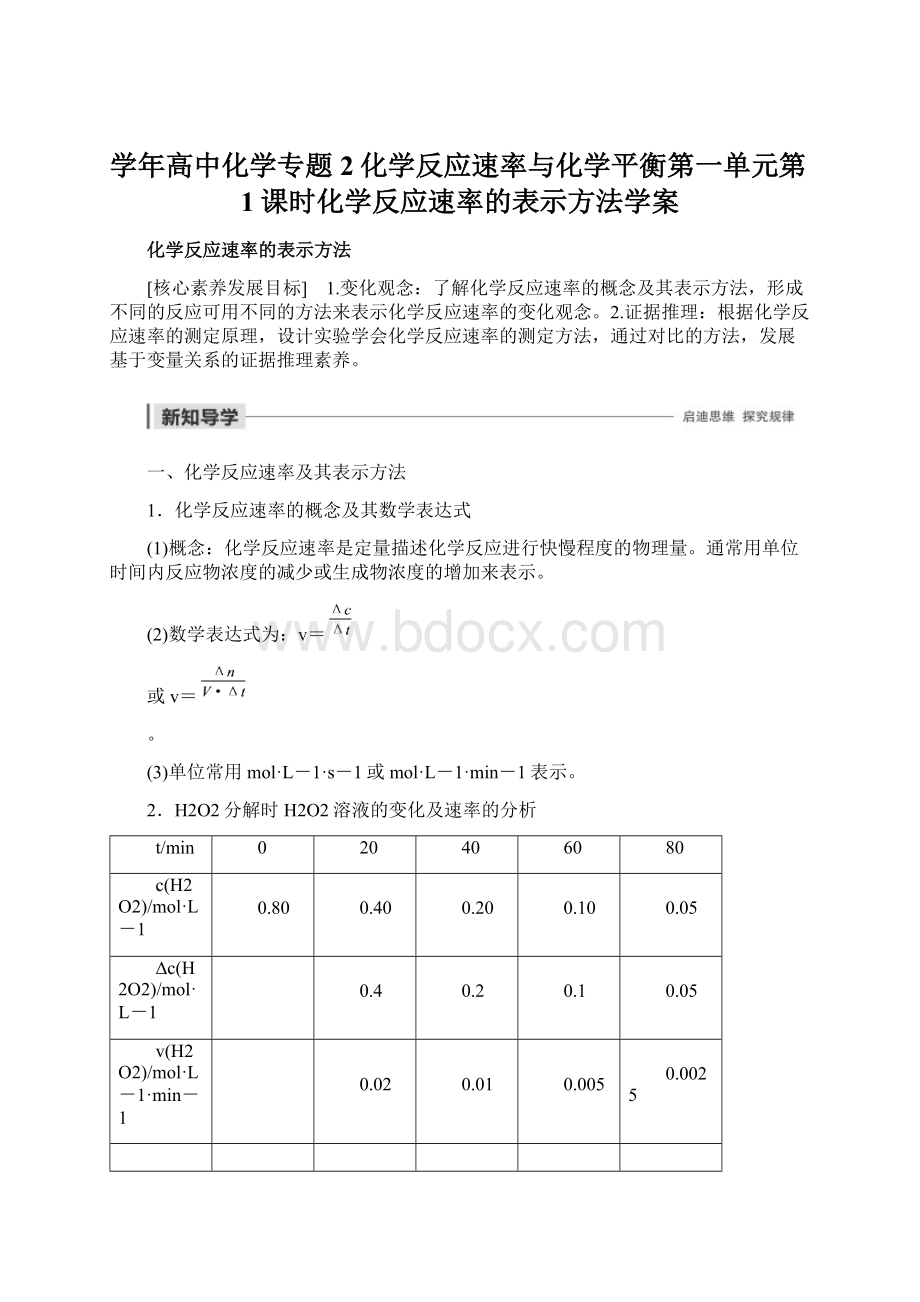
随着反应的进行,相同时间间隔内,H2O2浓度变化量逐渐减小,化学反应速率逐渐减慢。
3.对于反应2N2O5===4NO2+O2,用不同物质表示化学反应速率的分析
1
2
3
4
5
N2O5
c(N2O5)/mol·
1.00
0.71
0.50
0.35
0.25
0.17
Δc(N2O5)/mol·
0.29
0.65
0.75
0.83
/mol·
0.290
0.250
0.217
0.1875
0.166
NO2
c(NO2)/mol·
0.58
1.30
1.50
1.66
Δc(NO2)/mol·
0.580
0.500
0.433
0.375
0.332
O2
c(O2)/mol·
0.15
0.33
0.38
0.42
Δc(O2)/mol·
0.150
0.125
0.110
0.095
0.084
(1)在同一个化学反应中,用不同物质表示的化学反应速率,其数值大小不一定相同,但表示的速率相同,即一种物质的速率就代表了整个化学反应的速率。
(2)用不同反应物表示化学反应速率时,化学反应速率之比=物质的量浓度变化量之比=物质的量变化量之比=化学计量数之比。
(1)固体或纯液体的浓度记为常数,Δc=0,因此不用固体或纯液体表示化学反应速率。
(2)化学反应速率是一段时间(Δt)内的平均反应速率,而不是瞬时反应速率。
(3)无论是反应物还是生成物,其化学反应速率均取正值。
(4)在描述或计算某物质表示的化学反应速率大小时,必须注明其单位,否则毫无意义。
例1
反应:
4A(s)+3B(g)===2C(g)+D(g),经2min后,B的浓度减少0.6mol·
L-1。
对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4mol·
B.分别用B、C、D表示的反应速率之比是3∶2∶1
C.在2min末的反应速率,用B表示是0.3mol·
D.在2min内的反应速率,用C表示是-0.2mol·
答案 B
解析 化学反应速率是一段时间内的平均反应速率,不是瞬时反应速率,只能取正值;
不能用固体或纯液体表示某一反应的反应速率。
考点
化学反应速率及其表达式的应用
题点
化学反应速率的概念
相关链接
对化学反应速率的正确理解
(1)在中学化学中,通常笼统地说化学反应速率的快慢时,往往是对整个化学反应而言。
如反应:
NaOH+HCl===NaCl+H2O进行很快,反应:
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O进行很慢等。
定量地表示某反应的化学反应速率时,是对某种具体物质而言,故描述反应速率时应指明反应体系中的物质,即要在反应速率v后标明具体的物质。
(2)一般来说,化学反应速率随反应的进行而逐渐减小,即化学反应速率不是一个定值,化学反应速率一般是指一段时间内的平均反应速率。
(3)反应物浓度的减少量和生成物浓度的增加量都是正值,因此无论是反应物还是生成物,其反应速率都是正值。
(4)在同一化学反应中,虽然用不同物质表示的化学反应速率的数值不一定相同,但它们表示的意义完全相同,即表示整个化学反应的快慢程度。
例2
反应A(g)+3B(g)2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.15mol·
②v(B)=0.01mol·
s-1
③v(C)=0.40mol·
④v(D)=0.45mol·
则该反应在不同情况下进行的快慢顺序为。
答案 ④>
③=②>
①
解析 方法一:
将以不同物质表示的反应速率换算为用同一物质同一单位表示的速率,再比较速率数值的大小。
若以物质A为标准,根据用不同物质表示同一反应的速率时,速率之比等于各物质的化学计量数之比,将②③④的反应速率换算为用物质A表示的反应速率,则有:
②v(A)=
v(B)=
×
0.01mol·
s-1×
60s·
min-1=0.20mol·
③v(A)=
v(C)=
0.40mol·
④v(A)=
v(D)=
0.45mol·
min-1=0.225mol·
故反应在不同情况下进行的快慢顺序为④>
①。
方法二:
首先将反应速率单位统一为mol·
min-1,则②v(B)=0.60mol·
min-1,然后根据反应速率与对应物质化学计量数之比的大小进行判断。
由化学方程式A(g)+3B(g)2C(g)+2D(g)得出:
=0.15mol·
②
=0.20mol·
③
④
=0.225mol·
化学反应速率与化学计量数关系的应用
比较化学反应速率大小
思维启迪
化学反应速率大小的比较方法——“先化后转再比较”
(1)化:
将不同化学反应速率的单位化为同一单位。
(2)转:
将不同物质表示的化学反应速率转化为同一物质表示的化学反应速率。
(3)比:
比较同一物质的化学反应速率的数值大小,数值越大,化学反应速率越快。
化学反应速率大小的比较方法
(1)定性比较
通过明显的实验现象(如反应的剧烈程度、产生气泡或沉淀的快慢等)来定性判断化学反应的快慢。
(2)定量比较
对同一化学反应,用不同物质表示化学反应速率时,数值可能不同。
比较时应统一单位。
①归一法
根据化学反应速率之比等于化学计量数之比,将用不同物质表示的化学反应速率换算为用同一种物质表示的化学反应速率,最后依据数值大小进行比较。
②比值法
可通过化学反应速率与其对应的化学计量数的比值进行比较,比值大的化学反应速率大。
(3)常见误区
误区一 只看数值
同一化学反应,用不同的物质表示时其化学反应速率不一定相同;
用同一物质的化学反应速率比较反应的快慢时,必须要保证在速率单位统一的前提下再比较数值的大小;
注意物质不能是固体或纯液体。
误区二 思维混乱
对理论知识掌握得不够扎实,解题时慌乱不堪,思维混乱,把同一化学反应中不同物质的反应速率之比等于化学计量数之比的结论误认为将不同物质的反应速率乘以其化学计量数,然后进行比较,从而导致出错。
二、化学反应速率的测定
1.测定原理
利用与化学反应中任何一种化学物质的浓度(或质量)相关的性质进行测定。
2.测定方法
(1)直接观察测定:
如释放出气体的体积和体系的压强等。
(2)科学仪器测定:
如反应体系颜色的变化。
在溶液中,当反应物或产物本身有较明显的颜色时,可利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。
3.实验测定化学反应速率
设计实验测定盐酸与碳酸钙的反应速率,按下列实验步骤完成实验:
①按下图装置安装仪器,并检查装置气密性,加入5g碳酸钙然后快速加入20mL1mol·
L-1的盐酸,测量收集10mLCO2所用的时间。
②用相同的装置换用20mL4mol·
回答下列问题:
(1)实验中所用仪器有哪些?
答案 锥形瓶、双孔塞、直角导气管、分液漏斗、50mL注射器、铁架台、秒表。
(2)观察到的现象是什么?
答案 碳酸钙与盐酸反应产生气泡;
收集10mLCO2实验②所用时间比实验①所用时间短。
(3)你能得出的实验结论是什么?
答案 4mol·
L-1的盐酸与碳酸钙反应比1mol·
L-1的盐酸与碳酸钙反应速率快。
(4)该实验中的注意事项有哪些?
答案 ①碳酸钙颗粒(即表面积)大小基本相同。
②20mL的盐酸溶液要迅速加入。
③装置气密性要好,且计时要迅速、准确。
用碳酸钙与不同浓度的稀盐酸反应,除了测定收集相同体积CO2的时间长短表示化学反应速率,还可根据下列量的变化测定其反应速率:
(1)测定相同时间内收集CO2的多少。
(2)测定一段时间内溶液中c(H+)的变化。
(3)测定一段时间内碳酸钙质量的变化。
例3
化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项
化学反应
测量依据(单位时间内)
A
CO(g)+H2O(g)===CO2(g)+H2(g)
压强变化
B
Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g)
氢气体积
C
2NO2(g)N2O4(g)
颜色深浅
D
Ca(OH)2(aq)+Na2CO3(aq)===CaCO3(s)+2NaOH(aq)
沉淀质量
答案 A
解析 化学反应速率用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
A项,该反应是气体分子数不变的反应,反应前后压强不变;
B项,单位时间内H2体积变化大,速率快;
C项,2NO2N2O4,NO2是红棕色气体,N2O4是无色气体,可以用单位时间内气体颜色的变化来衡量反应的快慢;
D项,单位时间内产生沉淀的质量越多,速率越快。
化学反应速率的测定
实验测定化学反应速率
特别提示
(1)对于有气体生成的反应,可测定相同时间内收集气体的多少或测定收集等量气体所耗时间的多少。
(2)对于有固体参加的反应,可测定相同时间内消耗固体质量的多少。
(3)对于有酸或碱参加的反应,可测定溶液中c(H+)或c(OH-)的变化。
(4)对于有颜色变化或有沉淀生成的反应,可测定溶液变色或变浑浊所消耗时间的多少。
(1)计算反应速率的方法
解题步骤
解题注意事项
第一步:
审题列数据
读题,找出题目提供的有关数据,一般为浓度数据(或物质的量与体积)、时间数据或某些物质的反应速率数据
第二步:
统一单位
如部分题目给出的时间单位与问题中的单位不统一,此时需要对时间单位进行统一
第二、三步可以互换
第三步:
将数据代入公式
将列出的数据代入反应速率公式v=
或利用反应速率与化学计量数的关系,得出问题的答案
(2)反应速率的计算误区
在做有关反应速率的计算题目时,由于粗心大意及对反应速率概念理解不够透彻,常会出现以下失误:
误区一 忽视反应容器的容积
某些试题不是直接给出反应物或生成物的物质的量浓度,而是给出物质的量及容器的容积。
解答这类题目时,不要想当然地认为容器容积为1L,从而导致出错。
误区二 忽视统一单位
部分涉及反应速率计算的题目中,时间单位(s、min)与反应速率的单位(mol·
s-1、mol·
min-1)不统一,如给出的时间单位为min,要求的反应速率单位为mol·
s-1,此时就需要将min换算为s,否则就会出现计算错误。
1.(2018·
沈阳调研)下列有关化学反应速率的说法中正确的是( )
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率通常用单位时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加来表示
C.若某化学反应的反应速率为0.5mol·
s-1,就是指在该时间内反应物和生成物的浓度变化都为0.5mol·
D.化学反应速率是用来衡量化学反应进行快慢的物理量
答案 D
解析 A项,中和反应速率很快,但有的没有明显现象,错误;
B项,在化学反应中,由于固体和纯液体的浓度视为常数,其浓度变化值为零,故不能用它们表示反应速率,错误;
C项,单位错,浓度变化单位应为mol·
L-1,且由于化学计量数不一定相同,在该时间内反应物和生成物的浓度变化不一定都为0.5mol·
2.对于化学反应:
3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z)B.2v(X)=3v(Z)
C.2v(X)=v(Y)D.3v(W)=2v(X)
答案 C
解析 对于任一化学反应,用不同的物质表示该反应的速率,其数值之比等于其化学计量数之比,v(W)∶v(X)∶v(Y)∶v(Z)=3∶2∶4∶3,C正确。
计算化学反应速率
3.在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol·
L-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A.0.02mol·
B.1.8mol·
C.1.2mol·
D.0.18mol·
解析 v(H2SO4)=
=0.06mol·
s-1,v[Al2(SO4)3]=
0.06mol·
s-1=0.02mol·
min-1=1.2mol·
min-1。
4.(2018·
杭州市实验外国语学校期中)在不同条件下进行反应:
2A(s)+B(g)3C(g)+4D(g),分别测得了如下反应速率数据,其中反应速率最快的是( )
A.v(A)=0.7mol·
B.v(B)=0.3mol·
C.v(C)=0.8mol·
D.v(D)=1.0mol·
解析 物质A是固体,不能表示反应速率。
如果反应速率均用物质B表示,则根据方程式结合反应速率之比是化学计量数之比可知选项B~D分别是(mol·
s-1)0.3、0.267、0.25,所以反应速率最快的是选项B。
5.对于可逆反应:
A(g)+3B(s)2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·
B.v(B)=1.2mol·
C.v(D)=0.4mol·
D.v(C)=0.1mol·
解析 本题可以采用归一法进行解答,可以通过将不同物质的反应速率换算成同一物质的反应速率进行比较,B项中的B物质是固体,不能用来表示反应速率;
C项中对应的v(A)=0.2mol·
min-1,D项中对应的v(A)=3mol·
6.将10molA和5molB放入10L真空容器内,某温度下发生反应:
3A(g)+B(g)2C(g),在最初的0.2s内,消耗A的平均速率为0.06mol·
s-1,则在0.2s时,容器中C的物质的量是( )
A.0.12molB.0.08mol
C.0.04molD.0.8mol
解析 v(A)∶v(C)=3∶2,则v(C)=0.04mol·
s-1,n(C)=0.2s×
0.04mol·
10L=0.08mol。
相关综合应用
7.把0.6molX气体和0.4molY气体混合于2L密闭容器中,发生反应:
3X(g)+Y(g)nZ(g)+2W(g),5min末生成0.2molW,若测知以Z浓度变化来表示的平均速率为0.01mol·
min-1,上述反应中Z气体的化学计量数n的值是( )
A.1B.2C.3D.4
解析 利用条件可求:
v(W)=
=0.02mol·
min-1,利用计量数关系计算得n=1。
确定化学计量数之比
8.(2018·
嘉兴市第一中学期中)在恒温恒容条件下,反应2X(g)+Y(g)Z(g) ΔH=-197kJ·
mol-1,若将2molX和1molY充入2L的密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )
A.10min内,反应放出的热量为197kJ热量
B.10min内,X的平均反应速率为0.06mol·
C.第10min时,Y的反应速率小于0.015mol·
D.第10min时,Z浓度为0.6mol·
解析 2X(g)+Y(g)Z(g)
起始物质的量(mol) 2 1 0
改变物质的量(mol) 0.6 0.3 0.3
平衡物质的量(mol) 1.4 0.7 0.3
A项,10min内,反应放出的热量为197kJ·
mol-1×
0.3mol=59.1kJ热量,故错误;
B项,10min内,X的平均反应速率为
mol·
min-1=0.03mol·
min-1,故错误;
C项,10min内,Y的反应速率为
min-1=0.015mol·
min-1,随着反应的进行,反应物的浓度逐渐减小,所以反应速率逐渐变小,故正确;
D项,第10min时,Z浓度为
L-1,故错误。
题组一 化学反应速率及其数学表达式的应用
1.下列关于化学反应速率的说法,不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率的大小主要取决于反应物的性质
C.化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D.化学反应速率常用单位有mol·
s-1和mol·
解析 化学反应速率用单位时间内反应物或生成物的浓度变化量来表示,而不采用物质的质量或物质的量。
2.用纯净的碳酸钙与1mol·
L-1100mL稀盐酸反应制取二氧化碳。
关于此反应,下列说法不正确的是( )
A.可以用单位时间内碳酸钙质量的减少表示该反应的反应速率
B.可以用单位时间内生成二氧化碳的量表示该反应的反应速率
C.可以用单位时间内溶液中Ca2+浓度的增加表示该反应的反应速率
D.可以用单位时间内碳酸钙浓度的变化表示该反应的反应速率
解析 CaCO3为固体,浓度不变化。
化学反应速率的表示方法
3.在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则用该气体表示该反应的平均反应速率为( )
A.0.4mol·
s-1B.0.3mol·
C.0.2mol·
s-1D.0.1mol·
解析 v=
=0.2mol·
s-1。
4.反应:
2SO2(g)+O2(g)2SO3(g)经一段时间后,SO3的浓度增加了0.4mol·
L-1,在这段时间内用O2表示的反应速率为0.04mol·
min-1,则这段时间为( )
A.5sB.10sC.300sD.600s
解析 该段时间内SO3的浓度增加了0.4mol·
L-1,根据化学方程式,在相同时间内O2的浓度减少了0.2mol·
L-1,所以由公式v=
可知,Δt=
=
=5min=300s。
化学反应速率数学表达式的应用
题组二 化学反应速率与化学计量数关系的应用
5.(2018·
咸阳高二质检)在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8mol·
L-1和5.4mol·
L-1,在一定条件下反应生成NH3,10min后测得N2的浓度是0.8mol·
L-1,则在这10min内NH3的平均反应速率是( )
A.0.1mol·
B.0.2mol·
C.0.3mol·
D.0.6mol·
解析 v(N2)=
=0.1mol·
min-1,
v(NH3)=2v(N2)=0.2mol·
6.反应:
3X(g)+Y(g)2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的反应速率为( )
A.v(X)=0.05mol·
B.v(Y)=0.10mol·
C.v(Z)=0.10mol·
D.v(W)=0.10mol·
解析 依题意,v(Y)=
=0.05mol·
min-1,用单位时间内不同物质的浓度变化量表示的化学反应速率之间的关系为v(X)∶v(Y)∶v(Z)∶v(W)=3∶1∶2∶2,故v(X)=0.15mol·
min-1,v(Z)=v(W)=0.10mol·
min-1,C项正确。
7.一定温度下,向一个容积为2L的真空密闭容器中(事先装入催化剂)通入1molN2和3molH2,3min后测得密闭容器内的压强是起始时的0.7倍,在此时间内v(H2)是( )
min-1B.0.2mol·
min-1D.0.6mol·
解析 3min后测得密闭容器内的