精品解析全国百强校山东省济南外国语学校届高三第一次模拟考试化学试题解析版Word下载.docx
《精品解析全国百强校山东省济南外国语学校届高三第一次模拟考试化学试题解析版Word下载.docx》由会员分享,可在线阅读,更多相关《精品解析全国百强校山东省济南外国语学校届高三第一次模拟考试化学试题解析版Word下载.docx(17页珍藏版)》请在冰豆网上搜索。
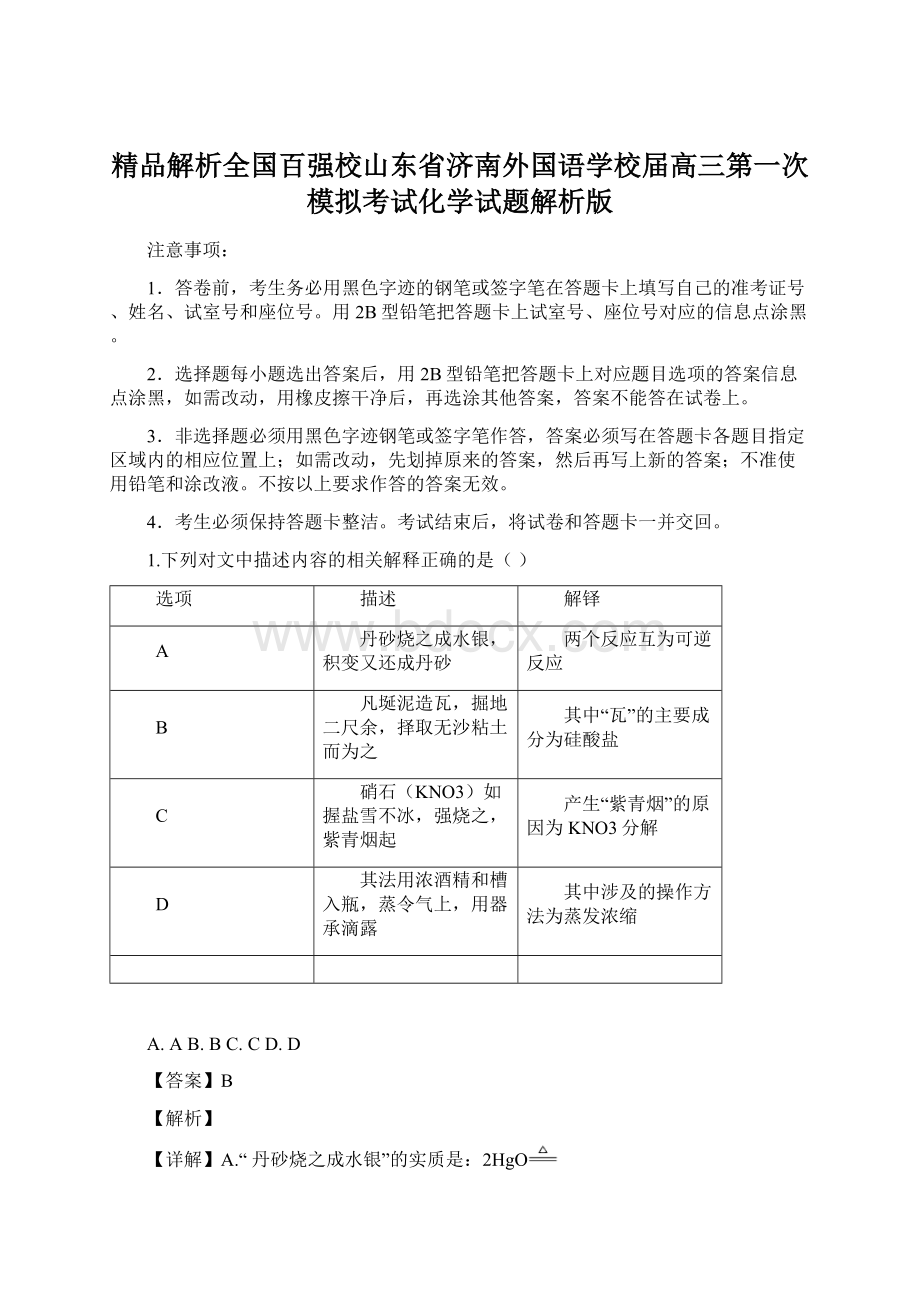
2HgO
2Hg+O2
,“积变又还成丹砂”实质是2Hg+O2=2HgO,化学反应条件不同,不互为可逆反应,错误;
B.“埏泥”即为黏土,其主要成分为硅酸盐,正确;
C.“紫青烟”是由于钾的焰色反应引起的,错误;
D.“蒸令气上,用器承滴露”可知,该操作方法为蒸馏,错误。
【点睛】
(1)可逆反应的正逆条件必须相同;
(2)焰色反应还可用于区分KNO3和NaNO3;
(3)对于化学与传统文化考题,需抓住关键词解答。
2.下列关于有机化合物的说法正确的是()
A.分子式为C8H8O2
的芳香族化合物中属于羧酸的同分异构体有3
种
B.麦芽糖的水解产物有两种,且互为同分异构体
C.等质量的苯和苯乙烯(
)完全燃烧,消耗氧气的体积相同
D.分子式为C4H8Cl2
且含有两个甲基的有机物有4种
【答案】D
A、分子式为C8H8O2
的芳香族化合物中属于羧酸的同分异构体有苯乙酸、对甲基苯甲酸、间甲基苯甲酸、邻甲基苯甲酸共4种,选项A错误;
B、麦芽糖的水解产物只有葡萄糖一种,选项B错误;
C.最简式相同的苯和苯乙烯,等质量的苯和苯乙烯(
)完全燃烧,消耗氧气的质量相同,但若不在相同条件下体积不一定相同,选项C错误;
D、分子式为C4H8Cl2
且含有两个甲基的有机物有CH3CHCl2CH2CH3;
CH3CHClCHClCH3、CHCl2CH(CH3)2、CH2ClCCl(CH3)2共4种,选项D正确。
答案选D。
点睛:
本题考查有机物的结构及性质,注意分别写出同分异构体,进行对比分析。
易错点为选项C,最简式相同的苯和苯乙烯,等质量的苯和苯乙烯(
)完全燃烧,消耗氧气的质量相同,但若不在相同条件下体积不一定相同。
3.设NA为阿伏加德罗常数的值。
下列说法正确的是()
A.用惰性电极电解CuSO4溶液一段时间后,若加入29.4
gCu(OH)2
能使溶液复原,则电解过程中转移电子的数目为1.2NA
B.常温常压下,0.5
molO3与11.2
LO2
所含的分子数均为0.5NA
C.一定条件下,丁烷催化裂化生成1mol乙烯时,消耗丁烷的数目为NA
D.25℃时,1LpH=10的NaHCO3溶液中含有H2CO3的数目为10-4NA
【答案】A
A、若加入29.4gCu(OH)2能使溶液复原,则相当于阴极上析出氢气和铜,生成0.3mol铜转移电子个数=0.3mol×
2×
NA/mol=0.6NA,根据原子守恒知,生成0.3mol水需要0.3mol氢气,生成0.3mol氢气转移电子的个数=0.3mol×
NA/mol=0.6NA,所以电解过程中共转移电子数为1.2NA,选项A正确;
B、常温常压下,11.2LO2的物质的量小于0.5mol,0.5molO3和11.2LO2的分子数不相等,选项B错误;
C、一定条件下,丁烷催化裂化除生成乙烯和乙烷这种均裂外,还会裂解生成甲烷和丙烯,则生成1mol乙烯时,消耗丁烷的数目大于NA,选项C错误;
D、25℃时,1LpH=10的NaHCO3溶液中含有H2CO3的数目小于10-4NA,选项D错误。
答案选A。
4.用下列实验方案及所选玻璃仪器(非玻璃任选),就能实现相应实验目的的是()
序号
实验目的
实验方案
所选玻璃仪器
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
证明HClO与CH3COOH的酸性强弱
同温下用pH试纸测定浓度为0.1mol/L'
NaClO溶液和0.1mol/LCH3COONa溶液
玻璃棒、玻璃片
检验蔗糖水解产物且具有还原性
向蔗糖容易中加入几滴稀硫酸,水浴加热5分钟,再向其中加入新制银氨溶液,水浴加热
试管、烧杯、酒精灯、滴管
配制1L1.6%的硫酸铜溶液(其密度为1.0g/mL)
将25gCuSO4·
5H2O溶解在975g水中
烧杯、量筒、玻璃棒
【详解】A、过滤需要漏斗,故不选A;
B、NaClO水解生成次氯酸,次氯酸具有漂白性,不能用pH试纸测其pH,故不选B;
C、检验蔗糖是否水解,应该向水解后的溶液中加氢氧化钠溶液中和酸,再向其中加入新制的银氨溶液,并水浴加热,故不选C;
D、1L1.6%的硫酸铜溶液中溶质的物质的量为0.1mol,将25gCuSO4·
5H2O溶解在975g水中,溶液质量为1000g,25gCuSO4·
5H2O中n(CuSO4)=0.1mol,故选D。
5.已知高能锂离子电池的总反应式为2Li+FeS
Fe+Li2S,LiPF6·
SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。
下列说法不正确的是
A.电极Y应为Li
B.电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C.X极反应式为FeS+2Li++2e-
Fe+Li2S
D.若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
【详解】A.由于c中反应为Ni2++2e-=Ni,故c室为阴极室,则电极Y为Li,选项A正确;
B.由于c中Ni2+不断减少,Cl-通过阴离子膜从c移向b,a中OH-放电不断减少,Na+通过阳离子膜从a移向b,所以b中NaCl溶液的物质的量浓度不断增大,选项B错误;
C.X为正极,FeS得电子,电极反应式为FeS+2Li++2e-
Fe+Li2S,选项C正确;
D.若去掉阳离子膜,Cl-在阳极放电生成Cl2,电解反应总方程式发生改变,选项D正确。
答案选B。
6.X、Y、Z、W
为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。
X、Z、W形成的最高价氧化物分别为甲、乙、丙。
x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。
其转化关系如图所示,下列判断错误的是
A.反应①、②、③都属于氧化还原反应B.X、Y、Z、W四种元素中,Y的原子半径最小
C.Na
着火时,可用甲扑灭D.一定条件下,x与甲反应生成丁
【答案】C
根据题中信息可判断x为碳,丙为二氧化硅,在高温条件下碳与硅反应生成w为硅、丁为一氧化碳;
y2为氧气,碳与氧气点燃反应生成甲为二氧化碳,z为镁,二氧化碳在镁中点燃反应生成碳和乙为氧化镁。
A.反应①二氧化碳与镁反应、②碳与氧气反应、③碳与二氧化硅反应都属于氧化还原反应,选项A正确;
B.同周期元素原子从左到右依次减小,同主族元素原子从上而下半径增大,故C、O、Mg、Si四种元素中,O的原子半径最小,选项B正确;
C.Na着火时,不可用二氧化碳扑灭,选项C错误;
D.一定条件下,碳与二氧化碳在高温条件下反应生成一氧化碳,选项D正确。
答案选C。
本题考查元素周期表、元素周期律及物质的推断,根据题中信息可判断x为碳,丙为二氧化硅,在高温条件下碳与硅反应生成w为硅、丁为一氧化碳;
y2为氧气,碳与氧气点燃反应生成甲为二氧化碳,z为镁,二氧化碳在镁中点燃反应生成碳和乙为氧化镁,据此分析解答。
7.已知HA的酸性弱于HB的酸性。
25℃时,用NaOH固体分别改变物质的量浓度均为0.1mol•L-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化悄况如图所示。
A.曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B.
C.溶液中水的电离程度:
M>
N
D.N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
【详解】A.由“HA的酸性弱于HB的酸性”可知,Ka(HB)>
Ka(HA),由图可知,曲线I表示溶液的pH与-lgc(B-)的变化关系,错误;
B.根据图中M、N点的数据可知,c(A-)=c(B-),c(HA)=c(HB),故
,正确;
M点与N点存在c(A-)=c(B-),M点溶液的pH比N点溶液的pH小,故M点水的电离程度弱,错误;
D.N、Q点对应溶液的pH相等,由图可知c(A-)<
c(B-),根据电荷守恒可知,N点对应的溶液中c(Na+)小于Q点对应的溶液中c(Na+),错误。
8.根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)
CO2(g)+H2(g)△H=-41kJ/mol
已知:
2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
用活性炭还原法处理氮氧化物,有关反应为:
C(s)+2NO(g)
N2(g)+CO2(g)。
某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·
L-1
时间/min
NO
N2
CO2
0.100
10
0.058
0.021
20
0.040
0.030
30
40
0.032
0.034
0.017
50
①则从反应开始到20min时,以NO表示的平均反应速率=________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。
已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。
若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。
【答案】
(1).2CO(g)+O2(g)=CO2(g)△H=-566kJ/mol
(2).0.003mol/(L
min)(3).0.56(4).减小CO2的浓度(5).AD(6).2Fe3++SO2+2H2O=2Fe2++SO42—+4H+(7).SO2+2H2O-2e-=SO42-+4H+(8).2SO2+O2+2H2O=2H2SO4或2SO2+O2+2H2O=4H++2SO42-
【分析】
(1)由①CO(g)+H2O(g)
②2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,
根据盖斯定律,①
2+②可得:
2CO(g)+O2(g)=CO2(g);
(2)①根据速率公式计算速率;
通过表中数据可以知道,反应进行到20-30分钟时达到平衡状态,则K=
;
②根据表中30-40分钟各物质浓度的变化可以看出改变的条件是分离出部分CO2;
③A.碳是固体,因此当容器内气体的平均摩尔质量保持不变,说明各组成含量保持不变,即已达平衡;
B、2v(NO)正=v(N2)逆,说明正反应速率和逆反应速率不相等,不能说明反应已达平衡;
C、该反应,反应前后气体分子数不变,所以当容器中气体的压强保持不变,不能说明反应已达平衡;
D、单位时间内生成nmolCO2的同时生成2nmolNO,说明正反应速率和逆反应速率相等,说明反应已达平衡;
(3)SO2转化为SO42-,该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根;
(4)SO2-O2-H2SO4形成燃料电池,通O2的电极为正极发生还原反应,同SO2的电极为负极发生氧化反应,书写电极反应式按照先总后分的顺序,先写出总的原电池方程式,然后写出正极的电极反应式,用总方程式减去正极反应式就是负极的电极反应式。
【详解】
2CO(g)+O2(g)=CO2(g)△H=-566kJ/mol;
因此,本题正确答案是:
(2)①
=
=0.003mol/(L
min);
反应进行到20-30分钟时达到平衡状态,则K=
=0.56;
③A.碳是固体,因此当容器内气体的平均摩尔质量保持不变,说明各组成含量保持不变,即已达平衡,故A正确;
B、2v(NO)正=v(N2)逆,说明正反应速率和逆反应速率不相等,不能说明反应已达平衡,故B错误;
C、该反应,反应前后气体分子数不变,所以当容器中气体的压强保持不变,不能说明反应已达平衡,故C错误;
D、单位时间内生成nmolCO2的同时生成2nmolNO,说明正反应速率和逆反应速率相等,说明反应已达平衡,故D正确;
0.003mol/(L.min);
0.56;
减小CO2的浓度;
AD;
(3)SO2转化为SO42-,该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42—+4H+;
2Fe3++SO2+2H2O=2Fe2++SO42—+4H+;
(4)原电池总方程式为2SO2+O2+2H2O=2H2SO4,正极的电极反应式为O2+4H++4e-=2H2O,用总的减去正极的电极反应式得负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
SO2+2H2O-2e-=SO42-+4H+;
2SO2+O2+2H2O=2H2SO4或2SO2+O2+2H2O=4H++2SO42-。
9.化合物M{[(CH3COO)2Cr]2·
2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。
实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。
已知二价铬不稳定,极易被氧气氧化,不与锌反应。
制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
请回答下列问题:
(1)仪器1的名称是__________;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是__________(填序号);
目的是______________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门__________(填“A”或“B”,下同),打开阀门___________________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是__________________________。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;
实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O9.024g,则该实验所得产品的产率为__________(不考虑溶解的M)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的________,再加入碱液,调节pH至少为________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。
【已知Cr(OH)3的溶度积为6.3×
10-31,
=4,lg2≈0.3】
【答案】
(1).分液漏斗
(2).C(3).让锌粒先与盐酸反应产生氢气,H2将装置2和装置3中的空气排出,防止生成的Cr2+被氧化(4).B(5).A(6).过量的Zn将Cr3+充分还原为Cr2+(7).80.0%或0.80(8).空气或氧气(9).5.6
本题考查物质制备实验方案的设计。
(1)根据仪器结构特征,判断仪器1的名称。
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出。
(3)利用生成氢气,使装置内气体压强增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合。
(4)过量的锌与CrCl3充分反应得到CrCl2
(5)CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为0.15mol,由方程式可知CH3COONa足量,根据CrCl2计算[Cr(CH3COO)2]2·
2H2O的理论产量,进而计算其产率。
(6)二价铬不易除去,可将其氧化方便除去;
依据Ksp[Cr(OH)3]=c(Cr3+)×
c3(OH-)以及KW=c(H+)×
c(OH-)计算pH即可。
(1)由图可知,仪器1的名称是分液漏斗。
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,将装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,故选C。
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是使锌与CrCl3充分反应得到CrCl2。
(5)CrCl3的物质的量为:
=0.06mol,得到CrCl2为0.06mol,而CH3COONa为0.15mol,由方程式可知CH3COONa足量,则得到[Cr(CH3COO)2]2·
2H2O为0.06mol×
×
376g/mol=11.28g,所得产品的产率为:
100%=80.0%。
(6)向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+;
铬的离子沉淀完全时,浓度应小于10-5mol/L,根据Ksp[Cr(OH)3]=c(Cr3+)×
c3(OH-)=6.3×
10-31,此时溶液中c(OH-)=4×
10-9mol/L,溶液pH=-lgc(H+)=
=5.6。
【点睛】本题涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用。
10.硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。
一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
(1)硼砂中B元素的化合价为_______,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为____________________。
X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为_____________。
(2)由MgCl2·
7H2O制备MgCl2时,需要在HC1氛围中加热,其目的是________。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+==Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为_____________mol·
L-1。
已知该温度下,Ksp[Mg(OH)2]=5.6×
10-12,当电解质溶液的pH=6时,_______(填“有”或“无”)Mg(OH)2沉淀析出。
(忽略反应过程中溶液的体积变化)
II.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。
(4)写出放氢过程中发生反应的化学方程式:
____________。
III.MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2===MgSO3+H2O
②MgSO3+SO2+H2O===Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
④2MgSO3+O2===2MgSO4
已知25℃时,Kap(MgSO3)=3.86×
10-3,Kap(CaSO3)=3.1×
10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。
镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为_____________。
【答案】
(1).+3价
(2).
(3).3Mg+B2O3
2B+3MgO(4).防止MgCl2水解生成Mg(OH)2(5).
0.045mol·
L-1(6).无(7).MgH2+2LiBH4=2LiH+MgB2+4H2↑(8).MgSO3的溶解度比CaSO3的大,MgSO3比CaSO3更易氧化
【