高中化学选修四第三章沉淀溶解平衡典型题难题练习题带答案Word文件下载.docx
《高中化学选修四第三章沉淀溶解平衡典型题难题练习题带答案Word文件下载.docx》由会员分享,可在线阅读,更多相关《高中化学选修四第三章沉淀溶解平衡典型题难题练习题带答案Word文件下载.docx(36页珍藏版)》请在冰豆网上搜索。
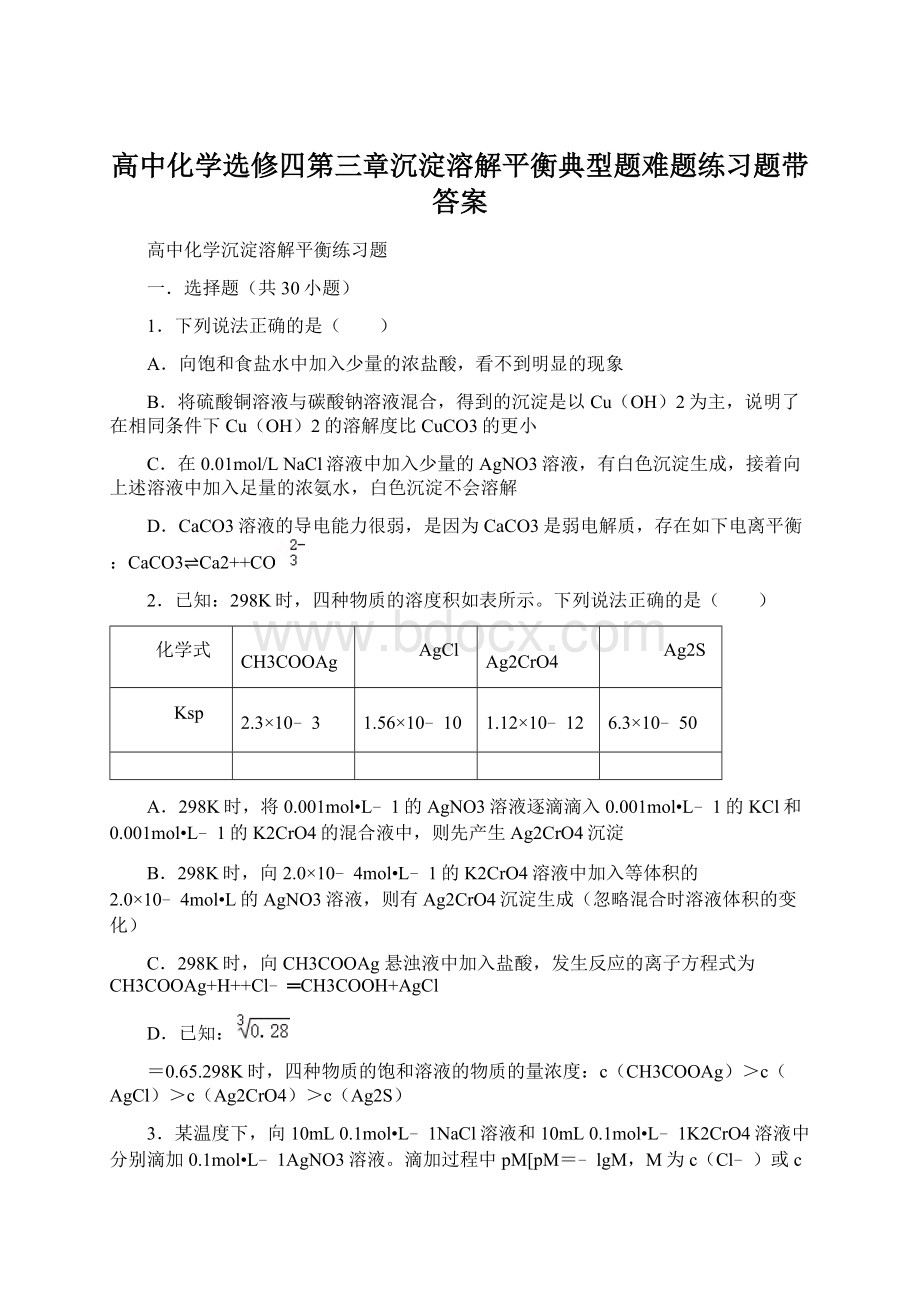
=0.65.298K时,四种物质的饱和溶液的物质的量浓度:
c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
3.某温度下,向10mL0.1mol•L﹣1NaCl溶液和10mL0.1mol•L﹣1K2CrO4溶液中分别滴加0.1mol•L﹣1AgNO3溶液。
滴加过程中pM[pM=﹣lgM,M为c(Cl﹣)或c(CrO42﹣)]与所加AgNO3溶液体积之间的关系如图所示。
已知Ag2CrO4为深红色沉淀,100.1≈1.259,
≈1.265。
下列说法错误的是( )
A.a1、b、c三点所示溶液中c(Ag+):
b>c>a1
B.若将上述NaCl溶液的浓度改为0.2mol•L﹣1,则a1点会平移至a2点
C.若将a1与b点溶液混合,则有AgCl与Ag2CrO4固体析出
D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
4.黄铁矿的主要成分是FeS2,在空气中会被缓慢氧化,氧化过程如图所示。
(已知25℃时,Ksp[Fe(OH)3]=2.79×
10﹣39)下列说法正确的是( )
A.发生反应a时,0.5molFeS2被氧化转移的电子数为7molB.Fe3+的水解可以促进FeS2的氧化
C.发生反应c时,FeS2中铁元素和硫元素都被氧化D.25℃,d逆反应的平衡常数为K=2.79×
1025
5.氢氧化钙是一种微溶于水的碱。
如图是Ca(OH)2在温度分别为T1、T2时的两种沉淀溶解平衡曲线(浓度单位为mol•L﹣1,与曲线Ⅰ对应的Ksp=4×
10﹣6,
≈1.6)。
下列说法中正确的是( )
A.Q点的溶液中c(OH﹣)约为0.0125mol•L﹣1B.在温度为T1时,P点分散系中分散质粒子直径<1nm
C.温度:
T1<T2D.加水稀释时溶液碱性减弱,Z点溶液可转化为Q点溶液
6.常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示(第一次平衡时c(I﹣)=2×
10﹣3mol•L﹣1,c(Pb2+)=1×
10﹣3mol•L﹣1),下列说法不正确的是( )
A.常温下,PbI2的Ksp=4×
10﹣9
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度减小,Pb2+浓度不变
C.T时刻可能向溶液中加入了KI固体,Ksp不变
D.常温下Ksp(PbS)=8×
10﹣28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2﹣(aq)⇌PbS(s)+2I﹣(aq)反应的化学平衡常数为5×
1018
7.已知Ksp(AgBr)=5.53×
10﹣13,Ksp(AgCl)=1.77×
10﹣10,将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A.只有AgBr沉淀生成B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
8.硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。
已知:
CdS在水中的溶解过程为吸热过程。
A.图中各点对应的Ksp的关系:
Ksp(m)=Ksp(n)=Ksp(p)<Ksp(q)
B.温度降低时,p点的饱和溶液的组成由p沿pq线向q方向移动
C.向p点溶液中加入少量Na2S固体,溶液组成由p沿mpn线向m方向移动
D.向q点的饱和溶液中滴加Na2S溶液,一定会析出CdS沉淀
9.某温度时硫酸盐MSO4(M:
Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。
已知p(M)=﹣lgc(M),p(SO42﹣)═﹣lgc(SO42﹣)。
A.向BaSO4悬浊液中加入浓度较大的Pb(NO3)2溶液可能转化成PbSO4
B.X、Y两点对应的SrSO4均是饱和溶液,不能继续溶解SrSO4
C.蒸发Z点的BaSO4溶液可得到C点状态的BaSO4溶液
D.溶度积:
Ksp(SrSO4)<Ksp(PbSO4)<Ksp(BaSO4)
10.常温下,向25mL0.12mol/LAgNO3溶液中逐滴加入浓度为2%的氨水,先出现沉淀,继续滴加沉淀溶解。
该过程中加入氨水的体积V与溶液中lg
的关系如图所示。
已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×
10﹣3mol/L.下列叙述不正确的是( )
A.a点溶液呈酸性的原因是AgNO3水解B.b点溶液中:
c(Ag+)+c[Ag(NH3)2+]<c(NO3﹣)
C.由e点可知,反应Ag++2NH3⇌[Ag(NH3)2]+平衡常数的数量级为105
D.cd段加入的氨水主要用于沉淀的生成和溶解
11.常温下,有关物质的溶度积如下,下列有关说法不正确的是( )
物质
CaCO3
MgCO3
Ca(OH)2
Mg(OH)2
Fe(OH)3
Ksp
4.96×
10﹣9
6.82×
10﹣6
4.68×
5.60×
2.80×
10﹣39
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):
c(Fe3+)=2.0×
10﹣21
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.0×
10﹣2mol/L],若保持温度不变,向其中加入100mL0.012mol/L的NaOH,则该溶液变为不饱和溶液
12.常温下,向1mol•L﹣1NH4Cl溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。
实验观察到b点开始溶液中有白色沉淀生成。
下列说法错误的是( )(已知Ksp[Mg(OH)2]=1.8×
10﹣11)
A.a点溶液中,c(NH4+)+c(H+)<c(Cl﹣)+c(OH﹣)B.b点时,溶液中c(Mg2+)=0.18mol•L﹣1
C.体系中,水的电离程度大小关系为a>c>bD.常温下,NH4Cl的水解平衡常数数量级为10﹣10
13.某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中﹣lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知:
lg2=0.3,Ksp(ZnS)=3×
10﹣25mol2/L2,下列有关说法正确的是( )
A.a、b、c三点中,水的电离程度最大的为b点
B.如不考虑CuS的溶解,则c点溶液有:
2[c(S2﹣)+c(HS﹣)+c(H2S)]═c(Cl﹣)
C.该温度下Ksp(CuS)=2×
10﹣18mol2/L2
D.该温度下,反应:
ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq)的平衡常数为1.33×
10﹣11
14.常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得沉淀溶解平衡图象如图所示(不考虑C2O42﹣的水解)。
下列叙述不正确的是( )
A.n点表示Ag2C2O4的不饱和溶液B.Ksp(AgCl)的值等于10﹣9.75
C.Ag2C2O4(s)+2Cl﹣(aq)⇌2AgCl(s)+C2O42﹣(aq)的平衡常数为109.04
D.向c(Cl﹣)=c(C2O42﹣)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
15.常温下,将0.025molBaSO4粉末置于盛有蒸馏水的烧杯中形成1L悬浊液,然后向烧杯中加入Na2CO3固体(忽略溶液体积的变化)并充分搅拌。
加入Na2CO3固体的过程中溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
A.常温下,Ksp(BaSO4)=2.5×
10﹣9B.BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C.若要使BaSO4全部转化为BaCO3至少要加入0.65molNa2CO3
D.BaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小关系为:
c(SO42﹣)>c(CO32﹣)>c(Ba2+)>c(OH﹣)
16.T℃下,三种硫酸盐MSO4(M:
已知p(M)=﹣lgc(M),p(SO42﹣)=﹣lgc(SO42﹣)。
A.溶度积:
BaSO4>PbSO4>SrSO4B.Y点对应的SrSO4是不饱和溶液,能继续溶解SrSO4
C.Z点对应的溶液中c(Ba2+)>c(SO42﹣),c(Ba2+)•c(SO42﹣)等于1×
10﹣25D.BaSO4不可能转化成PbSO4
17.工业上常用还原沉淀法处理含铬废水(Cr2O72﹣和CrO42﹣),其流程为:
步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)⇌Cr3+(aq)+3OH﹣(aq)Ksp=c(Cr3+)•c3(OH﹣)=10﹣32下列有关说法正确的是( )
A.步骤①中当2v正(CrO42﹣)=v逆(Cr2O72﹣)时,说明反应:
2CrO42﹣+2H+⇌Cr2O72﹣+H2O达到平衡状态
B.Cr2O72﹣在酸性溶液中不能大量存在
C.步骤②中,若要还原1molCr2O72﹣离子,需要12mol(NH4)2Fe(SO4)2
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10﹣5mol/L时,可视作该离子沉淀完全)
18.已知:
常温下Ksp[Fe(OH)3]=8.0×
10﹣16,Ksp[Fe(OH)3]=4.0×
10﹣38下列说法正确的是( )
A.常温下,若配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸5mL(总体积忽略加入盐酸体积)
B.向1L含1.0molFe2(SO4)3和1.0molFeSO4的酸性混合溶液中通入NH3,至该溶液的pH=3时,溶液体积变化忽略不计,所得溶液中c(Fe2+):
c(Fe3+)的值为2.5×
104
C.常温下,Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为4×
10﹣17D.pH越小,越有利于去除废水中的Fe3+
19.某温度下,分别向10.00mL0.1mol/L的KCl和K2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中﹣lgc(M)(M为Cl﹣或CrO42﹣)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
下列说法不正确的是( )
A.曲线L1表示﹣lgc(Cl﹣)与V(AgNO3)的变化关系
B.M点溶液中:
c(NO3﹣)>c(K+)>c(Ag+)>c(H+)>c(OH﹣)
C.该温度下,Ksp(Ag2CrO4)=4.0×
10﹣12
D.相同实验条件下,若改为0.05mol/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点
20.常温下,向10mL0.1mol•L﹣1KCl溶液和10mL0.1mol•L﹣1K2CrO4溶液中分别滴加0.1mol•L﹣1AgNO3溶液。
滴加过程中pM[表示﹣lgc(Cl﹣)或﹣lgc(CrO42﹣)]与所加AgNO3溶液体积之间的关系如图所示。
已知Ag2CrO4为砖红色沉淀,下列说法不合理的是( )
A.bc所在曲线对应K2CrO4溶液B.常温下,Ksp(Ag2CrO4)<Ksp(AgCl)
C.溶液中c(Ag+)的大小:
a点>b点
D.用0.1mol•L﹣1AgNO3标准液滴定上述KCl、K2CrO4溶液时,Cl﹣先沉淀
21.某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2.室温下,PbCO3和PbI2在不同的溶液中分别达到溶解平衡时﹣lgc(Pb2+)与﹣lgc(CO32﹣)或﹣lgc(I﹣)的关系如图所示。
A.Ksp(PbCO3)的数量级为10﹣14B.相同条件下,水的电离程度p点大于q点
C.L1对应的是﹣lgc(Pb2+)与﹣lgc(I﹣)的关系变化D.p点溶液中加入Na2CO3浓溶液,可得白色沉淀
22.t℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。
pM=﹣lgc(M2+),p(CO32﹣)=﹣lgc(CO32﹣),Ksp(XCO3)<Ksp(YCO3)。
A.线a表示YCO3的溶解平衡曲线B.Ksp(XCO3)=1.0×
10﹣8
C.t℃时,向XCO3悬浊液中加入饱和Y(NO3)2溶液,可能有YCO3生成
D.t℃时,向饱和YCO3溶液中加入Na2CO3溶液,一定能产生YCO3沉淀
23.已知:
硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。
A.a点溶液加入硝酸银固体,则a点可沿虚线移动到b点B.a点溶液若降低温度,则a点可沿虚线移动到c点
C.向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动
D.根据曲线数据计算可知,T℃下,Ksp(Ag2SO4)=2.25×
10﹣4
24.已知Cr(OH)3是类似Al(OH)3的两性氢氧化物,Ksp[Al(OH)3]=1.3×
10﹣33,Ksp[Cr(OH)3]=6.3×
10﹣31.如图为Cr和Al两种元素在水溶液中存在的形式与pH的关系,图中纵轴表示lgc(M3+)或lgc[M(OH)4﹣](其中M=Al或Cr)。
A.曲线N表示Al3+的浓度变化
B.在Al(OH)3和Cr(OH)3混合悬浊液中滴加NaOH溶液,Al(OH)3先溶解
C.在Al(OH)3和Cr(OH)3共沉淀的体系中
≈4.8×
102
D.若溶液中Al3+和Cr3+起始浓度均为0.1mol•L﹣1,通过调节pH能实现两种元素的分离
25.已知25℃时,二元酸H2X的电离平衡常数K1=5.0×
10﹣2.K2=5.4×
10﹣5.此温度下用AgNO3.溶液分别滴定浓度均为0.01mol•L﹣1的KY和K2X溶液,所得的沉淀(AgY和Ag2X)溶解平衡图象如图所示。
下列叙述正确的是( )
A.25℃时,KHX的溶液pH>7B.反应Ag2X+2Y﹣⇌2AgY+X2﹣的平衡常数为103.29
C.a点既可以表示AgY的不饱和溶液也可以表示Ag2X的过饱和溶液
D.向c(Y﹣)=c(X2﹣)=0.01mol•L﹣1的混合液中滴入AgNO3溶液时,先生成AgY沉淀
26.下列说法不正确的是( )
A.向盛有1mL0.1mol/LAgNO3溶液中加入2滴0.1mol/L的NaCl溶液,产生白色沉淀,然后向其中再滴加2滴0.1mol/LKI溶液,可见有黄色沉淀,由此可得出Ksp(AgCl)>Ksp(AgI)
B.相同温度条件下,AgCl在不同浓度的盐酸中,溶解度不同,但Ksp是相同的
C.难溶电解质的溶度积Ksp越小,则难溶电解质的溶解度不一定越小
20℃的溶解度AgCl>AgBr,将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为:
AgCl沉淀多于AgBr沉淀
27.向废水中加入硫化物可以依次获得CuS、ZnS纳米粒子。
常温下,H2S的Ka1=1.3×
10﹣7,Ka2=7.1×
10﹣15,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是( )
A.Ksp(CuS)的数量级为10﹣37B.a点对应的CuS溶液为不饱和溶液
C.向p点的溶液中加入少量NaS固体,溶液组成由p向q方向移动
D.H2S+Zn2+⇌ZnS+2H+平衡常数很大,反应趋于完全
28.利用调节pH值的方法,可以除去硫酸铜溶液中的亚铁离子(已知常见某些阳离子沉淀对应pH值如表所示),下列说法正确的是( ):
阳离子
开始沉淀时
完全沉淀时
Fe3+
2.7
3.7
Cu2+
4.4
6.4
Fe2+
7.6
9.6
A.调节pH值前,应先将Fe2+氧化为Fe3+,可选择Cl2或H2O2作为氧化剂
B.调节pH值可选用Cu(OH)2或Cu(OH)2CO3
C.调节pH值控制在pH=6.4~7.6效果最好D.将分离得到硫酸铜溶液蒸干可获得Cu(OH)2固体
29.常温下,BaCO3的溶度积常数为Ksp,碳酸的电离常数为Ka1、Ka2.关于0.1mol/LNaHCO3溶液的下列说法错误的是( )
A.溶液中的c(HCO3﹣)一定小于0.1mol/L
B.将少量该溶液滴入BaCl2溶液中,反应HCO3﹣(aq)+Ba2+(aq)⇌BaCO3(s)+H+(aq)平衡常数K=
C.升高温度或加入NaOH固体,
均增大D.c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
30.黄铁矿(主要成分FeS2),在空气中会被缓慢氧化,氧化过程如图所示。
A.发生反应a时,0.05molFeS2被氧化时消耗标准状况下空气的体积大约19.6L
B.为了验证b过程反应后溶液中含Fe2+,可选用KSCN溶液和氯水
C.c发生反应的离子方程式为:
14Fe3++FeS2+8H2O═15Fe2++2SO42﹣+16H+
D.已知25℃时,Ksp[Fe(OH)3]=2.79×
10﹣39,则该温度下d逆反应的平衡常数为K=2.79×
103
二.填空题(共2小题)
31.甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×
10﹣38,Cu(OH)2的溶度积Ksp=3.0×
10﹣20,通常认为残留在溶液中的离子浓度小于1×
10﹣5mol•L﹣1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L﹣1,则Cu(OH)2开始沉淀时溶液的pH为 ,Fe3+完全沉淀时溶液的pH为 ,通过计算确定上述方案 (填“可行”或“不可行”);
理由 。
32.某实验小组欲利用该黑色粉末(氧化铜和氧化亚铁的混合物)制取较纯净的硫酸铜,通过查阅资料
得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的PH如下:
Cu(OH)2
Fe(OH)2
开始沉淀pH
6.0
7.5
1.4
沉淀完全pH
13
14
实验室有下列试剂可供选择:
A、氯水B、H2O2C、NaOHD、Cu2(OH)2CO3.实验小组设计了如下实验方案:
试回答:
试剂1为 ,试剂2为 (填字母),固体X的化学式是 ;
操作1中各步骤的名称为 .
三.解答题(共3小题)
33.
(1)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol•L﹣1盐酸、③0.1mol•L﹣1氯化镁溶液、④0.1mol•L﹣1硝酸银溶液中,c(Ag+)由大到小的顺序为:
。
(2)含有Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×
10﹣3mol•L﹣1的Cr2O72﹣.为了使废水的排放达标,进行
如下处理:
Cr2O
Cr3+、
Fe3+Cr(OH3)、
Fe(OH)3
(a)该废水中加入绿矾和H+,发生反应的离子方程式为 。
(b)若处理后的废水中残留的c(Fe3+)=2.0×
10﹣13mol•L﹣1,则残留的Cr3+的浓度为
(已知:
Ksp[Fe(OH)3]=4.0×
10﹣38,Ksp[Cr(OH)3]=6.0×
10﹣31)。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。
请回答下列问题:
(a)下列说法正确的是 (填序号)。
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成D.a点对应的Ksp大于c点对应的Ksp
(b)将100mL1mol•L﹣1H2SO4溶液加入100mL含Ba2+0.137g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为 。
34.
(1)一定温度下,Ksp[Mg3(PO3)2]=6.0×
10﹣29,Ksp[Ca3(PO4)2]=6.0×
10﹣26.向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加人Na3PO4,先生成 沉淀(填化学式);
当测得溶液其中一种金属阳离子沉淀完全(浓度小于10﹣5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= mol/L.
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
①毒重石用盐酸浸取前需充分研磨,目的是 .
②加入NH3•H2O调节PH=8可除去 (填离子符号),滤渣II中含 (填化学式).加入H2C2O4时应避免过量,原因是 .
Ca2+
Mg2+
开始沉淀时的pH
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.1
Ksp(BaC2O4)=1.6×
10﹣7,Ksp(CaC2O4)=2.3×
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的