版《高考复习方案》高考化学全国卷人教一轮复习听课手册第4单元非金属及其化合物第15讲富集在海Word文档下载推荐.docx
《版《高考复习方案》高考化学全国卷人教一轮复习听课手册第4单元非金属及其化合物第15讲富集在海Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《版《高考复习方案》高考化学全国卷人教一轮复习听课手册第4单元非金属及其化合物第15讲富集在海Word文档下载推荐.docx(19页珍藏版)》请在冰豆网上搜索。
________________________________________________________________________。
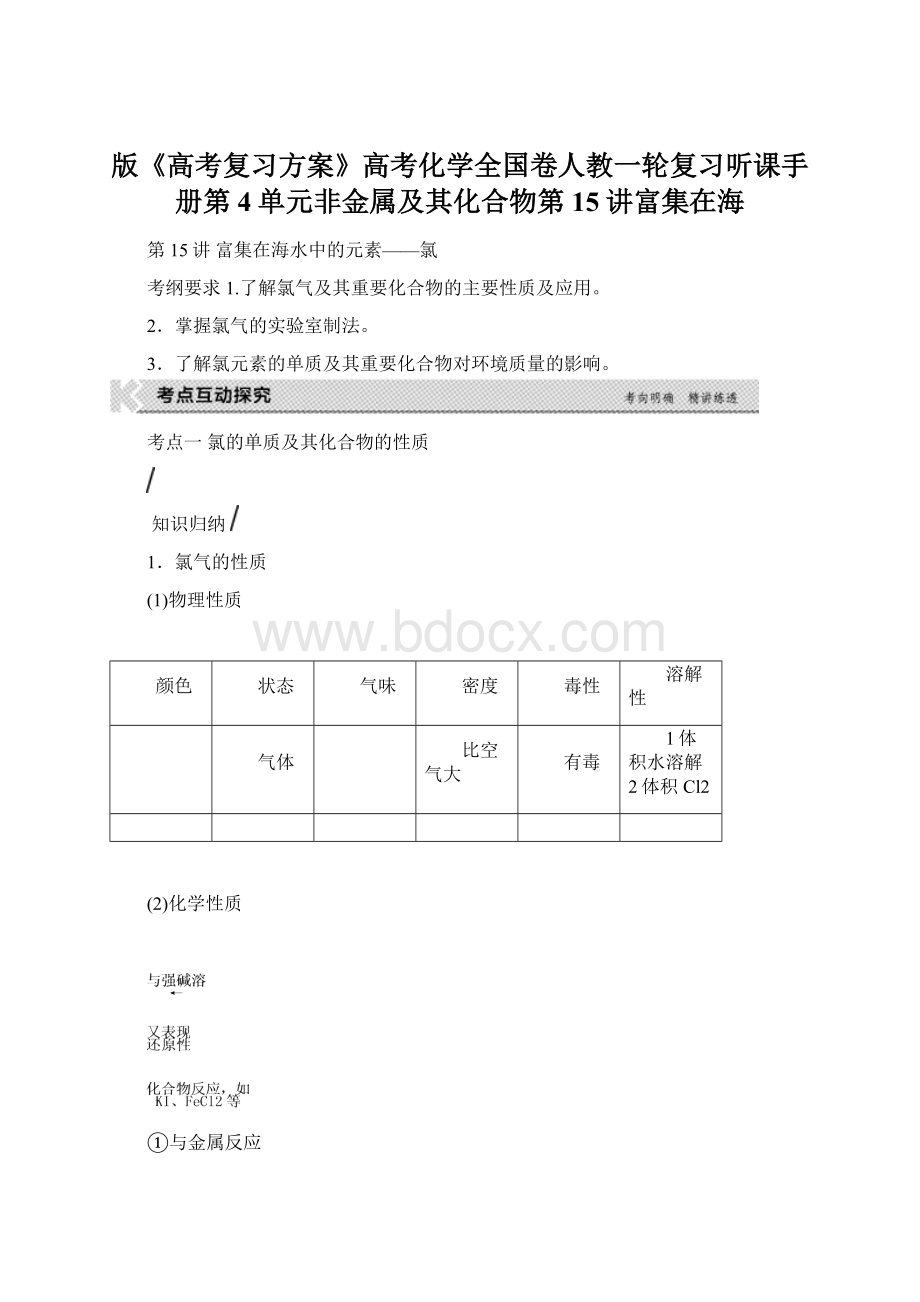
⑤与还原性无机化合物反应(书写离子方程式):
与碘化钾溶液反应:
与SO2水溶液反应:
与FeCl2溶液反应:
2.氯水的成分与性质
(1)氯水的成分
氯水中存在的平衡关系:
Cl2+H2OHCl+HClO、HClOH++ClO-、H2OH++OH-
氯水中含有三种分子:
H2O、________、________;
四种离子:
__________________________(极少量)。
(2)氯水的性质
氯水为浅黄绿色有刺激性气味的液体,与不同的试剂反应时,起作用的微粒不同。
所加试剂
实验现象
参与反应
的微粒
离子方程式或解释
AgNO3溶液
白色沉淀
Cl-
Na2CO3固体
有气泡产生
H+
有色布条
布条颜色褪去
HClO
发生氧化还原反应
FeCl2溶液
溶液变棕黄色
Cl2
SO2
黄绿色褪去
Cl2、H2O
石蕊溶液
先变红后褪色
H+、HClO
酸性和漂白性
镁粉
有气泡产生,氯水褪色
H+、Cl2
反应Mg+2H+===Mg2++H2↑使平衡Cl2+H2O
HClO+HCl向右移动,导致氯水褪色
(3)Cl2+H2OHCl+HClO平衡移动的应用
向氯水中加
入的物质
浓度变化
平衡移动
的方向
应用
可溶性氯化物
c(Cl-)增大、
c(HClO)减小
左移
①用饱和食盐水除Cl2中的________气体
②用排饱和食盐水法收集Cl2
盐酸
c(H+)和
c(Cl-)增大
洁厕剂和“84”消毒液不宜混用
NaOH
c(H+)减小
右移
用________溶液吸收多余的Cl2
光照
氯水应________保存或现用现配
碳酸钙
c(HClO)增大
制取次氯酸浓度较大的氯水
3.氯的重要化合物
(1)次氯酸
HClO—
(2)漂白粉
■判断思考
1.判断下列描述的正误(正确的打“√”,错误的打“×
”)
(1)氯化铵、次氯酸都属于强电解质()
(2)次氯酸钠溶液可用于环境的消毒杀菌()
(3)用pH试纸测定氯水的pH为4()
(4)Cl2具有很强的氧化性,在化学反应中只能作氧化剂()
(5)过量的铁与氯气在一定条件下反应生成FeCl2()
(6)次氯酸是酸性比碳酸强的弱酸()
(7)漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的()
2.久置的氯水和新制氯水性质上有哪些差异?
典型例题
1下列说法正确的是()
A.[2015·
江苏卷]氯气溶于水的离子方程式:
Cl2+H2O===2H++Cl-+ClO-
B.[2015·
广东卷]向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,若溶液变成蓝色,则氧化性:
Cl2>
I2
C.[2015·
浙江卷]为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
D.[2014·
新课标全国卷Ⅰ]漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
2[2014·
江苏卷]在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是()
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
利用HClO及次氯酸盐强氧化性解题的策略
1.HClO的强氧化性
(1)漂白性:
氯水能使紫色石蕊溶液、蓝色石蕊试纸、pH试纸等先变红后褪色。
不能用pH试纸测定氯水的pH。
(2)能氧化还原性离子:
HClO能氧化I-、S2-、SO
、Fe2+等还原性离子。
2.次氯酸盐的强氧化性
ClO-是一种弱酸的酸根离子。
漂白液或漂白粉暴露于潮湿的空气中,会与二氧化碳反应生成HClO,故漂白液、漂白粉具有漂白性。
(2)强氧化性:
ClO-不论是在酸性还是碱性条件下都能跟亚铁盐、碘化物、硫化物、亚硫酸盐等发生氧化还原反应,即ClO-与I-、Fe2+、S2-、SO
不论是在酸性环境还是在碱性环境中均不能大量共存。
如漂白粉遇到亚硫酸盐:
Ca2++ClO-+SO
=CaSO4↓+Cl-。
说明:
NO
不同于ClO-,在酸性条件下NO
具有强氧化性,与Fe2+、I-、S2-、SO
不能大量共存,而在碱性条件下,NO
与I-、S2-、SO
可以大量共存。
■变式训练
1.水处理包括水的净化、杀菌消毒、蒸馏等。
其中常见的水处理剂包括氯气、臭氧、漂白粉、活性炭等。
游泳场馆往往用臭氧、活性炭对游泳池进行消毒和净化。
下列说法中正确的是()
A.臭氧、活性炭处理水的原理相同
B.氯气是一种常用的消毒剂,用氯气消毒的水可以用于配制化学试剂
C.氯气和二氧化硫都具有漂白性,等体积的两者混合会提高漂白的效率
D.漂白粉长期露置在空气中会失效
2.图4151所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。
向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:
2KMnO4+16HCl,F2KCl+5Cl2↑+2MnCl2+8H2O
图4151
对实验现象的“解释或结论”正确的是()
选项
解释或结论
A
a处变蓝,b处变红棕色
氧化性:
Cl2>Br2>I2
B
c处先变红,后褪色
氯气与水生成了酸性物质
C
d处立即褪色
氯气与水生成了漂白性物质
D
e处变红色
还原性:
Fe2+>Cl-
考点二氯气的实验室制法
1.氯气的实验室制法
(1)实验原理:
________________________________________________________________
还可以使用KMnO4、K2Cr2O7、KClO3等作氧化剂与浓盐酸反应,使用以上物质时,反应不需要加热,如KClO3+6HCl(浓),FKCl+3Cl2↑+3H2O。
(2)实验装置:
图4152
―→固体+液体
―→
(3)验满方法:
①将湿润的淀粉碘化钾试纸靠近盛Cl2的集气瓶口,观察到试纸立即变________,则证明已集满。
②将湿润的蓝色石蕊试纸靠近盛Cl2的集气瓶口,观察到试纸__________________,则证明已集满。
③实验室制取Cl2时,常常根据集气瓶中气体的颜色判断是否集满。
2.注意事项
(1)试剂必须用浓盐酸,MnO2与稀盐酸不反应。
(2)为了减少制得的Cl2中HCl的含量,加热的温度不宜过高,以减少浓盐酸的挥发。
(3)实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气。
(4)尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全。
(1)除去氯气中HCl杂质可用饱和食盐水,也可用饱和碳酸氢钠溶液()
(2)足量的MnO2与40mL10mol·
L-1浓盐酸加热条件下反应转移0.2mol电子()
(3)用NaOH溶液吸收多余的Cl2时,导气管不能伸到液面以下,原因是防止倒吸()
(4)用MnO2和浓盐酸制取Cl2的反应中,氧化剂与还原剂物质的量之比为1∶4()
(5)检验氯气可用湿润的淀粉KI试纸()
(6)一套完整的制气装置包括:
发生装置→净化装置→收集或性质验证装置→尾气处理装置()
2.图4153是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
图4153
请判断思考装置B、C、D的作用?
3[2015·
福建卷]某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一制取氯酸钾和氯水
利用如图4154所示的实验装置进行实验。
图4154
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。
该实验操作过程需要的玻璃仪器有________________________________________________________________________
(2)若对调B和C装置的位置,________(填“能”或“不能”)提高B中氯酸钾的产率。
实验二氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。
该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号
1
2
3
4
0.20mol·
L-1KI/mL
1.0
KClO3(s)/g
0.10
6.0mol·
L-1H2SO4/mL
3.0
6.0
9.0
蒸馏水/mL
①系列a实验的实验目的是__________________________________________________。
②设计1号试管实验的作用是____________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;
假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为________________________________________________________________________
实验三测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:
使用如图4155装置,加热15.0mL饱和氯水试样,测定产生气体的体积。
此方案不可行的主要原因是________________________________________________________________________。
(不考虑实验装置及操作失误导致不可行的原因)
图4155
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):
________________________________________________________________________
资料:
i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2、FeCl2等物质还原成Cl-。
1.[2013·
海南卷]图4156所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是()
图4156
A.a—b—c—d—e—f—g—h
B.a—e—d—c—b—h—i—g
C.a—d—e—c—b—h—i—g
D.a—c—b—d—e—h—i—f
2.氯气是一种重要的工业原料。
(1)实验室可用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式是
(2)资料显示:
Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O。
某学习小组利用此原理设计如图4157所示装置制取氯气并探究其性质:
图4157
1在该实验中,甲部分的装置是________(填字母)。
如何检查该装置的气密性?
②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________________________________________________________________
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。
已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是________________________________________________________________________。
④该实验存在明显的缺陷,改进的方法是________________________________________。
考点三卤素的性质及X-的检验
1.卤素单质性质的递变性、相似性
(1)递变性
颜色:
颜色加深
熔、沸点:
逐渐________
密度:
呈增大趋势
还原性(X-):
(2)相似性
①都能与大多数金属反应:
2Fe+3Br2===________;
I2+Fe===________;
②都能与H2反应:
________________________________________________________________________;
③都能与H2O反应:
________________________________________________________________________(F2例外);
④都能与碱液(NaOH)反应:
________________________________________________________________________(F2例外)。
2.卤素离子的检验方法
(1)AgNO3溶液——沉淀法
未知液
生成
(2)置换——萃取法
未知液加适量新制饱和氯水加入CCl4(下层)或汽油(上层)有机层呈
(3)氧化——淀粉法检验I-
未知液加入适量新制饱和氯水(双氧水)淀粉溶液______________________________色溶液,表明有I-
【判断思考】
(1)实验室保存液溴时要加少量水进行水封,不用橡胶塞()
(2)向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色说明原溶液中有I-()
(3)卤素单质与水的反应中,卤素单质既作氧化剂又作还原剂()
(4)氢碘酸(HI)的酸性和还原性都强于盐酸()
(5)类比Fe与Cl2的反应判断Fe与I2反应时生成FeI3()
(6)浓硫酸不能干燥HBr、HI,因为HBr、HI还原性较强,能与浓硫酸发生氧化还原反应()
2.下列事实或实验能说明氧化性Cl2>
Br2>
I2的是________________________________________________________________________。
①氯水分别滴入KBr、NaI溶液中颜色加深,而溴水滴入NaCl溶液中无明显变化,滴入KI淀粉溶液中,溶液变蓝;
②H2和Cl2的混合气体光照爆炸,H2和Br2的混合气体加热才能反应,而H2和I2反应更困难;
③Fe分别与Cl2、Br2、I2反应生成的化合物中铁的化合价;
④HCl、HBr、HI的热稳定性越来越差;
⑤Cl2、Br2、I2在水中的溶解度逐渐减小。
4[2014·
江苏卷]实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
图4159
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________________;
该操作将I2还原为I-的目的是______________________。
(2)操作X的名称为________。
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图41510所示)。
图41510
实验控制在较低温度下进行的原因是______________;
锥形瓶里盛放的溶液为________。
(4)已知:
5SO
+2IO
+2H+===I2+5SO
+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
中的一种或两种。
请补充完整检验含碘废水中是否含有I-、IO
的实验方案:
取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
实验中可供选择的试剂:
稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
1.在含有KCl和KI的混合液中,滴入足量的溴水,待反应完全后,将溶液蒸干、灼烧,最后得到的残留固体物质为()
A.KCl和KBrB.KCl、KBr和I2
C.KBrD.KBr和KI
2.下列说法中正确的是()
A.向某溶液中加入CCl4,振荡后静置,液体分层,下层呈紫红色,则该溶液中存在I-
B.某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水
C.碘是人体必需的微量元素之一
D.从海水中提取物质都必须通过化学反应才能实现
1.下面有关氯气的叙述正确的是()
A.氯气可使湿润的红布条褪色,所以氯气具有漂白性
B.在通常情况下,氯气可以和任何金属直接化合
C.氯气没有漂白性,但通入品红溶液中,品红会褪色
D.氯气是黄绿色气体,闻其气味时要小心将集气瓶放在鼻孔下直接闻
2.关于碘及其化合物的说法正确的是()
A.“碘遇淀粉变蓝”,“碘”指碘元素
B.为了补碘,要多食用含高碘酸的食物
C.I-与IO
可能大量共存于溶液中
D.通过“取样→灼烧→溶解→过滤”可从海带中提取单质碘
3.如图41511所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将甲针筒内的物质压到乙针筒内,进行实验,对乙针筒里的现象所作的判断不正确的是()
图41511
实验序号
甲针筒内物质
乙针筒内物质
乙针筒里的现象
HCl
产生白色沉淀
NH3
FeCl3溶液
出现红褐色沉淀
CO2
BaCl2溶液
紫色石蕊溶液
4.[2015·
安徽卷]下列有关NaClO和NaCl混合溶液的叙述正确的是()
A.该溶液中,H+、NH
、SO
、Br-可以大量共存
B.该溶液中,Ag+、K+、NO
、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×
1023个
5.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图41512所示的实验装置:
图41512
请回答下列问题:
(1)整套实验装置的连接顺序是f接()()接()()接()(填各接口处的字母代号)。
(2)E装置中制取氯气反应的离子方程式是_____________________________________________________________