最新FDA新药申请指南.docx
《最新FDA新药申请指南.docx》由会员分享,可在线阅读,更多相关《最新FDA新药申请指南.docx(5页珍藏版)》请在冰豆网上搜索。
最新FDA新药申请指南
FDA新药申请指南
FDA新药许可申请、审核及管理简介
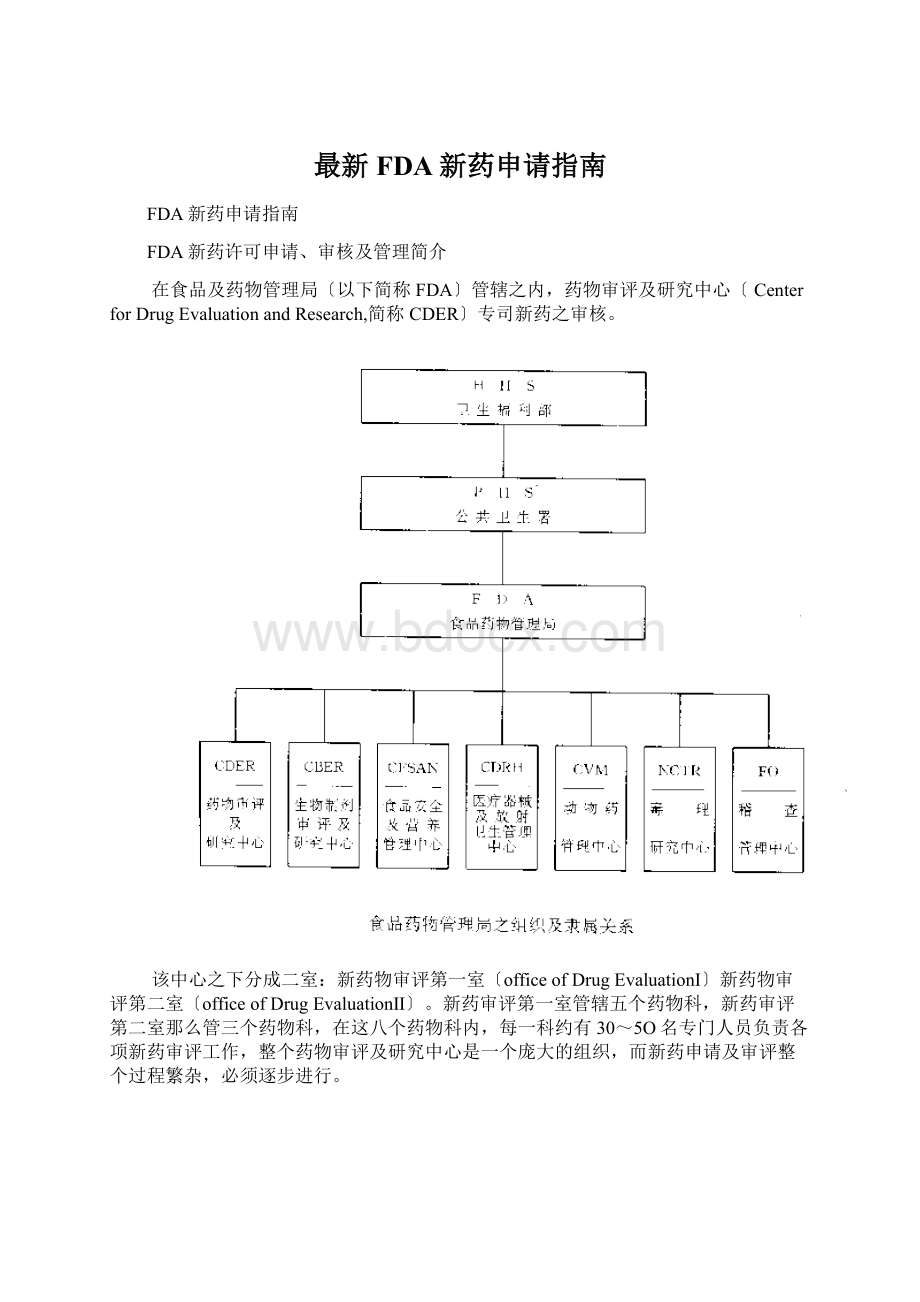
在食品及药物管理局〔以下简称FDA〕管辖之内,药物审评及研究中心〔CenterforDrugEvaluationandResearch,简称CDER〕专司新药之审核。
该中心之下分成二室:
新药物审评第一室〔officeofDrugEvaluationⅠ〕新药物审评第二室〔officeofDrugEvaluationⅡ〕。
新药审评第一室管辖五个药物科,新药审评第二室那么管三个药物科,在这八个药物科内,每一科约有30~5O名专门人员负责各项新药审评工作,整个药物审评及研究中心是一个庞大的组织,而新药申请及审评整个过程繁杂,必须逐步进行。
药物审评及研究中心〔CenterforDrugEvalutionandResearch,CDER〕之组织说明如下:
1.秘书室〔ExecutiveSecretariantStaff〕
8.研究开展室〔OfficeofResearchResources〕
〔1〕研究及试验科〔ResearchandTesting〕
〔2〕药品分析科〔DrugAnalysis〕
〔3〕生体药学科〔Biopharmaceutics〕
〔4〕临床药理科〔Clinicalpharmacology〕
9.新药标准室〔OfficeofDrugStandards〕
〔l〕新药市场广告及信息科〔DrugMarketing,AdvertisingandCommunications〕
10.新药合法性室〔OfficeofCompliance〕
〔1〕新药信息科〔DrugLabelingCompliance〕
〔2〕新药品质审核科〔DrugQualityEvaluation〕
〔3〕新药产品及制造品质科〔MahufacturingandProductQuality〕
〔4〕科学性侦查科〔ScientificInvestigations〕
〔5〕新药管理科〔RegulatoryAffairs〕
11.新药流行学及统计生物学室〔OfficeofEpidemiologyandBiostatistics〕
〔1〕流行学及监视科〔EpidemiologyandSurveillances〕
〔2〕生物统计科〔Biometrics〕
12.新药审评第一室〔OfficeofDrugEvaluationⅠ,ODEI〕
〔1〕心脏药物科〔DivisionofCardio-RenalDrugProducts〕
〔2〕神经药物科〔DivisionofNeuropharmacologicalDrugProducts〕
〔3〕肿瘤肺药物科〔DivisionofOncologyandPulmonaryDrugProducts〕
〔4〕影像、手术及牙药物科〔DivisionofMedicalImagingSurgicalandDentalDrugProducts〕
〔5〕胃肠及凝血药物科〔DivisionofGastrointestinalandCoagulationDrugProducts〕
13.新药审评第二室〔OfficeofDrugEvaluationⅡ,ODEⅡ〕
〔1〕新陈代谢及内分泌药物科〔DivisionofMetabolismandEndocrineDrugProductS〕
〔2〕抗传染药物科〔DivisionofAnti-InfectiveDrugProducts〕
〔3〕抗病毒药物科〔DivisionofAnti—ViralDrugProductS〕
二、新药申请
〔一〕药物的定义
依据联邦食品药物及化装品法第二章第201节,药物的定义如下:
l.美国药典,同种治疗法药典,或者国家处方集〔NationalFormulary〕中所列的物质。
2.任何物质用于人或动物以利诊断、治愈、治疗、预防疾病。
3.任何物质用于改变人体或动物构造或功能。
4.任何物质属于上述1、2或3的一局部。
药物定义范围广泛,本文着重于人用新药,不包括生物制剂在内。
〔二〕新药申请手续
新药申请可分为两个阶段,即新药临床试验申请。
(InvestigationalNewDrugApplication,简称IND〕及新药上市许可申请〔NewDrugApplication,简称NDA〕。
1.新药临床试验申请〔IND)
一般新药试验申请的目的是请求FDA核准进行第一次人体临床试验,不管是否已在美国之外其他各国进行人体试验,只要是在美国申请,需填FormFDA1571表。
及FormFDA1572表。
新药试验申请所提出的内容应包括新药的物理化学性质、临床前〔preclinical〕或非临床〔nonclinical〕,以及健康志愿者〔healthyvolunteer〕或病人使用的经验[假设是已在美国以外之国家取得人体试验结果,最重要的资料是第一次在美国进行人体试验的方案书〔clinicalprotocol〕]。
进一步说明,新药试验申请至少应包括以下资料:
〔1〕药物的化学名称、分子式、构造、投药方式〔口服、注射或其他方法〕,如无商标名称tradename〕亦可先用公司暗码名称〔codename〕代替。
〔2〕主要成分及所知之非主要成分〔没作用的成分〕及所测得之杂物〔impurities〕,并列出成分组成。
〔3〕供给药物公司的地址。
〔4〕药物来源,工厂设备〔facilities〕及质量控制〔controls〕的资料以说明如何制造、包装等,以确保药物的认定〔identity〕、效力〔strength〕、质量〔quality〕及纯度〔purity〕。
〔5〕所有临床前之动物药理实验、毒性试验资料、动物毒性试验,须遵照优良实验室标准〔GLP〕。
假设未遵照是项规定,那么应加以说明。
〔6〕一份依据临床前动物实验的结果—确定该新药物第一次用于人体实验相当平安〔reasonablysafe〕的声明。
〔7〕一份提供所有相关资料—包括其可能发生副作用之临床研究员手册〔ClinicalInvestigator’sBrochure〕。
〔8〕一份第一次在美国进行人体试验方案书〔Protocol〕—该方案书应说明实验目的、实验手续、药物授予法、参加实验者合格条件及不合格条件〔inclusionandexclusioncriteria〕、处理特别反响或过度反响之方式、实验室血液及尿液检查等.
〔9〕一份说明书〔包括提供学历、经历及医学经验等文件〕—证明医生及专业人员有足够能力执行人体试验。
〔10〕经过研究机构审评委员会〔InstitutionalReviewBoard〕的核准,进行人体试验方案之文件。
〔11〕一份同意于向FDA提出人体试验申请日起30天开始进行人体试验之声明书。
正如FormFDA1571规定,除非经FDA特准,一般而言,FDA收到新药试验申请日起30天内是不能进行人体试验的。
新药试验申请送达相关的药物审评科评审后,如无问题,FDA也不会通知公司,亦即新药试验公司于30天期限未收到FDA通知有任何异议〔objection〕时此新药试验申请〔IND〕即开始生效〔ineffect〕。
换言之食品药物管理局并非“核准〞〔Approve〕IND,而是“反对〞而已。
如FDA对该新药申请之临床试验持不同意见,那么有临床试验暂缓进行〔Clinicalhold〕之判定,此时公司应充分合作,而补足FDA所要求的资料或实验。
新药试验如无法确定向FDA那一科〔Division〕申请时,可先以电话查询。
如申请之新药试验有两种药物,一般依具主要疗效〔Primarymode。
fuction〕之药物来决定。
如药物与生物制剂〔biologics〕或医疗器材〔medicaldevice〕合并使用时,大致亦依主要疗效〔Pri-marymodefuction〕,或经过不同的中心〔CDER,CBER或CDRH〕讨论而决定管辖权,详细情况请参考,FederalRegister,DocketNo.91N—0257Vol56,No.225November21,1991。