无机化工流程题复习策略与解题方法指导.docx
《无机化工流程题复习策略与解题方法指导.docx》由会员分享,可在线阅读,更多相关《无机化工流程题复习策略与解题方法指导.docx(8页珍藏版)》请在冰豆网上搜索。
无机化工流程题复习策略与解题方法指导
无机化工流程题复习策略与解题方法指导
在高考试题考察中,为了使化学教学更加紧密联系工农业生产和日常生活,高考将无机框图题改为化学工艺流程框图题。
这类题是通过某种重要的化工产品的工业生产流程简图的分析,以物质制备、分离、提纯为试题情境,以元素化合物知识、实验基本操作、化学平衡原理、水解理论、物质制备和分离的知识为考察知识目标,以信息的获取、加工、整合和新情境下实际问题的分解、分析、综合、解决及以经济的视角分析实际生产中的各种问题为考察能力目标。
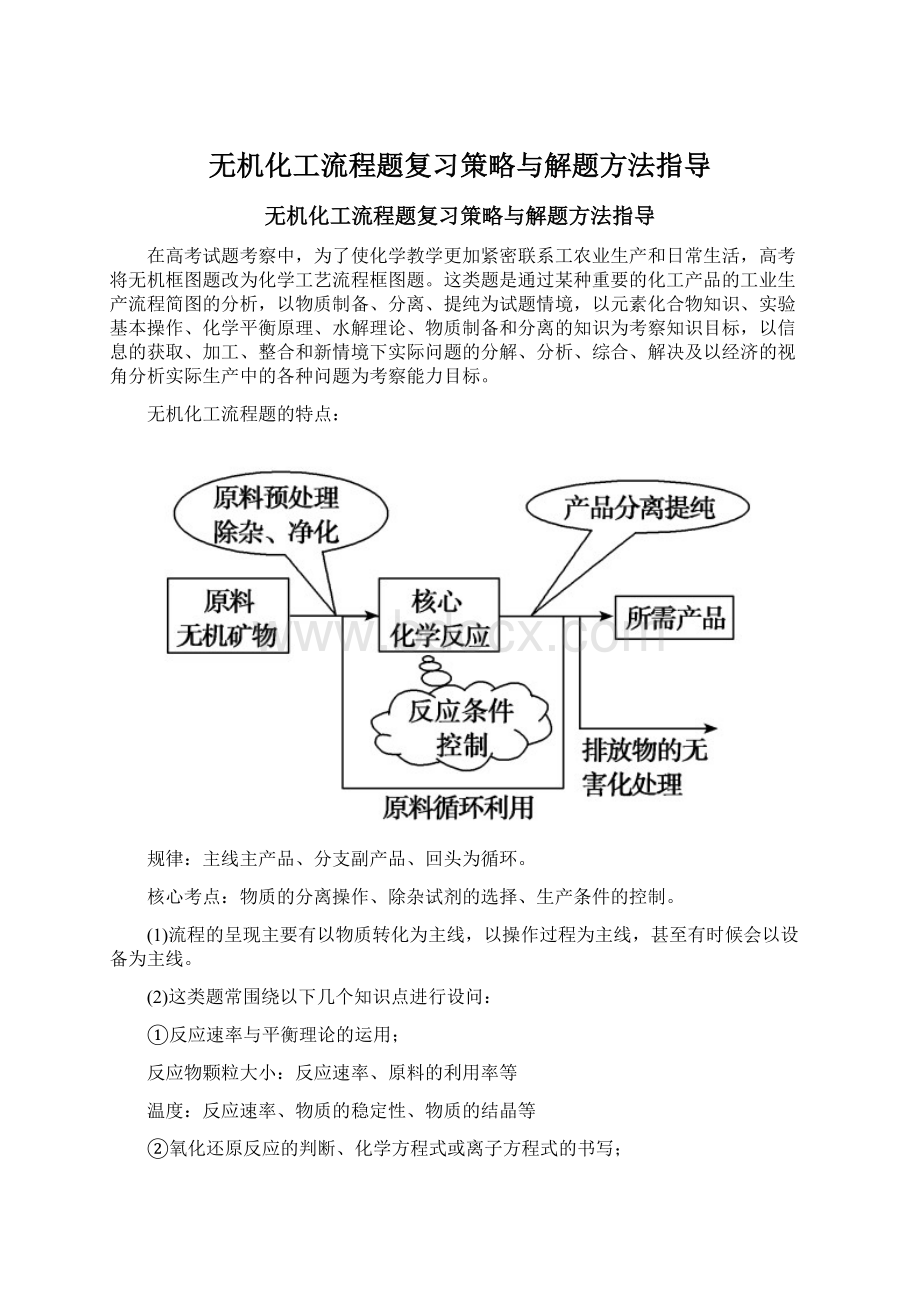
无机化工流程题的特点:
规律:
主线主产品、分支副产品、回头为循环。
核心考点:
物质的分离操作、除杂试剂的选择、生产条件的控制。
(1)流程的呈现主要有以物质转化为主线,以操作过程为主线,甚至有时候会以设备为主线。
(2)这类题常围绕以下几个知识点进行设问:
①反应速率与平衡理论的运用;
反应物颗粒大小:
反应速率、原料的利用率等
温度:
反应速率、物质的稳定性、物质的结晶等
②氧化还原反应的判断、化学方程式或离子方程式的书写;
③利用控制pH分离除杂;
④化学反应的能量变化;
⑤实验基本操作:
除杂、分离、检验、洗涤、干燥等;
⑥流程中的物质转化和循环,资源的回收和利用;
⑦环境保护与绿色化学评价。
解答无机化工流程试题的程序:
(1)基本步骤
①从题干中获取有用信息,了解生产的产品。
②然后整体浏览一下流程,基本辨别出预处理、反应、提纯、分离等阶段。
③分析流程中的每一步骤,从几个方面了解流程:
A.反应物是什么
B.发生了什么反应
C.该反应造成了什么后果,对制造产品有什么作用。
抓住一个关键点:
一切反应或操作都是为获得产品而服务。
④从问题中获取信息,帮助解题。
(2)流程具体分析:
化工过程加某物质的可能作用:
①参与反应:
作为原料参加反应、作为除杂试剂、作为除污染试剂。
②提供氛围(关注参与反应的物质性质的特殊性或反应条件的特殊性):
如氧化或还原性氛围、酸碱性氛围调节pH、温度氛围如提供能量维持高温、作溶剂如调节溶解度。
③满足定量要求:
如提供合适的元素比例,以符合产品的需要。
反应条件的选择:
反应
速率
平衡
提纯
温度
不能
太高
反应物或生成物可能不稳定或容易分解可能发生副反应
可能导致反应太剧烈
可能引起反应向不利于目标产物的方向移动
控制溶解度
不能
太低
温度低不利于反应发生
反应速率低
可能引起反应向不利于目标产物的方向移动
控制溶解度
浓度
控制
不可
太浓
可能容易分解、挥发
引发危险
可能不利于目标产物的生成
对后续操作产生影响
不可
太稀
反应不能顺利发生
速率太慢
可能不利于目标产物的生成,
对后续操作产生影响
过量
保证反应的完全发生或提高其他物质的转化率
对后续操作产生影响
酸碱度
的控制
控制反应的发生,酸性可增强物质的氧化性,碱性可增强物质的还原性
促进水解或抑制水解
学生看到化工流程题首先的感觉是害怕,因为害怕就不能静下心来审题做题,所以要先消除学生的恐惧心理,可以从以下入手。
化工流程题的备考建议:
(1)了解化工流程题的题型特点,充分利用教材知识素材
高考的化工流程题中试题的命制有时会依托教材中的重要的化工原料的制备及化学工业知识的介绍,工业流程相对稳定,所包含的化学知识比较基础,具有一定的代表性和典型性。
在备考中要重视教材的阅读,能够对涉及到化工生产的知识熟练掌握,举一反三。
(2)强化工业流程题的专项训练,及时归纳解题方法
收集各地高考模考中的工业流程题进行专题练习,指导学生学会运用化学反应原理、物质分离和制备及绿色化学的观点从经济的视角分析实际生产中的各种问题。
1.(2016·高考全国乙卷)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)NaClO2中Cl的化合价为。
(2)写出“反应”步骤中生成ClO2的化学方程式
。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为、。
“电解”中阴极反应的主要产物是。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
此吸收反应中,氧化剂与还原剂的物质的量之比为,该反应中氧化产物是。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:
每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
NaClO2的有效氯含量为。
(计算结果保留两位小数)
解析:
(1)由化合价规则知,NaClO2中Cl的化合价为+3。
(2)由工艺流程图可以看出SO2、H2SO4、NaClO3为反应物,ClO2、NaHSO4为生成物,再根据化合价升降法配平得出化学方程式为SO2+H2SO4+2NaClO3===2ClO2+2NaHSO4。
(3)粗盐水精制时除去Mg2+通常用NaOH溶液,生成氢氧化镁沉淀,过滤除去;除去Ca2+通常用Na2CO3溶液,生成碳酸钙沉淀,过滤除去。
电解时阴极为得电子极,因此产物的化合价应降低,即生成NaClO2。
(4)由信息“尾气吸收”是吸收“电解”过程排出的少量ClO2知,反应物之一为ClO2,再由生产工艺流程图知,用的吸收试剂是NaOH、H2O2,由生产工艺流程图知产物之一为NaClO2,由ClO2生成NaClO2,Cl的化合价由+4变为+3,化合价降低,ClO2为氧化剂,则H2O2为还原剂,化合价升高,生成氧气,再由得失电子守恒得,此吸收反应中氧化剂与还原剂的物质的量之比为2∶1,该反应中氧化产物是O2。
(5)由信息知,要求出每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,先求得1gNaClO2变为Cl-转移的电子数为1÷90.5×4,再设有xgCl2变为Cl-的氧化能力与1gNaClO2的氧化能力相当,列方程得1÷90.5×4=x÷71×2,解得x=1.57,即为有效氯含量。
答案:
(1)+3
(2)2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4 (3)NaOH溶液 Na2CO3溶液 ClO(或NaClO2) (4)2∶1 O2 (5)1.57
2.(2016·高考北京卷)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。
其工作流程如下:
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
ⅰ.2Fe2++PbO2+4H++SO===2Fe3++PbSO4+2H2O
ⅱ.……
①写出ⅱ的离子方程式:
。
②下列实验方案可证实上述催化过程。
将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.。
(3)PbO溶解在NaOH溶液中,存在平衡:
PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。
滤液1经处理后可在过程Ⅱ中重复使用,其目的是(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:
。
解析:
(1)根据题给化学工艺流程知,过程Ⅰ中,在Fe2+催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
(2)①催化剂能够参加化学反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变。
根据题给信息知反应ⅰ中Fe2+被PbO2氧化为Fe3+,则反应ⅱ中Fe3+被Pb还原为Fe2+,离子方程式为2Fe3++Pb+SO===PbSO4+2Fe2+;
②a实验证明发生反应ⅰ,则b实验需证明发生反应ⅱ,实验方案为取a中红色溶液少量,向其中加入铅粉后,红色褪去。
(3)①过程Ⅱ脱硫过程中发生的反应为PbSO4+2NaOH===PbO+Na2SO4+H2O,而滤液Ⅰ中含有硫酸,可降低溶液的pH,使平衡:
PbO(s)+NaOH(aq)NaHPbO2(aq)逆向移动,减少PbO的损失,提高产品的产率;②根据PbO的溶解度曲线,提纯粗Pb的方法为向PbO粗品中加入一定量的35%NaOH溶液中配成高温下的饱和溶液,降温结晶、过滤,得到PbO。
答案:
(1)Pb+PbO2+2H2SO42PbSO4+2H2O
(2)①2Fe3++Pb+SO===PbSO4+2Fe2+ ②b.取a中红色溶液少许,向其中加入铅粉后,红色褪去
(3)①A、B ②向PbO粗品中加入一定量的35%NaOH溶液,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤得到PbO固体
3.(2016·高考江苏卷)以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
(1)氯化过程控制电石渣过量,在75℃左右进行。
氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有(填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。
①滤渣的主要成分为(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]∶n[CaCl2]1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是。
解析:
(1)①氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水,则生成Ca(ClO)2的化学方程式为2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O。
②A.适当减缓通入Cl2速率可以使氯气被氢氧化钙充分吸收而反应,可以提高氯气的转化率,A正确;B.充分搅拌浆料可以增大反应物的接触面积,使氯气被氢氧化钙充分吸收而反应,可以提高氯气的转化率,B正确;C.加水使Ca(OH)2完全溶解,氢氧化钙浓度降低,不利于氯气的吸收,C错误,选AB。
(2)①碳酸钙不溶于水,与氯气不反应,氢氧化钙微溶,因此滤渣的主要成分为CaCO3、Ca(OH)2。
②由于氯气还能与氢氧化钙反应生成次氯酸钙、氯化钙和水,因此滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]∶n[CaCl2]<1∶5。
(3)根据图像可知氯酸钾的溶解度受温度影响最大,因此从该溶液中尽可能多地析出KClO3固体的方法是蒸发浓缩、冷却结晶。
答案:
(1)①2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O ②AB
(2)①CaCO3、Ca(OH)2 ②< (3)蒸发浓缩、冷却结晶