全国市级联考word甘肃省兰州市高考实战模拟考试理科综合化学试题Word文档格式.docx
《全国市级联考word甘肃省兰州市高考实战模拟考试理科综合化学试题Word文档格式.docx》由会员分享,可在线阅读,更多相关《全国市级联考word甘肃省兰州市高考实战模拟考试理科综合化学试题Word文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
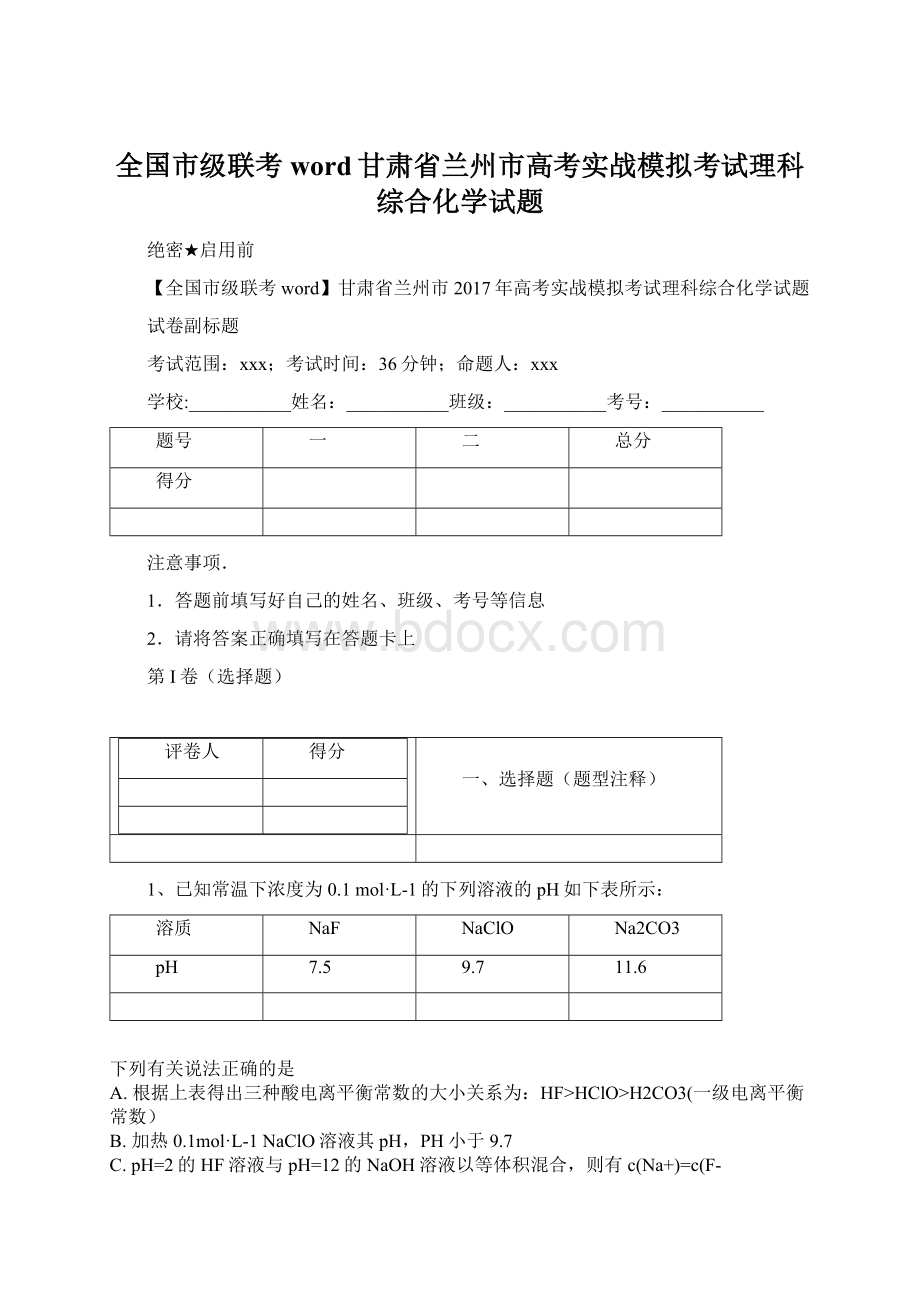
L-1NaClO溶液其pH,PH小于9.7
C.pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)=c(F-)>
c(H+)=c(OH-)
D.0.1mol·
L-1Na2CO3溶液中,存在的关系:
c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
2、短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。
R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T。
下列推断错误的是
A.形成的简单离子半径的大小顺序为T>
Y>
Z
B.Z2Y、Z2Y2所含有的化学键类型相同
C.0.005mol·
L-1T的最高价氧化物对应水化物的水溶液pH等于2
D.Z2T的水溶液显碱性,对水的电离有促进作用
3、己知
,下列有关说法中正确的是
A.M中所有碳原子均位于同一平面,且与苯互为同系物
B.与N含有相同官能团的同分异构体共有8种
C.M能发生加成反应和取代反应
D.N与乙醇发生酯化反应,生成物的分子式一定为C8H14O4
4、根据下图能量变化曲线判断,下列说法正确的是
A.H2(g)+1/2O2(g)=H2O(l)
△H=-242kJ·
mol-1
B.若H—H、O==O的键能分别是436kJ·
mol-1和496kJ·
mol-1,则H—O的键能是463kJ·
C.据图可知,氢气的燃烧热为242kJ·
D.10克氢气在氧气中完全燃烧,放出热量为1210kJ
5、下列离子方程式书写正确的是
A.碳酸钙与醋酸反应:
CO32-+
2CH3COOH=CO2↑+
H2O+2CH3COO-
B.向稀HNO3中滴加Na2SO3溶液:
SO32-+2H+=SO2↑+H2O
C.NaHCO3溶液显碱性:
HCO3-+H2O=CO32-+H3O+
D.碳酸氢钠溶液与足量氢氧化钡溶液混合:
HCO3-+Ba2++OH-=BaCO3↓+H2O
6、下列实验方案设计正确的是
A.利用图1收集干燥的氯化氢气体
B.选择合适的试剂,利用图2可分别制取并收集少量CO2、NO和O2
C.利用图3可验证铁发生吸氧腐蚀
D.利用图4蒸干NH4Cl饱和溶液制备NH4Cl晶体
7、中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果,下列古代文献对KNO3的叙述不合理的是
选项
目的
古代文献
说明
A
使用
“……凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”﹣《天工开物》
KNO3能自燃
B
鉴别
区分硝石(KNO3)和朴消(Na2SO4):
“强烧之,紫青烟起,乃真硝石也”﹣《本草经集注》
利用焰色反应
C
提纯
“(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”﹣《开宝本草》
溶解、蒸发、结晶
D
性质
“(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”﹣《本草纲目》
利用KNO3的氧化性
A.A
B.B
C.C
D.D
第II卷(非选择题)
二、简答题(题型注释)
8、【化学一选修5:
有机化学基础】
有机物B能与碳酸氢钠溶液反应产生二氧化碳,且其苯环上―氯代物只有2种,G为C和F在一定条件下按照1:
1反应生成的高分子化合物。
请根据下列转化关系回答:
己知:
(1)D中所含官能团的名称为______,E的名称为_______。
(2)G的结构简式为
______;
E→F的反应类型为______。
(3)下列有关说法正确的是_____(填序号)。
A.D可以发生银镜反应
B.1molC最多可与2molNaHCO3反应
C.C和F在一定的条件下可以反应生成环状化合物
D.H中所有的碳原子不可能在同一个平面上
(4)B和D反应生成H的化学方程式为_______________。
(5)同时符合下列条件B的同分异构体共有____种(不考虑立体异构);
①能发生银镜反应②含有苯环结构③能在碱性条件下水解
其中核磁共振氢谱中出现4组峰,且峰面积之比为3:
2:
1_______(写出结构简式)。
9、【化学一选修3:
物质结构与性质】
卤族元素单质与许多物质反应形成多种化合物。
请利用所学物质结构与性质的相关知识回答:
(1)写出基态碘原子的价电子排布式___________;
(2)卤族元素的含氧酸中酸性最强的是____(写化学式),该酸根离子的立体构型为_________。
(3)比较下列锗的卤化物的熔点和沸点,分析其变化规律及原因_________。
GeCl4
GeBr4
GeI4
熔点/℃
-49.5
26
146
沸点/℃
83.1
186
约400
(4)己知高碘酸有两种形式,化学式分别为H5IO6(
)和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____HIO4(填“>
”、“<
”或“=”)。
H5IO6中σ键与π键的个数比为________。
(5)己知氯元素与第四周期最外层只有1个电子、次外层的所有原子轨道均充满电子的元素M形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为_______,己知晶胞参数a="
0.542"
nm,此晶体的密度为_____g/cm3。
(写出计算式,不要求计算结果,阿伏加德罗常数为NA)
10、S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。
实验室常用CS2与纯净的氯气制备S2C12。
反应涉及到的几种物质的熔沸点如下:
物质
CS2
Cl2
CCl4
S2C12
47
-34.6℃
77
137
-109
-100.98℃
-23
-77
实验室利用下列装置制备S2C12(部分夹持仪器己略去):
回答下列问题:
(1)装置中b玻璃仪器的名称为_______;
写出制备S2C12的化学方程式_______。
(2)整套装置装配完毕后,首先进行的操作是________,再添加试剂。
(3)实验中盐酸试剂通常采用36.5%的浓盐酸,不用稀盐酸的理由是________。
装置A中反应的离子方程式是___________。
(4)D中采用热水浴加热的原因是__________,反应结束后从锥形瓶内混合物中分离出产品的方法是_______________。
(5)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为__________。
(6)该实始装置设计存在缺陷,你的改进建议及改进目的是_______________。
11、工业上采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、A12O3,不考虑其他杂质)制取FeSO4·
7H2O,其制备工艺流程如下:
结合所学知识回答:
(1)溶解烧渣选用的酸应为_____(填化学式),选用的试剂X为_____(填试剂名称)。
(2)加入NaOH控制pH的目的是____________。
(3)从溶液2得到FeSO4·
7H2O的实验操作主要步骤是________________________。
(4)为了测定获得的绿矾产品的纯度,进行了如下实验操作:
I.称取2.850g绿矾产品,溶解,用250mL容量瓶配制成待测液;
II.量取25.00mL待测溶液置于锥形瓶中;
III.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①判断此滴定实验达到终点的方法是____________。
②该滴定反应的离子方程式为___________________。
③上述样品中FeSO4·
7H2O的纯度为____________________。
(5)古代炼丹家以绿矾(FeSO4·
7H2O)为原料,放在炼丹炉中锻烧可制得绿矾油。
下图是2.780g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。
将加热产生的所有气体通入足量的BaCl2溶液,得到白色沉淀1.165g。
则t1~t2段发生反应的化学方程式为__________。
12、能源短缺是人类社会面临的重大问题。
甲醇是一种可再生能源,具有广泛的开犮和应用前景。
工业上通过媒的气化生成的CO和H2合成甲醇,反应原理为:
CO(g)+2H2(g)
CH3OH(g)
(1)在一容积可变的密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇。
CO的平衡转化率(a)与温度(T)、压强(p)的关系如图1所示。
①合成甲醇的反应为_____(填“放热”或“吸热”)反应。
判断理由是_________。
平衡常数KA_____KC(填“>
”、“&
lt;
②下列有关该反应的说法正确的是_____(填字母序号)。
A.当v(CO)生成=2v消耗(H2)时该反应达到平衡状态
B.其它条件不变,只改变CO和H2的投料量,该反应的焓变发生改变
C.在反应过程中混合气体的密度和相对平均分子质量均不发生变化
D.使用催化剂可以减小反应的活化能
(2)下列措施可以提高甲醇产率的是________。
A.压缩容器体积
B.恒容条件下充入He,使体系总压强增大
C.将CH3OH(g)从体系中分离
D.恒压条件下再充入10molCO和20molH2
(3)甲醇一一空气燃料电池装置如图2所示。
①该电池甲电极的电极反应式为_________。
②若用此甲醇燃料电池电解200mL—定浓度NaCl与CuSO4的混合溶液(电极为惰性电极,不参与反应),电极产生气体体积(标况下)与电解时间的关系图如图3所示,此溶液中硫酸铜的浓度为______mol/L。
参考答案
1、D
2、B
3、C
4、B
5、D
6、C
7、A
8、
羟基
1,2-二溴乙烷
取代反应
BC
4
9、
5s25p3
HClO4
正四面体
GeCl4、GeBr4、GeI4的熔、沸点依次增高。
原因是分子结构相似。
相对分子质量依次增大。
分子间相互作用力逐渐增强
<
11:
1
CuCl
或
10、
冷凝管
CS2+3Cl2
CCl4+S2Cl2
检查气密性
稀盐酸的还原性弱于浓盐酸的还原性,不能被二氧化锰氧化生成氧气
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
使气化蒸馏
2S2Cl2+2H2O=3S↓+SO2↑+4HCl
在D和E之间增加干燥装置
进入锥形瓶引起产物S2Cl2水解
11、
H2SO4
铁粉(Fe)
使Al3+转化为A1(OH)3沉淀,而不使Fe2+沉淀
蒸发浓缩、冷却结晶、过滤洗涤、自然干燥
滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色
MnO4-+5Fe2++8H+==Mn2++5Fe3++4H2O
97.5%
2FcSO4
Fe2O3+SO2↑+SO3↑
12、
放热
从图1可以看出,在压强不变的情况下,随温度T的升高,CO转化率减低,说明平衡逆向移动,则正向为放热反应
>
BD
AC
CH3OH+H2O-6e-=CO2+6H+
0.1
【解析】
1、A.相同温度下,相同浓度的钠盐溶液中,弱酸根离子水解程度越大其溶液pH越大,酸根离子水解程度越大其相对应的酸的电离程度越小,即酸的电离平衡常数越小,根据表中数据知,酸根离子水解程度F-<ClO-<CO32-,则酸的电离平衡常数HF>HClO>HCO3-,故A错误;
B.盐类水解是吸热反应,升高温度促进盐类水解NaClO溶液pH>7,则NaClO是强碱弱酸盐,升高温度促进其水解,溶液的碱性增强,pH增大,故B错误;
C.常温下NaF溶液pH=7.5>7,NaF溶液呈碱性,说明NaF是强碱弱酸盐,则HF是弱酸;
pH=2的HF浓度大于pH=12的NaOH溶液浓度,二者等体积混合HF有剩余,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒得c(Na+)<c(F-),酸的电离程度较小,则溶液中离子浓度大小顺序是c(F-)>c(Na+)c(H+)>c(OH-),故C错误;
D.根据物料守恒:
2[c(CO32-)+c(HCO3-)+c(H2CO3)]=c(Na+),根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故D正确;
故选D。
2、由以上分析可知X为H、R为C、Y为O、Z为Na、T为S元素;
A.S的离子核外有3个电子层,而O、Na的离子核外有2个电子层,核外电子层数越多,离子半径越大,且核电荷数越大离子半径越小,则形成的简单离子半径的大小顺序为T>Y>Z,故A正确;
B.Na2O只含有离子键,Na2O2含有离子键和共价键,故B错误;
C.0.005mol•L-1T的最高价氧化物对应水化物为硫酸,水溶液中氢离子浓度为0.01mol/L,则pH等于2,故C正确;
D.Na2S水解呈碱性,可促进水的电离,故D正确;
故选B。
点睛:
推断元素是解题的关键,R原子最外层电子数是电子层数的2倍,可能为C或S,由于图示原子半径和原子序数关系可知R应为C;
Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;
Z与T形成的Z2T化合物能破坏水的电离平衡,T应为S,X的原子半径最小,原子序数最小,应为H元素,结合对应单质、化合物的性质以及题目要求解答该题。
3、A.有机物含有饱和碳原子,具有甲烷的结构特点,则所有碳原子不在同一个平面上,不含苯环,不是同系物,故A错误;
B.可作为C4H10的2个H被-COOH取代,C4H10有正丁烷、异丁烷两种,二取代物共9种,故B错误;
C.M含有碳碳双键,可发生加成反应,也可发生取代反应,如关照条件下可与氯气发生取代反应,故C正确;
D.N含有2个羧基,可与部分或完全酯化,故D错误;
故选C。
4、A.由图可知H2(g)+1/2O2(g)=H2O(g)
△H=-242kJ·
mol-1,故A错误;
B.反应热△H=反应物的键能和-生成物的键能和,若H—H、O=O的键能分别是436kJ·
mol-1,则△H="
(4×
436"
kJ·
mol-1+496kJ·
mol-1)-(2×
H—O的键能)=-242kJ·
mol-1,得H—O的键能是463kJ·
mol-1,故B正确;
C.氢气的燃烧热为1mol氢气完全燃烧生成液态水放出的热量,故C错误;
D.10克氢气的物质的量为5mol,在氧气中完全燃烧生成气态水,放出热量为1210kJ,故D错误;
答案为B。
5、A.醋酸是弱酸,不可拆分,故A错误;
B.稀HNO3有强氧化性,能氧化Na2SO3生成Na2SO4,故B错误;
C.HCO3-的水解是可逆反应,应用“
”,故C错误;
D.碳酸氢钠溶液与足量氢氧化钡溶液混合发生的离子反应为HCO3-+Ba2++OH-=BaCO3↓+H2O,故D正确;
答案为D。
6、A.氯化氢的密度比空气大,排空气法收集时导管应长进短出,故A错误;
B.NO易于空气中的氧气作用,无法用排空气法收集,故B错误;
C.氯化钠溶液呈中性,铁在食盐水中发生吸氧腐蚀,在酸性条件下发生析氢腐蚀,故C正确;
D.NH4Cl不稳定,受热易分解,故D错误;
答案为C。
7、A.由文献可知,KNO3加热后才分解,不能自燃,故A错误;
B.鉴别KNO3和Na2SO4,利用钾元素和钠元素的焰色反应不同,钠元素焰色反应为黄色,钾元素焰色反应为隔着钴玻璃为紫色,故B正确;
C.KNO3溶解度随温度变化大,提纯的方法是利用溶解后,煎炼得之主要利用蒸发结晶,故C正确;
D.火药发生化学反应时生成氮气,KNO3中氮元素的化合价降低,由文献可知KNO3的氧化性,故D正确;
故选A。
8、A为乙烯,与水发生加成反应生成D为CH3CH2OH,乙烯与溴发生加成反应生成E为BrCH2CH2Br,E在氢氧化钠水溶液、加热条件下发生水解反应生成F为HOCH2CH2OH,B的分子式为C8H8O2,B能与碳酸氢钠溶液反应产生二氧化碳,含有-COOH,其苯环上一氯代物只有2种,则B为
,B发生氧化反应生成C为
,故H为
,G为C和F一定条件下1:
1反应生成的高分子化合物,故G为
;
(1)CH3CH2OH中所含官能团的名称为羟基,BrCH2CH2Br的名称为1,2-二溴乙烷;
(2)G的结构简式为
E在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2OH,反应类型为取代反应;
(3)A.CH3CH2OH分子结构中无醛基,不可以发生银镜反应,故A错误;
B.1mol
最多可与2molNaHCO3反应生成CO2,故B正确;
C.
和HOCH2CH2OH在一定的条件下可以环酯化,反应生成环状酯,故C正确;
D.
中苯环和羰基是平面结构,分子内所有的碳原子可能在同一个平面上,故D错误,答案为BC;
(4)
和CH3CH2OH发生酯化反应反应生成H的化学方程式为
(5)B为
,其同分异构体符合下列条件:
①能发生银镜反应,含有-CHO;
②含有苯环结构;
③能在碱性条件下水解,含有酯基,故应为甲酸形成的酯,只有1个侧链,为-CH2OOCH,有1种,若有2个侧链,为-CH3、-OOCH,有邻、间、对3种位置关系,故符合条件的同分异构体共有4种;
其中核磁共振氢谱中出现4组峰,且峰面积之比为3:
2:
1,应含有一个甲基,符合条件的同分异构体为:
。
根据反应条件推断反应类型:
(1)在NaOH的水溶液中发生水解反应,可能是酯的水解反应或卤代烃的水解反应。
(2)在NaOH的乙醇溶液中加热,发生卤代烃的消去反应。
(3)在浓H2SO4存在的条件下加热,可能发生醇的消去反应、酯化反应、成醚反应或硝化反应等。
(4)能与溴水或溴的CCl4溶液反应,可能为烯烃、炔烃的加成反应。
(5)能与H2在Ni作用下发生反应,则为烯烃、炔烃、芳香烃、醛的加成反应或还原反应。
(6)在O2、Cu(或Ag)、加热(或CuO、加热)条件下,发生醇的氧化反应。
(7)与O2或新制的Cu(OH)2悬浊液或银氨溶液反应,则该物质发生的是—CHO的氧化反应。
(如果连续两次出现O2,则为醇→醛→羧酸的过程)。
(8)在稀H2SO4加热条件下发生酯、低聚糖、多糖等的水解反应。
(9)在光照、X2(表示卤素单质)条件下发生烷基上的取代反应;
在Fe粉、X2条件下发生苯环上的取代。
9、
(1)碘的核电荷数为53,基态碘原子的电子排布式为[Kr]4d105s25p5,其价电子排布式5s25p3;
(2)含氯的酸中高氯酸酸性最强是含氧酸中最强酸,化学式为:
HClO4,高氯酸酸根离子中氯原子为sP3杂化,没有孤对电子数,立体构型为正四面体;
(3)锗的卤化物都是分子晶体,分子间通过分子间作用力结合,对于组成与结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,由于相对分子质量:
GeCl4<GeBr4<GeI4,故沸点:
GeCl4<GeBr4<GeI4;
(4)H5IO6(
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:
H5IO6<HIO4,H5IO6中σ键数11,π键数为1,两者的个数比为11:
1;
(5)依据晶胞结构,利用切割法分析,每个晶胞中含有铜原子个数为:
8×
+6×
=4,氯原子个数为4,则化学式为;
CuCl;
1mol晶胞中含有4molCuCl,1mol晶胞的质量为M(CuCl)×
4,晶胞参数a=0.542nm,则晶体密度为
=
10、
(1)根据仪器的结构可知装置中b玻璃仪器的名称为冷凝管;
CS2遇Cl2在加热条件下生成S2C12和CCl4的化学方程式为CS2+3Cl2
CCl4+S2Cl2;
(2)整套装置装配完毕后,应先进行气密性的检查,再添加试剂.;
(3)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸,因为稀盐酸还原性弱,反应困难;
用固液加热的方法制Cl2,常用浓盐酸和二氧化锰反应制取,反应离子方程式为:
Mn2++Cl2↑+2H2O;
(4)根据表中物质的沸点高低,为了使CS2平稳汽化,避免产物S2Cl2汽化,可以采用水浴加热的方法,结束后从锥形瓶内混合物中分离出S2Cl2的方法是蒸馏,控制温度在137℃;
(5)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,无色刺激性气味气体除氯化氢外,依据氧化还原反应的元素化合价变化守恒推断,化合价降低的生成黄色沉淀为单质硫,化合价升高的生成二氧化硫气体,依据原子守恒、电子守恒写出化学方程式为:
2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(6)S2Cl2易水解,在D和E之间增加干燥装置,防止水蒸汽进入锥形瓶引起产物S2Cl2水解。
11、
(1)制取七水合硫酸亚铁,为不引入杂质,故酸应选择硫酸;
试剂X的作用是将铁离子还原为亚铁离子,不引入新杂质,X为铁单质;
(2)加入NaOH控制溶液pH是为了使Al3+转化为A1(OH)3沉淀,而不使Fe2+沉淀;
(3)将FeSO4溶液蒸发浓缩、冷却结晶、过滤洗涤、自然干燥可得到FeSO4·
7H2O;
(4)①根据题中实验步骤可知,滴定实验达到终点时,溶液中的高锰酸钾不完全褪色,溶液呈浅红色,所以判断滴定实验达到终点的现象是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
②酸性KMnO4被FeSO4还原时生成Mn2+,同时生成铁离子,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
③根据电子得失守恒有关系式MnO4-~5Fe2+,滴定中用去的高锰酸钾的物质的量为0.0100mol/L×
0.02L=0.0002mol,所以2.850g绿矾产品中FeSO4•7H2O的物质的量为:
×
5×
0.0002mol=0.01mol,所以样品中FeSO4•7H2O的质量分数为:
100%=97.5%;
(5)根据元素守恒,及绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈即能与氧化铁反应,可知绿矾油应为浓硫酸;
2.78g的FeSO4•7H2O晶体的物质的量
=0.01mol,加热生成FeSO4时的质量为1.52g,再将FeSO4加热产生的所有气体通入足量的BaCl2溶