浙大作业物理化学习题集答案Word文件下载.docx
《浙大作业物理化学习题集答案Word文件下载.docx》由会员分享,可在线阅读,更多相关《浙大作业物理化学习题集答案Word文件下载.docx(15页珍藏版)》请在冰豆网上搜索。
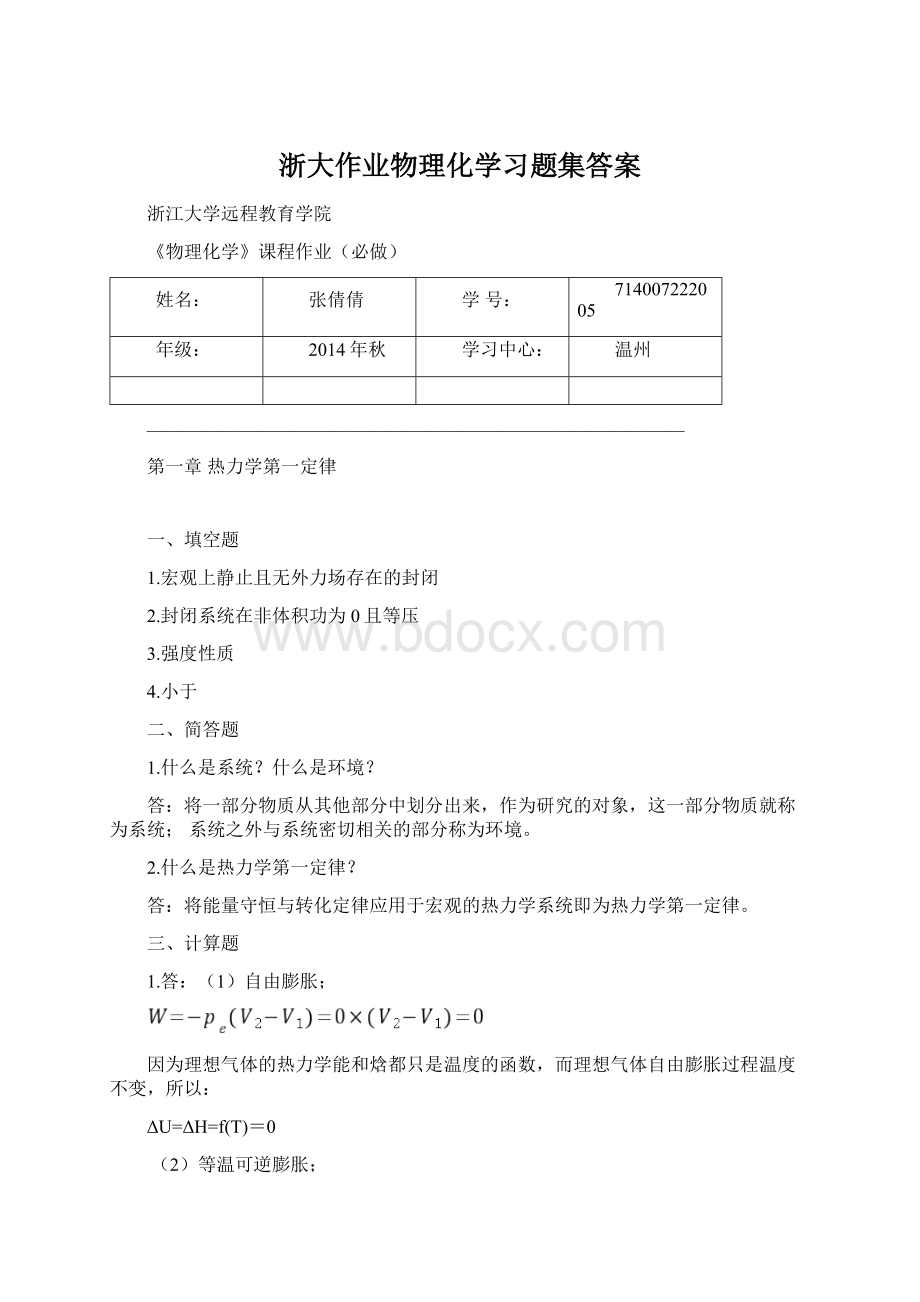
(40-15)=-1548.5J
Q=-w=1548.5J
2.答:
2NaCl(s)+H2SO4(l)=Na2SO4(s)+2HCl(g)
△rHmө=(∑H)产物-(∑H)反应物=(-1383-92.3*2)-(-411*2-811.3)=65.7KJ/mol
第二章热力学第二定律
一、单选题
1.反应NH4Cl(s)=NH3(g)+HCl(g)的△rSmөA。
A.大于零B.小于零C.等于零D.不确定
二、填空题
1.过程方向限度
2.大于
3.绝热可逆压缩
4.封闭系统等温等压和非体积功为零
5.小于
三、简答题
1.什么是热力学第二定律?
热量由低温物体传给高温物体而不引起其他变化,是不可能的。
2.如何用熵判据判断过程的方向?
熵是系统混乱程度的度量,孤立系统的熵值永远不会减少,孤立系统杜绝了一切人为控制则可用熵增原理来判别过程的自发方向。
孤立系统中使熵值增大的过程是自发过程也是不可逆过程;
使系统的熵值保持不变的过程是可逆过程,系统处于平衡态;
孤立系统中不可能发生使熵值变小的任何过程。
3.如何用吉布斯能判据判断过程的方向?
在等温等压和W=0的条件下,封闭系统自发过程总是朝着吉布斯能减小的方向进行,直至吉布斯能降到极小值(最小吉布斯能原理),系统达到平衡。
4.一般情况下,温度升高,固体溶解度增大,气体溶解度减小,请用热力学原理解释之。
一般情况下,固体溶解是熵增加过程,而气体溶解是熵减少过程。
根据G=△H-TS提高温度对固体溶解有利而对气体溶解不利。
四、计算题
P末V末=nRT
P末×
0.05m²
=2mol×
298.15K
P末=9.92×
104PaW=-P末△V=-9.92×
104Pa×
(0.05m2-0.025m2)=-2.48×
103J
Q=-W=2.48×
△S环境=-Q/T=8.314J/mol/K
温度不变状态函数△U、△H、△S、△F和△G都为零
2.0.5L343K的水与0.1L303K的水混合,求系统的熵变。
已知水的Cp,m=75.29J/(K·
mol)。
0.5×
75.29×
(343-T)=0.1×
(T-303)
T=336.33
△S=Cpln(T/T0)+Cpln(T/T1)=2.091J/K
3.答:
(1)ΔS槽=-Q/T槽=-4184/(96.9+273)=-11.3J·
K-1
(2)ΔS空=Q/T空=4184/(26.9+273)=13.95J·
(3)因为ΔS总=ΔS槽+ΔS空=-11.3+13.95=2.65J·
K-1>0
所以不可逆。
4.答:
ΔrSmθ=Sθ,金刚石,s-Sθ,石墨,s=2.44-5.69=-3.25J·
mol-1·
ΔrGθm=ΔrHθ-TΔrSmθ=1.90*1000-(25+273)*(-3.25)=2868J/mol=2.87KJ/mol
石墨更稳定
第四章化学平衡
1.*改变反应物的浓度将影响化学平衡,这是由于B发生改变所致。
A.
B.△rGm
C.经验平衡常数D.标准平衡常数
2.*已知反应N2+3H2=2NH3的标准平衡常数为K1ө,反应
的标准平衡常数为K2ө,两者的关系为D。
A.K1ө=K2өB.K1ө=2K2өC.K1ө=½
K2өD.K1ө=(K2ө)2
3.*反应N2O5(g)=N2O4(g)+½
O2(g)的△rHmө=41.84kJ·
mol-1,为了提高N2O4的产率,可以采取的措施是B。
A.降低温度、提高压力B.降低压力、提高温度
C.降低温度、降低压力D.提高温度、提高压力
4.*若298K时反应N2O4(g)=2NO2(g)的Kө=0.1132,则当N2O4和NO2的分压均为1.0kPa时,该反应A。
A.向生成NO2的方向进行B.向生成N2O4的方向进行
C.正好达到化学平衡D.难于判断其进行方向
5.*某气态反应为放热反应,在727℃时的Kө=3.4×
10-5,已知△rHmө=-189kJ·
mol-1,则在827℃时的Kө=C。
A.3.4×
10-5B.3.4×
10-4C.4.3×
10-6D.4.3×
10-7
1.(K1ө/K2ө)2。
2.0.02409。
3.向左
4.向右
5.-15.92kJ·
mol-1。
三、简答题
1.化学反应CaCO3(s)=CaO(s)+CO2(g)必须在高温下进行,请用热力学原理解释之。
化学反应CaCO3(s)=CaO(s)+CO2(g)是吸热反应,提高反应温度可以增大平衡常数,有利于反应正向进行。
乙苯脱氢生成苯乙烯是吸热反应,提高反应温度有利;
该反应也是增加体积的反应,减少压力有利。
通过通入过热水蒸气即可以提供热量,维持较高的反应温度,同时还由于水蒸气不参加反应,起稀释作用,与减少压力效果等同。
(1)因为△rGmө=-168.6-68.178+228.59=-8.268kJ·
mol-1
△rGmө=-RTlnKө
lnKө=△rGmө/(-RT)=-8.268*103/(-8.314*298.2)=3.3025
所以Kө=27.18(298.2K)
(2)ln(K2/K1)=【△rHmө*(1/T1-1/T2)】/R
lnk2/27.18=-46.02*1000*(1/298.2-1/500)/8.314
lnk2/k1=7.5
K2=0.01516
2答:
(1)△rGmө=-RTlnKө=-8.314*298.2*lnKө=12890
lnKө=-5.2Kө=5.521*10-3(
(2)能自动分解
第五章相平衡
1.简单低共熔双组分系统T-x相图如图所示。
当物系点M随温度下降时,固相物质与液相物质重量的比值A。
()
A.增大
B.减小
C.不变
D.先增大,后减小
1.在常温常压下,由O2(g)、N2(g)、CO2(g)和H2O(l)等四种物质组成的平衡系统含有2相。
2.碳酸钠与水可以形成三种含水盐:
Na2CO3·
H2O(s)、Na2CO3·
7H2O(s)和Na2CO3·
10H2O(s)。
在常压下,Na2CO3(s)与Na2CO3溶液及一种Na2CO3含水盐(s)三相平衡,则该含水盐含有2个水分子。
3.单组分系统三相点的自由度等于0。
4.已知A和B不会形成恒沸混合物,纯A的沸点低于纯B的沸点。
对任一比例的A和B混合物进行精馏,塔底馏出物是纯B。
5.固体混合物在某个比例时的熔点最低,该熔点称为最低共熔点。
1.什么是恒沸混合物?
气液平衡时两相组成相同的混合物。
1.已知水的气化热为△H=40.67kJ·
mol-1,求p=404.13kPa时水的沸点。
lnP2/P1=△H(T2-T1)/RT1T2
P1=101.32kPaTI=100+273=373KP2=404.13kPa
△H=40.67kJ·
mol-1
ln(404.13/101.32)=40670*(T2-373)/(8.314*373*T2)
T2=144.1℃
2:
(1)A区(上面):
液相
B区(中左):
液相+固相邻硝基氯苯
C区(中右):
液相+固相对硝基氯苯
D区(下面):
固相邻硝基氯苯+固相对硝基氯苯
(2)根据杠杆规则:
ns/nl=(70-60.18)/(100-70)=9.82/30
ns=(70+30)*[9.28/(30+9.82)]=24.66g
nl=(70+30)*[30/(30+9.82)]=75.34g
第六章电化学
1.下列说法正确的是A。
A.E与电解质活度有关,Eө与电解质活度无关
B.E与电解质活度无关,Eө与电解质活度有关
C.E和Eө均与电解质活度无关
D.E和Eө均与电解质活度有关
2.Pt︱H2(p1)︱H2SO4(m)︱O2(p2)︱Pt的电池反应可写成:
①H2(g)+½
O2(g)=H2O(l)
或②2H2(g)+O2(g)=2H2O(l)
相应的标准电动势和化学反应标准平衡常数分别用E1ө、E2ө、K1ө和K2ө表示,则D。
()
A.E1ө=E2ө、K1ө=K2өB.E1ө≠E2ө、K1ө≠K2ө
C.E1ө≠E2ө、K1ө=K2өD.E1ө=E2ө、K1ө≠K2ө
1.Ca2+和Cl-的无限稀释摩尔电导率分别为
S·
m2·
mol-1和
S·
mol-1,则CaCl2的无限稀释摩尔电导率
=0.01646S·
2.Ag︱AgCl,KCl(a1)‖AgNO3(a2)︱Ag的电池反应是Cl-(al)+Ag+(a2)=AgCl(s)。
3.Pt︱H2(p)︱NaOH(a)︱HgO(s)︱Hg(l)的正极反应是HgO(s)+H2O+2e-=Hg(l)+2OH-(a)。
4.Pt︱H2(p1)︱H2SO4(m)︱H2(p2)︱Pt的负极反应是H2(p1)=2H+(m)+2e-。
5.在电化学中,规定标准氢电极的电极电势为零。
1.什么是摩尔电导率?
答:
摩尔电导率是指相距为1m的两平行电极间放置含有1mol电解质的溶液所具有的电导。
2.什么是可逆电池?
电池中进行的化学反应,能量转换和其他过程均可逆的电池四、计算题
(1)因为G=1/R,G=R*A/l
所以l/A=kR=0.2786*82.4=22.96m-1
(2)K2=l/R2A=1/376*22.96=0.06105S·
m-1
(3)因为∧m=KVm=k/c
所以∧m(K2SO4)=k/c=6.11*10-2/0.0025*103=0.0245S·
已知λm∞Ag+=61.92*10-4s·
m2mol-1
λm∞cl+=76.34*10-4s·
∧m(AgCl)=λm∞(AgCl)=(61.92+76.34)*10-4=1.382*10-2s·
根据C(饱和)=〔k(溶液)-k(水)〕/λm(AgCl)=〔(3.41-1.52)*10-4〕
/1.382*10-2=1.37*10-2mol·
m-3
根据溶解度定义:
每kg溶液溶解的固体kg数,对于极稀溶液=1dm-3溶液,
所以AgCl的标准活度积为:
KSPө(AgCl)=c(Ag+)/cө·
c(Cl-)/cө=(1.37*10-5)2=1.88*10-10
(1)负极(氧化反应):
2Cl--2eCl2
正极(还原)反应:
MnO4-+8H++5e-Mn2++4H2O
电池反应:
2MnO4-+16H++10Cl-2Mn2++5Cl2+8H2O
(2)Eθ=φθMnO4-,Mn2+-φθCl2(g)/cl-=1.507-1.358=0.149V
(3)E=Eθ-(RT)/(Vf)ln[(CMn)2*(Ccl)5*(CH2O)8]/C2(Mno4-)
=0.149-(8.314*298/10/96500)=0.0543V
第七章化学动力学
一、判断题
1.对
二、单选题
1.化学反应
的反应速率可以表示为
或
,两者之间的关系为D。
B.
C.
D.
三、填空题
1.由反应物微粒(分子、原子、离子、自由基)一步直接生成产物的反应称为基元反应。
2.某化学反应A+B→P的速率方程是
,该反应的反应级数等于3。
3.某化学反应A→P是一级反应,当反应时间为2t1/2时,反应的转化率为75%。
4.已知下列两个反应的指前因子相同,活化能不同,且Ea,1>
Ea,2
当反应温度升高时,k1小于k2(填“大于”、“小于”或“等于”),k1/k2增大(填“增大”、“减小”或“不变”)。
5.按照光化当量定律,在光化反应的初级过程中,1爱因斯坦能量活化1mol反应物分子。
温度对光化反应的速率常数影响大
四、简答题
1.什么是准一级反应?
有些反应实际上不是真正的一级反应,但由于其它反应物的浓度在反应过程中保持不
变或变化很小,这些反应物的浓度项就可以并入速率常数中,使得反应速率只与某反应物的一次方成正比,其速率方程的形式与一级反应相同,这样的反应称为准一级反应。
2.用活化分子的概念解释提高反应温度可以加快化学反应的原因。
根据波兹曼能量分布定律,温度升高,高能量分子所占的比例增大,即活化分子增多,反应速率加快。
3.为什么光化反应的速率常数与温度关系不大?
在热化学反应中,活化分子是根据玻尔兹曼能量分布反应物分子中能量大于阈能的部分。
温度升高,活化分子所占的比例明显增大,速率常数增大。
而在光化反应中,活化分子主要来源于反应物分子吸收光子所形成,活化分子数与温度关系不大,因此,速率常数也与温度关系不大。
4.降低反应温度有利于提高合成氨反应的平衡转化率,但实际生产中为什么选取450~550℃的较高温度?
由于合成氨反应是放热反应,降低反应温度有利于提高合成氨反应的平衡转化率,但实际生产中,不仅要考虑平衡转化率,还要考虑反应速率,升高温度对提高反应速率有利。
实践的结果是选取450~550℃比较合适。
五、计算题
(1)ln(CA,0/CA)=KAT
CA,0/CA=rA,0/rA=4
Ln4=KA*120
KA=ln4/120=0.0116min-1
(2)t1/2=ln2/kA=0.693/0.0116=60min
(3)rA=k*CA
CA=4.00×
10-3/0.0116=0.345mol*dm-3
(1)反应的活化能:
t11/2=ln2/K1=32.1*60=1926
K1=3.60*10-4h-1
T21/2=ln2/K2=17.1*60=1026
K2=6.76*10-4h-1
ln(6.76/3.60)=-E/8.314*[1/(37+273)-1/(43+273)]
E=85.60kJ/mol
所以故反应的活化能E=85.60kJ/mol
(2)速率常数:
k3=k2*exp[-E/R*(1/298-1/316)]=5.68*10-3h-1
3:
(1)t1/2=(ln2)/k=ln2/7.92=0.0875d
(2)k2=k1*exp[-E/R*(1/298-1/373)]=0.04341d-1
(3)t0.7=(1/K)*ln(10/7)=8.22d
第八章表面现象
1.p平、p凹和p凸分别表示平面、凹面和凸面液面上的饱和蒸气压,则三者的关系是
p凹<p平<p凸。
2.20℃时,水的饱和蒸气压为2337.57Pa,密度为998.3kg·
m-3,表面张力为7.275×
10-2N·
m-1,则半径为10-9m的水滴在20℃时的饱和蒸气压为6864.83Pa。
3.已知某温度下液体A、液体B和它们之间的表面张力分别σA=7.5×
10-2N·
m-1,σB=3.2×
m-1,σA-B=1.2×
m-1,则A在B表面的铺展系数等于-5.5×
m-1,A不能在B表面铺展(填“能”或“不能”)。
4.将200gHLB=8.6的表面活性剂与300gHLB=4.5的表面活性剂进行混合,所得混合物的HLB=6.14。
5.对于化学吸附,当吸附温度升高时,吸附速率增大,吸附量减少。
1.什么是表面活性剂?
其结构特征如何?
能显著降低溶液表面张力的物质称为表面活性剂。
表面活性剂都是两亲分子,
即同时具有亲水的极性基团和亲油的非极性基团。
2.表面活性剂如何起增溶作用?
表面活性物质是通过形成胶团使溶质溶解在胶团中而起增溶作用。
3.什么是物理吸附?
什么是化学吸附?
答:
固体和吸附质之间由于范德华引力所引起的吸附称为物理吸附,固体和吸附质之间
由于化学键力所引起的吸附称为化学吸附。
(1)因为P静=(ρ液-ρ气)hg=ρ液hg
又因为Δp=(2σ)/r,rcosθ=R,
所以Δp=(2σcosθ)/R
因此ρ液hg=(2σcosθ)/R
即h=(2σcosθ)/(ρ液hgR)
根据汞与毛细管壁的接触角为140°
,θ>900,h<0,毛细管内液面下降,
低于正常液面。
所以毛细管内的汞面下降。
(2)由上题公式h=(2σcosθ)/(ρ液hgR)得
σ=(ρ液hgR)/(2cosθ)
=[1.359×
104*(-16)*9.8*3.5×
10-4]/[2*(cos140)]/1000
=0.487N/m
已知水的M=18.015*10-3σ=58.9×
10-3N·
m-1
100℃时水的密度=958.4kg/m3P=101.325kpa
T=100+273=373r=10-6/2=5*10-7
由开尔文公式得知:
ln(pr/p)=(2σM)/(рRTr)
ln(pr/101.325)=(2*58.9*10-3*18.015*10-3)/[958.4*8.314*373*(-1*5*10-7)]
pr=101.1804kpa
△P=(2σ)/r=[(2*58.9*10-3)/(1*5*10-7)]*10-3=235.600kpa
P=pr+△P=101.1804+235.600=336.7804kpa
根据克劳修斯-克拉伯龙方程ln=(p2/p1)=[(-△vapHm)/R]*[(1/T2)-(1/T1)]
T2=({[Rln(p2/p1)]/(-△vapHm)}+(1/T1))-1
=({[8.314*ln(336.7804/101.1804)]/(-40.656*10-3)}+(1/373))
=410.77K(138℃)
3.答:
(1)兰格缪尔吸附等温式Γ=Γm*(bp)/(1+bp)
82.5=93.8*(13.4b)/(1+13.4b)
b=0.545kpa-1
(2)由兰格缪尔吸附等温式Γ=Γm*(bp)/(1+bp)
由上题已知b=0.545kpa-1
得Γ=93.8*(0.545*6.67)/(1+0.545*6.67)=73.6dm3/kg
第九章胶体分散系统
1.根据其形成的相态,分散系统可以分为均相系统和多相系统。
2.溶胶的制备方法分为分散法和凝聚法。
3.由于溶胶粒子的直径小于可见波长和光学不均匀性,所以,溶胶具有明显的丁达尔现象。
4.AgNO3溶液与过量的KI溶液形成AgI溶胶。
比较MgSO4、K3Fe(CN)6和AlCl3这三种物质的量浓度相等的电解质溶液对该溶胶的聚沉能力:
AlCl3>MgSO4>K3Fe(CN)6。
1.为什么说溶胶是热力学不稳定系统?
溶胶为什么能稳定存在?
溶胶是高度分散的多相系统,有很大的表面积和表面吉布斯能,具有自动聚沉而使分散相颗粒变大、表面吉布斯能减小的趋势,因此,溶胶是热力学不稳定系统。
由于布朗运动、胶粒带电和溶剂化作用都能阻碍溶胶聚沉,因此溶胶能稳定存在。
2.与分子分散系统和粗分散系统相比,溶胶具有丁达尔现象,为什么?
产生丁达尔现象的两个基本条件是:
一、粒子直径小于入射光的波长;
二、光学不均匀性,即分散相与分散介质的折光率不同。
溶胶正好满足这两个条件,因此具有丁达尔现象,而粗分散系统由于粒子太大不满足粒子大小的条件,小分子溶液由于是均相系统不满足光学不均匀性条件。
1:
x=[RTt/(3兀ηrL)]1/2
=[8.314*298*1/(3*3.14*2.1*10-9*1.0*10-3*6.023*1023)]1/2
=1.442*10-5m
第十章大分子溶液
1.大分子化合物的溶解特点是先溶胀后溶解。
2.用粘度法测得的大分子平均摩尔质量是粘均摩尔质量。
3.用光散射法测得的大分子平均摩尔质量是质均摩尔质量。
蛋白质的等电点是指蛋白质链上-NH3+基和-COO-基数目相等时的PH值
二、简答题
1.大分子化合物的平均摩尔质量通常有哪几种表示方法?
它们的相对大小关系如何?
大分子化合物的平均摩尔质量通常有4种表示方法:
数均摩尔质量、质均摩尔质量、
粘均摩尔质量和z均摩尔质量。
它们的相对大小关系:
数均摩尔质量<
粘均摩尔质
量<
质均摩尔质量<
z均摩尔质量。
2.大分子化合物的溶解有什么特点?
大分子化合物的溶解特点是溶解前有一个溶胀过程。
大分子化合物在溶剂中,首先
是溶剂分子向大分子内部扩散、渗透,使大分子体积逐渐胀大,此过程称为溶胀;
溶胀后的大分子链间作用力减弱,能在溶剂中自由运动并充分伸展,形成溶液。
3.什么是电粘效应?
如何消除电粘效应?
当大分子电解质溶液较稀时,电离度大,大分子链上电荷密度增大,链段间的斥力
增加,分子链舒张伸展,溶液粘度迅速上升,这种现象称为电粘效应。
消除方法:
加入足够量的小分子电解质。
4.什么是Donnan效应?
如何消除Donnan效应?
由于大分子离子的存在引起小分子离子在膜内外分布不均的现象称为唐南效应。
消