化学必修2知识点填空.doc
《化学必修2知识点填空.doc》由会员分享,可在线阅读,更多相关《化学必修2知识点填空.doc(12页珍藏版)》请在冰豆网上搜索。
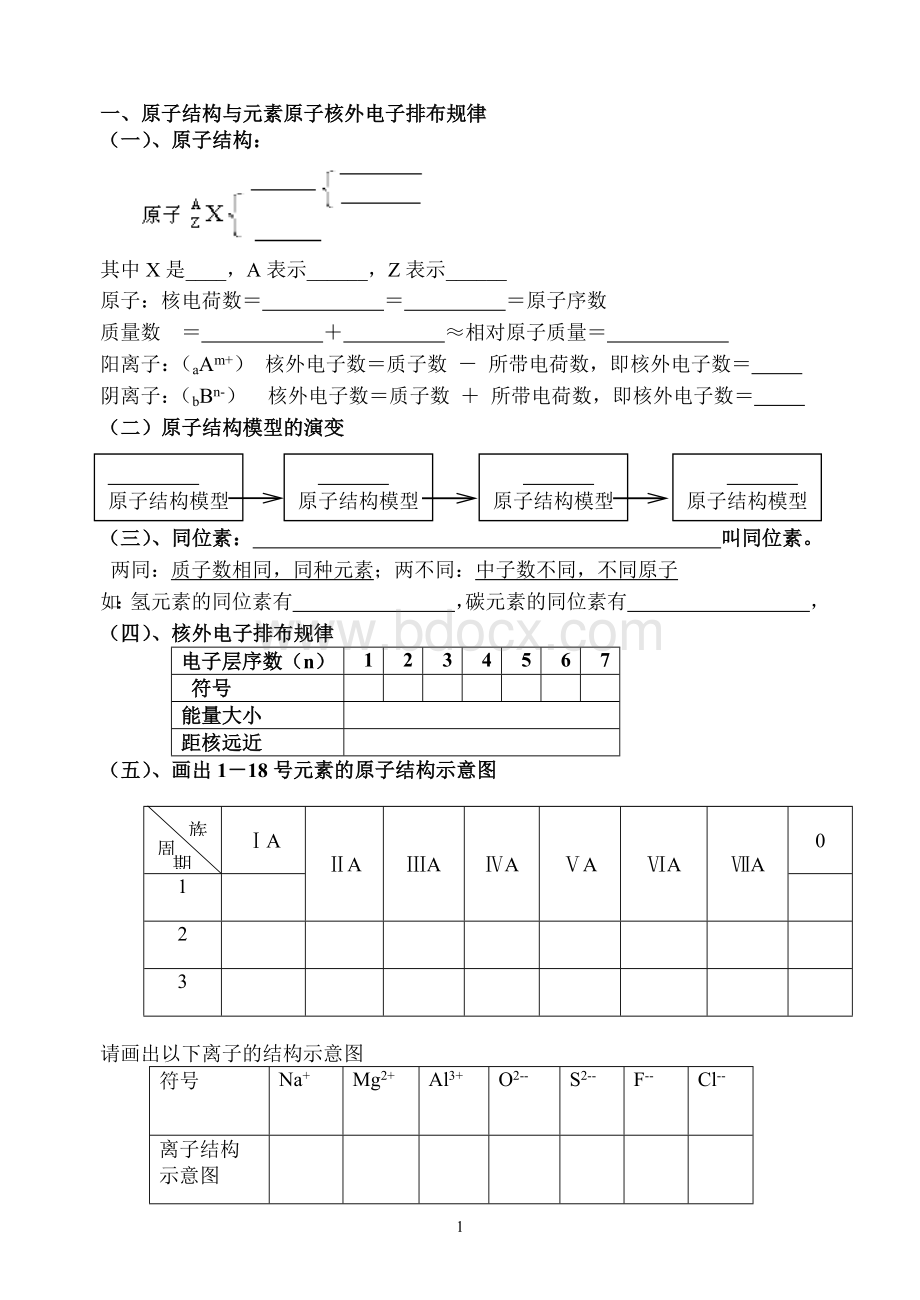
一、原子结构与元素原子核外电子排布规律
(一)、原子结构:
其中X是____,A表示______,Z表示______
原子:
核电荷数= = =原子序数
质量数 = + ≈相对原子质量=
阳离子:
(aAm+)核外电子数=质子数-所带电荷数,即核外电子数=
阴离子:
(bBn-)核外电子数=质子数+所带电荷数,即核外电子数=
(二)原子结构模型的演变
原子结构模型
原子结构模型
原子结构模型
原子结构模型
(三)、同位素:
叫同位素。
两同:
质子数相同,同种元素;两不同:
中子数不同,不同原子
如:
氢元素的同位素有 ,碳元素的同位素有 ,
(四)、核外电子排布规律
电子层序数(n)
1
2
3
4
5
6
7
符号
能量大小
距核远近
(五)、画出1-18号元素的原子结构示意图
族
周
期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
2
3
请画出以下离子的结构示意图
符号
Na+
Mg2+
Al3+
O2--
S2--
F--
Cl--
离子结构示意图
二、原子结构、元素周期律、元素周期表的关系
(一)、元素周期表编排原则、元素周期表的结构
周期系数= ;主族系数= =最高正价(O、F除外)
最高正价+|负价|=
现行元素周期表的编排原则与特点:
周期:
族 :
(二)、元素周期律:
元素的性质 的规律。
元素周期律是 随着元素核电荷数的递增发生周期性变化的必然结果。
(三)同周期与同主族的变化规律(稀有气体除外)
同周期(左到右)
同主族(上到下)
结构
核电荷数
电子层数
最外层电子数
原子半径
金属性:
元素原子失电子能力
①最高价氧化物对应水化物碱性
②金属单质与水或酸置换出H2
非金属性:
元素原子得电子能力
①最高价氧化物对应水化物的酸性
②气态氢化物的稳定性
第三周期:
原子半径由大到小的顺序为
金属单质与水或酸置换出氢由易到难的顺序为 >>
最高价氧化物的水化物碱性由强到弱的顺序为 >>
金属性:
>>
非金属单质与氢气反应由易到难的顺序为 >>>
气态氢化物的稳定性顺序为 >>>
最高价氧化物的水化物酸性由强到弱的顺序为 >>>
非金属性:
>>>
(四)元素周期表和元素周期律对我们的指导作用
①在周期表中寻找新的农药。
②在周期表中寻找半导体材料。
③在周期表中寻找催化剂和耐高温、耐腐蚀的合金材料。
一.离子键
1.离子键:
静电作用(包含吸引和排斥)
离子键只存在离子化合物中,离子化合物中一定含有离子键。
离子化合物:
(1)活泼金属与活泼非金属形成的化合物。
如NaCl、Na2O、K2S等
(2)强碱:
如NaOH、KOH、Ba(OH)2、Ca(OH)2等
(3)大多数盐:
如Na2CO3、BaSO4
(4)铵盐:
如NH4Cl
小结:
一般含金属元素的物质(化合物)+铵盐。
(一般规律)
二.共价键
1.共价键:
原子间通过共用电子对所形成的相互作用叫做共价键。
键
项型
目
离子键
共价键
形成过程
得失电子
形成共用电子对
成键粒子
阴、阳离子
原子
实质
阴、阳离子间的静电作用
原子间通过共用电子对所形成的相互作用
2.共价化合物:
只含有共价键的化合物叫做共价化合物。
3.分子间作用力:
定义
分子间作用力仅存在于由 构成的物质,它的作用力比化学键 (“强”或“弱”),分子间作用力是影响物质的和 重要因素之一。
4、氢键:
一种特殊的分子间作用力。
分子间氢键的形成使水的熔沸点升高,体积增大,密度减小。
能用电子式、结构式、结构简式表示常见微粒或物质
元素(原子)符号
Na
Mg
Al
O
S
F
Cl
原子电子式
离子符号
离子电子式
用电子式来表示以离子键结合的物质,
NaCl MgO Na2O K2S
MgCl2 CaCl2 NaOH NH4Cl
用电子式、结构式来表示以共价键相结合的物质
H2 N2 HCl
H2O NH3 CH4
CO2 CCl4 HClO
一、化学反应速率与化学平衡
1.化学反应速率:
(1)概念:
。
(2)表示方法:
。
(3)单位:
。
(4)注意点
a现表示的化学反应速率是平均速率,同一反应用不同物质表示的化学反应
速率数值可能不同,必须注明物质。
b起始浓度不一定按比例,但是转化浓度一定按比例。
c同一反应各物质的反应速率之比等于化学计量数之比。
(变化量比=方程式系数比)
2.化学反应限度:
大多数化学反应都具有 ,故可逆反应都有一定的限度;可逆反应的限度以到达 为止。
对于,在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,反应达到化学平衡状态
反应开始:
υ(正)>υ(逆)
反应过程中:
υ(正)逐渐减小,υ(逆)逐渐增大;
反应物浓度减小,生成物浓度增大
平衡时:
υ(正)=υ(逆);
各组分的浓度不再发生变化
化学平衡状态的特征:
逆、动、等、定、变。
举例:
电离平衡:
在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态。
二.化学反应中的热量(在任何的化学反应中总伴有能量的变化)
1、吸热反应和放热反应
旧化学键断裂需要能量,形成化学键要能量(化学反应的实质)。
2、吸热反应与放热反应的判断
放热反应
吸热反应
△E
反应物总能量生成物的总能量
反应物总能量生成物的总能量
热效应
△H<0
△H>0
图示
实例
H2(g)+Cl2(g)==2HCl(g)
△H=-184.6kJ·mol-1
2HCl(g)===H2(g)+Cl2(g)
△H=+184.6kJ·mol-1
①所有的燃烧与缓慢氧化。
②②酸碱中和反应。
③金属与酸(水)反应生成氢气。
④大多数化合反应
①以C、H2、CO为还原剂的氧化还原反应如:
C(s)+H2O(g)CO(g)+H2(g)。
②铵盐和碱的反应如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O
③大多数分解反应如KClO3、KMnO4、CaCO3的分解等。
三.化学能与电能的转化
(一)原电池:
原理:
氧化还原反应。
1、定义:
转化为的装置。
2、电极反应总反应:
Zn+2H+=Zn2++H2↑
负极():
(氧化反应)
正极():
(还原反应)
电子从极(锌)经导线流向极(铜);电流从极流向极;
电解质溶液中的阴离子移向极(锌,锌失电子,带正电,吸引阴离子),
阳离子移向极(铜,电子转移到铜,铜带负电,吸引阳离子)。
3、形成原电池的条件
(1)具有活泼性不同的两个。
活泼的金属作(失电子),较不活泼的金属或非金属导体做(电子转移到正极,溶液中的阳离子或氧化性强的物质得电子)。
(2)具有溶液。
(3)形成。
(4)能发生自发的。
4、电化学腐蚀:
钢铁在潮湿空气里腐蚀 负极:
Fe-2e-=Fe2+
正极:
2H2O+O2+4e-=4OH-
总反应:
2H2O+O2+Fe=2Fe(OH)2
进一步发生反应:
2H2O+O2+4Fe(OH)2=4Fe(OH)3
(二)电解池:
1、定义:
转化为的装置。
2、电极反应:
电解CuCl2溶液:
总反应:
CuCl2电解Cu+Cl2↑
阳极:
与电源极相连(氧化反应)
阴极:
与电源极相连(还原反应)
3、电解池的形成条件:
(1)必须有外接;
(2);(3)溶液或熔融的电解质;(4)形成;(5)有不能自发进行的氧化还原反应。
4、工作原理:
电子从阳极经导线流向阴极;电流从正极经外电路流向负极;电解质溶液中的阴离子移向极(阳极失电子,带正电,吸引阴离子),阳离子移向极(电子转移到阴极,阴极带负电,吸引阳离子)。
电解反应是电流作用下发生的氧化还原反应,是不能自发进行的氧化还原反应。
一、天然气的利用甲烷
(一)、甲烷的元素组成与分子结构
分子式__结构式_____电子式_____结构简式空间构型__________
(二)、甲烷的物理性质
(三)、甲烷的化学性