我国透明质酸行业研究Word文件下载.docx
《我国透明质酸行业研究Word文件下载.docx》由会员分享,可在线阅读,更多相关《我国透明质酸行业研究Word文件下载.docx(15页珍藏版)》请在冰豆网上搜索。
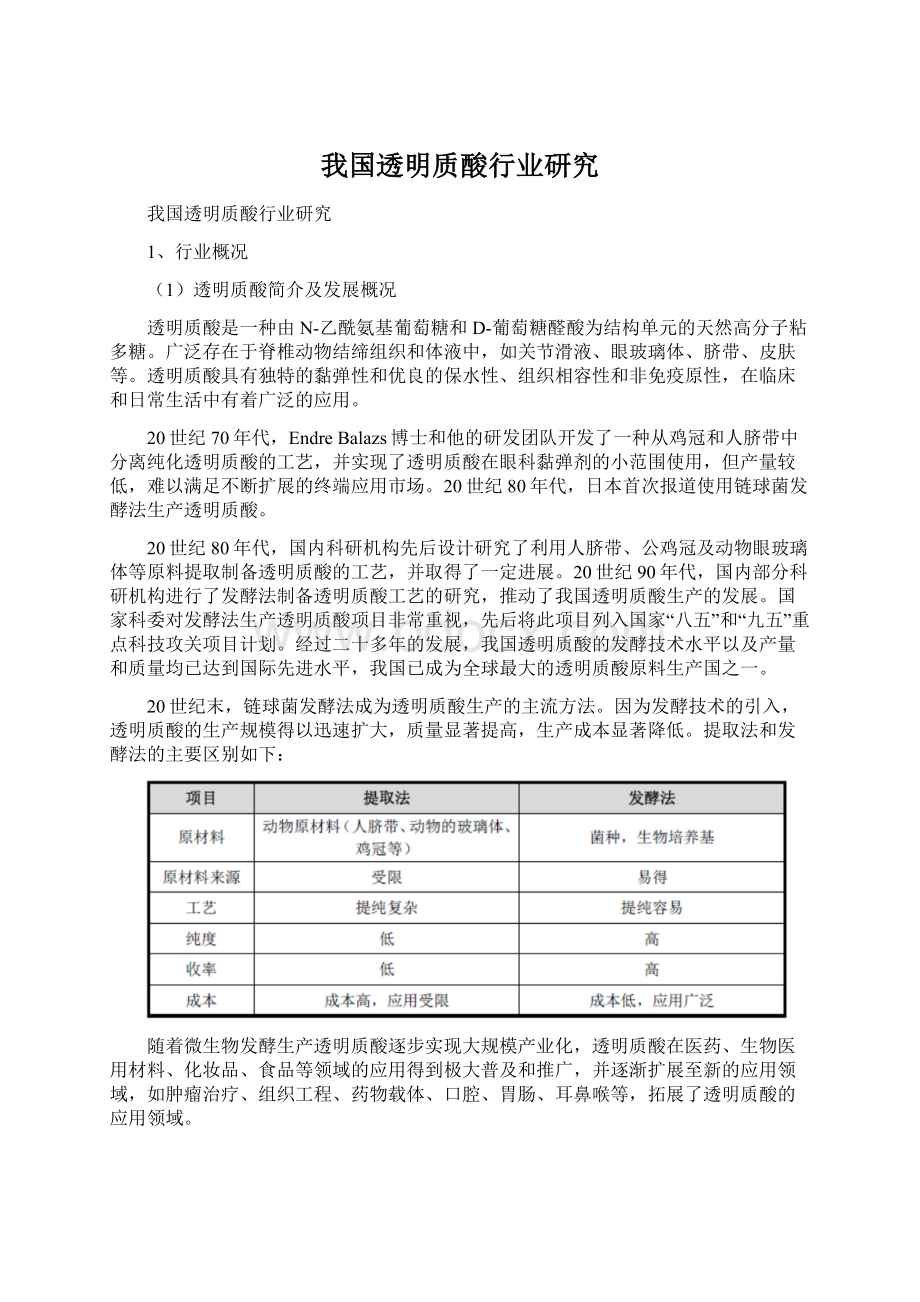
2018年,食品级、化妆品级和医药级透明质酸原料的销量分别达到230吨、250吨和20吨,2014-2018年复合增长率分别为29.4%、18.0%和22.1%,预计2023年销量可分别增长至654.3吨、454.5吨和41.2吨。
资料来源:
Frost&
Sullivan
(2)透明质酸的应用
①透明质酸在医药和临床诊治中的应用
透明质酸在医药和临床诊治中的主要应用包括:
黏弹性手术、黏弹性补充疗法、黏弹性填充、黏弹性阻隔和黏弹性防护。
另外,透明质酸在药物传递和组织工程等方面也有应用。
A.黏弹性手术(Viscosurgery)
透明质酸应用于眼科手术时,可起到支撑前房、保护眼部组织、维持手术操作空间的作用。
另外,透明质酸也应用于关节内窥镜手术、耳外科手术和内窥镜下黏膜切除术等。
具体应用领域包括:
B.黏弹性补充疗法(Viscosupplementation)
黏弹性补充疗法是指在病理状态下用透明质酸溶液来补充或替代关节滑液,减轻疼痛并促进关节内损伤的愈合。
黏弹性补充疗法可通过恢复关节滑液的黏弹性、减少摩擦、提高关节活动性来改善病变关节的生理环境。
C.黏弹性填充(Viscoaugmentation)
黏弹性填充是用透明质酸凝胶来填充并扩张皮肤、括约肌、声带和咽部结缔组织等,以改善填充部位的缺陷。
D.黏弹性阻隔(Viscoseparation)
黏弹性阻隔是指用透明质酸将相邻组织隔离以防止术后粘连的发生,减少疤痕的形成。
E.黏弹性防护(Viscoprotection)
黏弹性防护是指用透明质酸溶液来保护组织表面,使其免受脱水和有害物质的损伤,并促进表面创伤的愈合。
F.药物载体(DrugDelivery)
由于透明质酸具有高黏附性和安全性,使其作为肠道及非肠道给药的药物载体应用受到更多关注。
透明质酸材料作为药物载体时,可以是微粒或凝胶形式,由透明质酸、透明质酸衍生物或透明质酸与其它高聚物的结合物制成。
透明质酸可作用于在肿瘤细胞中过度表达的CD44受体,因此,也可作为治疗肿瘤的靶向药物载体。
此外,含透明质酸的药物通过皮下注射用于非肠道系统时还表现出缓释特性。
G.透明质酸的其它潜在应用
②透明质酸在化妆品中的应用
透明质酸的保水作用是其最重要的生理功能之一,其理论保水值高达500ml/g以上。
与其他常用保湿剂相比,透明质酸受环境湿度影响较小,在低相对湿度(33%)下的吸湿量高,在高相对湿度(75%)下吸湿量低。
这种独特的性质,适应了皮肤在不同季节、不同湿度环境下的保湿要求,因此称为理想的智能保湿剂。
透明质酸不但具有极高的保水性能,而且具备皮肤屏障的特性。
透明质酸可同时减少紫外线透射,并通过促进表皮细胞增殖分化和清除氧自由基,修护紫外线所致的皮肤损伤,达到双重保护。
皮肤轻度烧伤时,表面涂抹含透明质酸水剂化妆品可减轻疼痛,加速受伤部位愈合。
随着透明质酸的产业化和技术发展,拥有不同物理与生物特性的透明质酸和透明质酸衍生物推向护肤与彩妆市场,如超低分子透明质酸钠(<10kDa)、透明质酸钠交联聚合物、乙酰化透明质酸钠(AcHA)、油分散透明质酸钠、透明质酸钠络合物等,被广泛应用于护肤精华、口红、水乳膏霜、面膜、喷雾等。
③透明质酸在食品中的应用
20世纪末,日本市场首次推出口服透明质酸护肤保健食品,充分肯定了其食用安全性。
近年,透明质酸已广泛应用于各种食品及饮料。
研究显示,口服透明质酸具有补水、改善关节功能和骨质疏松、修复胃黏膜损伤、促进创伤愈合、改善心血管系统、改善软骨病症状、提高人体免疫力、促血管生成等功效。
2008年5月,国家卫生部按照《新资源食品管理办法》的规定发布相关公告,批准透明质酸钠作为新资源食品用作保健食品原料,仅能用于保健食品。
我国已上市的含透明质酸钠的保健食品有二十余种,申报功能大多为改善皮肤水分和增加骨密度。
美国、英国、加拿大、捷克、日本、中国台湾等国家和地区也有多款含透明质酸的保健食品上市,透明质酸作为食品原料已在多个国家或地区得到认可。
2、透明质酸应用领域的发展概况
(1)医疗健康行业发展概况
随着近年来新兴国家经济快速增长,以及发达国家及部分发展中国家人口老龄化规模持续扩大,全球医疗健康市场规模得以稳步增加。
Sullivan的分析,2017年度全球医疗健康行业市场的总销售规模约为1.77万亿美元。
①医药和医疗器械行业发展概况
A.医药行业发展概况
2017年全球制药和生物技术行业的销售规模约为1.20万亿美元。
从市场结构来看,美欧日等发达国家市场仍居全球药品消费主导地位,但市场增速将放缓。
而新兴市场如亚洲等,受益于当地较高的经济增速、人口数量的增长、政府投入的增加、发达国家原研药物专利到期等有利因素,有望迎来良好发展机遇、保持较高增速。
中国医药工业中心《中国健康产业蓝皮书2017版》
中国医药市场是医药健康产业的重要组成部分,根据中国医药工业中心发布的《中国健康产业蓝皮书2017版》,2016年,中国医药市场规模约14,436亿元,较上年同比增长8.1%,未来将保持稳健的增长趋势。
B.医疗器械行业发展概况
医疗器械是指直接或间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料及其他相关物品。
2017年全球医疗器械行业的销售规模约为4,650亿美元。
以中国为代表的新兴市场是全球最具潜力的医疗器械市场,产品普及需求与升级换代需求并存,增长速度较快。
我国医疗器械市场近年来增长率均保持在20%左右,2017年行业市场规模达到4,450亿元。
我国是人口大国,医疗器械行业属于国家重点支持的战略新兴产业,随着人口老龄化的到来和经济的快速发展,行业发展前景十分广阔。
中国医药物资协会
②生物医用材料行业的发展概况
生物医用材料是医疗器械的重要组成部分,是一类用于诊断、治疗、修复和替代人体组织、器官或增进其功能的新型高技术材料。
2017年,全球生物医用材料市场规模近2,000亿美元,其中,中国生物医用材料市场规模超过2,000亿元,同比增速近20%,增长十分迅速。
透明质酸因其良好的保水性、润滑性、黏弹性、生物降解性及生物相容性,被广泛应用于骨科、眼科、软组织填充等领域的各类生物医用材料中,受益于旺盛的终端需求增长,市场规模不断扩大。
A.骨科应用概况
世界卫生组织统计数据显示,全球关节炎患者达3.55亿人;
在中国,现有骨关节炎患者超过1.2亿。
年龄与骨科类疾病发病率呈正相关,根据卫计委发布的《2018中国卫生健康统计年鉴》,45岁以上人口骨科类疾病发病率明显较高。
卫计委《2018中国卫生健康统计年鉴》
目前我国治疗关节炎的常用注射类药物有四类:
非甾体类抗炎药、镇痛药物、糖皮质激素和其他关节腔注射药物(玻璃酸钠注射液为骨科关节腔注射用液)。
其中市场份额最高的是其他关节腔注射药物,其次为糖皮质激素。
Sullivan的分析,2018年中国骨关节炎注射类药物市场规模约98亿元,其中医药级透明质酸骨科终端产品的市场规模约为15.7亿元。
玻璃酸钠注射液作为关节补充滑液,可保护病损软骨,且具备良好的生物相容性,不良反应较少,其市场有望保持增长。
B.眼科应用概况
在眼科领域,以高纯度透明质酸钠制作的黏弹剂作为手术垫主要应用于白内障手术,起到临时支撑手术空间,避免眼组织受到手术器械的机械损伤。
白内障是全球首位致盲性眼病。
我国60岁以上的老年人白内障发病率达80%以上,手术是治疗白内障的唯一方式。
根据中国防盲治盲网数据,以2017年我国每百万人白内障手术率(CSR)为2205人推算,我国2017年白内障手术量在300万人次以上,并仍保持每年10%左右的市场增长,市场潜力较大。
此外,在干眼症市场,我国30-40岁人群患病率超过20%,并随年龄增长呈上升趋势,作为干眼症治疗一线用药,人工泪液是透明质酸的另一高潜力应用市场。
2018年中国医药级透明质酸眼科终端产品的市场规模约为16.1亿元。
C.软组织填充应用概况
近10年来,交联透明质酸材料一直是应用最多的软组织填充剂,由于其出色的生物相容性和填充效果,交联透明质酸凝胶正逐步取代胶原蛋白等其它填充剂,成为当前主流的填充材料。
以透明质酸为填充剂材料的注射类项目一直受到市场的高度认可,根据全球美学整形外科学会(ISAPS)的资料,2017年全球共进行整形注射类治疗项目857.22万例,其中透明质酸注射项目329.83万次,占整体注射类项目比例达38.48%。
ISAPS
(2)护肤品行业发展概况
护肤品为我国化妆品市场第一大品类,包括面部护理、护理套装、手部护理和身体护理四大品类,2017年我国护肤品市场容量为1,866.55亿元,占化妆品总体市场规模50.1%。
伴随着居民可支配收入的增长,消费者需求的逐步升级,国内个人化妆品消费的品类将持续扩充,产品由低档向中高端升级,中高端化妆品市场有望长期繁荣并保持高于大众市场的增长率。
Euromonitor
护肤品作为化妆品市场中的第一大品类,中高端及大众护肤品市场规模复合增速亦展现出前述差异特征。
近年来,消费者愈发重视产品效果,追求通过特定成分针对性地解决肌肤问题,具有从成分、功效等辨别产品的能力,有助于具有核心成分、功效明确的中高端功能性护肤品的市场推广。
2012~2017年中高端护肤品市场复合增速高于同期大众定位的相同品类市场规模复合增速。
3、行业技术
(1)透明质酸的制备技术
现有的透明质酸制备方法主要有提取法和发酵法两种。
①提取法制备透明质酸
从动物组织中提取透明质酸常用原料有鸡冠、脐带、猪皮、动物眼球玻璃体等,主要工艺包括脱水、磨碎、浸泡、提取、除杂、沉淀和分离。
其中纯化可以用乙醇或季铵盐反复沉淀,也可采用酶解、超滤、离子交换等技术除去杂质和蛋白。
因提取法原料来源有限,产品质量较差,生产成本高,基本上已被微生物发酵法所替代。
②发酵法制备透明质酸
链球菌发酵法生产透明质酸始于上世纪八十年代,透明质酸已被收录至欧洲药典。
发酵培养基包括蛋白胨、酵母粉、葡萄糖等。
当发酵结束时,首先进行微生物灭活,然后用有机溶剂沉淀,得到透明质酸粗品。
该粗品溶于盐水中,并进一步纯化,得到纯化后的透明质酸溶液,最后用有机溶剂沉淀并干燥或直接喷雾干燥即得透明质酸成品。
(2)透明质酸的分子量控制技术
对于商业化透明质酸产品,分子量是一个重要的质量参数。
不同透明质酸终端产品对透明质酸的分子量都有严格且差异化的要求。
①高分子量透明质酸制备技术
制备高分子量透明质酸的技术要点包括:
发酵阶段产生高分子量的透明质酸,其技术难点在于菌株选用、培养基选择以及生产工艺参数的设定;
在分离提纯阶段需尽可能降低对分子量的破坏,其技术难点在于工艺的选择、过程参数的控制等。
②低分子量透明质酸制备技术
降解是利用高分子量透明质酸制备低分子量透明质酸的常用技术。
透明质酸降解方法主要有物理降解、化学降解和生物降解三大类。
物理降解法很难将透明质酸降至10kDa以下;
化学降解法和酶切法可以制备寡聚透明质酸,但化学降解制备的寡聚透明质酸需要较剧烈的反应条件,对制得的寡聚透明质酸化学结构有一定破坏、生物活性降低,且生产过程会对环境有所污染;
酶解法降解透明质酸不会破坏其化学结构,且反应条件温和,不会造成环境污染,最适合制备寡聚透明质酸。
(3)透明质酸的修饰技术
非修饰透明质酸进入人体后会受到透明质酸酶的酶解作用而迅速降解代谢,人体皮肤、眼部、关节存留时间约在1至21天不等。
对于作为黏弹性补充疗法或黏弹性填充疗法等应用的透明质酸,需要修饰透明质酸结构,使得透明质酸分子更加稳定,从而减缓其体内降解速度,延长作用时间。
目前对透明质酸的结构修饰主要采用交联法。
交联是通过化学共轭反应,将透明质酸大分子中的一些官能团与某种化学物质连接得到具有三维立体构象的高分子凝胶,经过交联后的透明质酸拥有致密网状结构。
常规交联方法是将透明质酸与交联剂在水溶液中搅拌混合,通过交联剂使透明质酸高分子链间化学键合来制备。
4、行业发展的机遇和挑战
(1)行业发展机遇
①国家产业政策的有力支持
生物医药是“十三五”国家战略性新兴产业发展规划中大力推动发展的行业,国务院及有关政府部门先后颁布了《“十三五”国家战略性新兴产业发展规划》、《战略性新兴产业重点产品和服务指导目录》(2016版)、《“十三五”卫生与健康科技创新专项规划》等一系列政策,明确了生物医药的发展方向,推动了透明质酸原料和医疗器械终端产业的发展。
具体产业政策内容请参见本节“
(二)行业管理情况/3、行业主要法律法规和产业政策”。
②老龄化及老年性疾病发生率提升,带动医疗终端产品需求
根据世界卫生组织(WHO)发布的2018年版《WorldHealthStatistics》,中国人均预期寿命持续提高,从1982年的67.8岁提升至2018年的76.4岁。
60岁以上人群是老年性疾病及慢性疾病的高发人群,从我国人口结构变化趋势看,60岁以上人口所占比重越来越大,2017年我国60岁及以上人口24,090万人,占总人口的17.3%,其中65周岁及以上人口15,831万人,占总人口的11.4%。
随着我国老龄化进程的加快,眼科、骨科等和患者年龄相关性较强的医疗市场规模将会持续增长。
透明质酸广泛应用于眼科、骨科等医疗领域,相关医疗类终端产品的需求将持续增长。
③可支配收入增长,带动消费者对于健康品质生活追求的持续提升
城乡居民生活水平不断提高和居民可支配收入稳步上升是带动行业发展的根本原因。
根据国家统计局统计,2017年我国城镇居民人均可支配收入为36,396元,较上年度同期增长8.3%;
2017年全国居民人均消费支出24,445元,较上年度同期增长5.9%。
部分经济发达地区如沿海城市已进入较高的消费层次,特别是以人均GDP超过5,000美元为标志的中产阶级正在形成和扩大。
随着城乡居民购买力水平的提高,居民消费结构及需求层次随之发生变化,消费者对自身健康的需求日益关注,在医疗管理、健康等方面的消费支出逐步增加,有利于透明质酸在生物医用材料、保健食品等应用规模的增长。
④技术进步,推动透明质酸应用领域不断扩大
透明质酸钠作为新的生物材料,应用范围越来越广泛,已在眼科、骨科、整形外科、皮肤科、普外科等领域取得了非常广泛的应用,其研究工作的发展也突飞猛进。
随着对透明质酸研究的不断深入,越来越多透明质酸的特性及功效被发现,例如透明质酸及其衍生物在软骨和骨组织工程、椎间盘的再生和骨肉瘤的治疗中有很大的应用潜力、在皮肤科药用基质方面也存在一定应用前景。
未来透明质酸将在医疗、功能性护肤品和食品等领域得到更加广泛的应用,基于其作用与功效会有更多功能定位的新产品问世,进一步带动透明质酸产业链的增长与发展。
(2)行业发展挑战
①中国产品的品牌影响力有待提升
全球透明质酸原料供应市场中,多数中国企业提供的透明质酸原料相对附加值较低,食品级、外用级产品占比较高。
随着产品质量提升,中国透明质酸生产企业逐渐取得了一定的市场认可度与知名度,未来会生产并提供更多高质量、高等级、高附加价值的原料产品,与更多全球高端品牌客户建立商业合作。
医疗产品、护肤品等终端市场中,境外国际品牌依托跨国大型企业背书,通过多年消费者教育和消费习惯培养,取得了较高的品牌认可度,一定程度上限制了国内企业品牌的发展。
近年来,国内企业逐步重视产品质量,通过加大研发投入、培育行业人才、规范管理生产等手段,提高产品品质,在透明质酸终端产品领域扭转了消费者对中国制造不够信任的印象,加强了产品的国际竞争力。
但国内企业终端产品的定价及品牌影响力、消费者认可度仍需进一步提升。
②行业监管政策发生变动
A.CFDA进一步加强对透明质酸类产品的监管
CFDA对我国医疗器械实行分类管理,根据风险程度依次递增分为第一类、第二类、第三类。
第一类医疗器械实行备案管理,第二类、第三类医疗器械实行产品注册管理;
目前已批准的含透明质酸的医疗器械产品含全部分类。
考虑医疗器械的预期目的、结构特征和使用方法等因素,CFDA为提高监管要求,2018年8月实施新版《医疗器械分类目录》,将会进一步加强对透明质酸类产品的监管。
新版《医疗器械分类目录》细化了医疗器械产品具体的管理类别,进一步规范了透明质酸类产品的分类及管理,提高了透明质酸类产品的注册门槛,对透明质酸类产品的生产企业提出了更高的要求。
根据新版《医疗器械分类目录》,目前公司透明质酸终端产品的分类未发生变化,新版《医疗器械分类目录》不会对公司目前的生产经营造成影响。
对于新开发透明质酸类产品,公司将严格按照新版《医疗器械分类目录》的要求进行研发和注册。
B.欧盟医疗器材法规(MDR)将生效实施
2017年3月,医疗器材法规(MedicalDevicesRegulation,MDR;
Regulation(EU)2017/745)获得欧盟成员国一致通过,于2017年5月25日正式生效并设置3年过渡期。
MDR将取代医疗器材指令(MDD)和主动植入式医疗器材指令(AIMD),将原先医疗器材指令整合、升级成法规,并于2020年生效。
新法规大幅提升有关医材认证的规范与限制,增加医材追溯性、临床试验规范严谨度、临床证据的掌握度,增加上市后的产品安全性与效能监督。
MDR施行后,生物医用材料新品需严格按照新规进行认证;
此前依照MDD及AIMD指令取得的认证证书将于2024年失效,因此已获得认证的产品后续仍需重新申请CE认证,且必须开始收集自身产品于PMCF(上市后临床跟踪指南)的临床监督证据。
MDR对生物医用材料的产品质量要求显著提高,产品制造商需要对其销往欧盟市场的产品进行全面审查,以确定与MDR新规在分类、技术文档、标签和一般安全和性能要求(包括支持临床证据)等方面的合规差距,并采取应对措施以确保产品CE认证的有效性。
欧盟医疗器械新法规MDR将于2020年5月实施,但在此日期之前取得的CE证书在其有效期内仍然有效,此前依照医疗器材指令(MDD)和主动植入式医疗器材指令(AIMD)取得的认证证书将于2024年失效。
公司眼科粘弹剂产品及软组织填充凝胶BioHyalux的CE证书有效期至2022年1月,骨关节注射液产品以及软组织填充凝胶BioHyaluxFineLines、BioHyaluxDeepDermis、BioHyaluxLIPS的CE证书有效期至2023年11月,因此公司上述产品在CE证书有效期到期前,在欧盟成员国的销售不会受到影响。
欧盟医疗器械新法规MDR已发布,目前公司已经开展按照MDR重新申请CE认证的准备工作,并与数家有望取得MDR审核资格的公告机构进行了沟通,待其取得MDR审核资格后正式启动认证工作。
欧盟此前执行的医疗器材指令(MDD)已经对部分类型的产品提出了上市后临床跟踪(PMCF)的要求。
公司已根据MDD的要求制定了PMCF内部控制计划,并按照计划组织实施,通过检索文献、收集市场反馈信息、调研本公司产品及相似产品的使用情况等多种方式获得相关信息,每年形成一份PMCF因此公司自身产品已收集了较为完备的PMCF临床监督证据。
C.国家启动新一轮医保目录调整工作
2019年4月17日,国家医疗保障局公布了《2019年国家医保药品目录调整工作方案》(以下简称《调整方案》),根据《调整方案》及国家医疗保障局发布的政策解读,《医保药品目录》西药部分采用药品通用名进行表述,不涉及具体企业,同一通用名(含剂型)下,无论是哪个规格、哪个企业生产的品种,均纳入报销范围。
本次目录调整,仍坚持按通用名管理,不针对具体企业,因此本次医保目录调整工作不会对公司及行业其他企业的玻璃酸钠注射液类产品销售及价格带来重大影响。
公司其他医疗器械类终端产品未纳入现行《医保药品目录》,本次《调整方案》及国家医疗保障局政策解读未提及将医疗器械类产品纳入《医保药品目录》的计划,故本次医保目录调整工作也不会对公司及行业其他企业的医疗器械类产品销售及价格带来重大影响。
D.原材料与制剂共同审评审批的政策变化影响
对于在国家药品监督管理局药品审评中心(CDE)登记备案的原料药、药用辅料和药包材,其通过与制剂共同审评审批后即可进入“已激活”状态。
新药及仿制药研发需要投入大量的时间和成本,产品审评进度延误或被否会对制剂企业造成经济损失。
关联审批实施后,药品原辅料的工艺质量研究水平和资料完善程度影响制剂的审评进度,因而制剂企业在新药及仿制药研发过程中,会主动对所涉及的原辅料及其生产企业开展充分的风险评估。
为避免因原辅料问题造成的审批不确定性,制剂研发企业通常更倾向于选用“已激活”状态的原辅料或此前已取得注册号的原辅料进行关联审批。
未来如同类型的原料药/药用辅料企业通过关联审批并进入“已激活”状态,并随着上述企业数量的增加,可能会对医药级原料的销售业务造成不利影响。
5、行业主要企业
(1)境外企业
(2)境内企业