初三化学上册课本实验内容专题复习Word文档格式.docx
《初三化学上册课本实验内容专题复习Word文档格式.docx》由会员分享,可在线阅读,更多相关《初三化学上册课本实验内容专题复习Word文档格式.docx(17页珍藏版)》请在冰豆网上搜索。
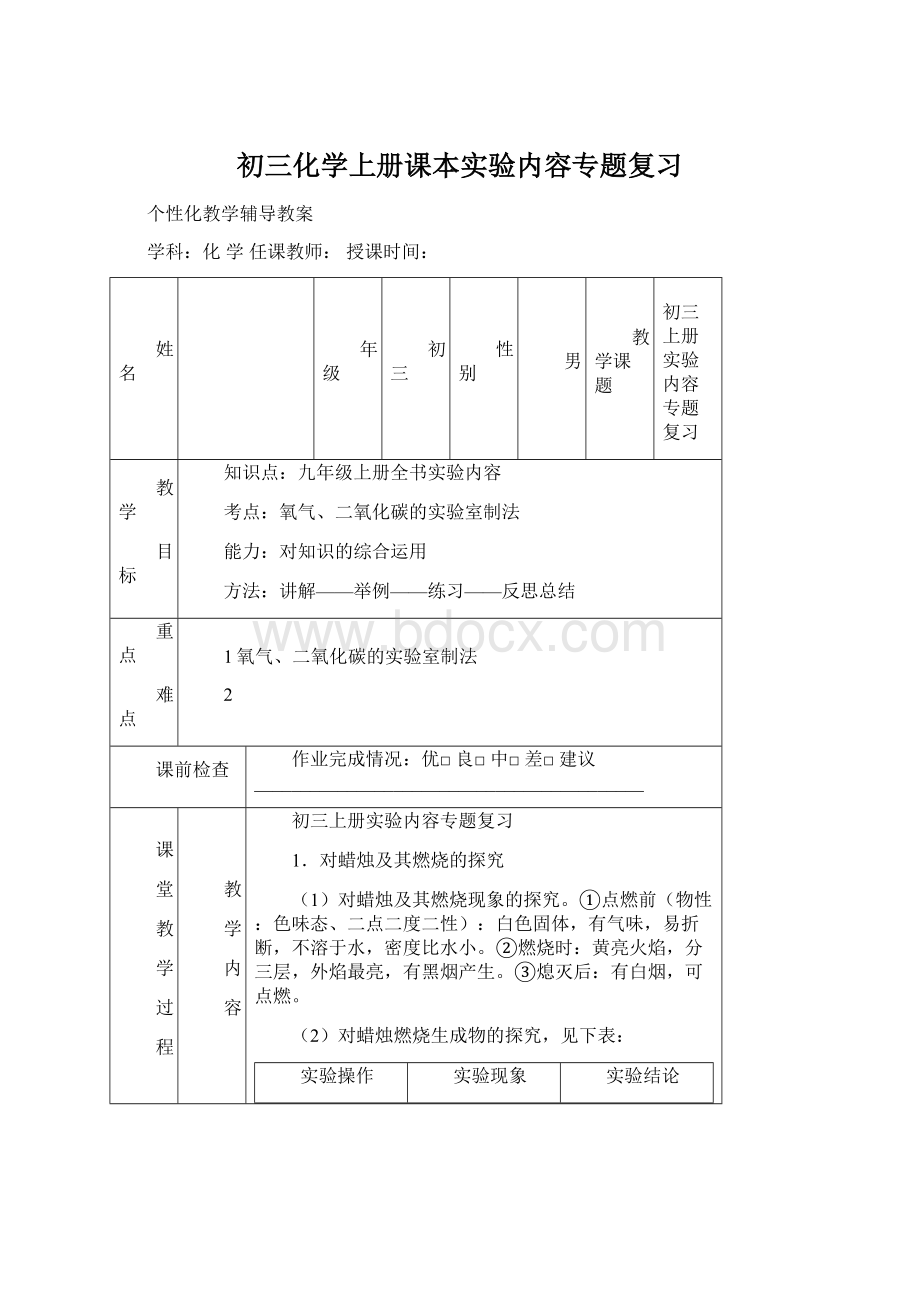
黄亮火焰,分三层,外焰最亮,有黑烟产生。
③熄灭后:
有白烟,可点燃。
(2)对蜡烛燃烧生成物的探究,见下表:
实验操作
实验现象
实验结论
在蜡烛火焰的上方罩一个冷而干燥的烧杯
烧杯内壁有无色液体生成
蜡烛燃烧有水生成
将上述烧杯取下来正放,迅速往烧杯中倒入少量澄清石灰水,振荡
澄清石灰水变浑浊
蜡烛燃烧有二氧化碳生成
【例1】.某同学对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究。
请填写下列空格。
(1)取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛浮在水面上。
结论:
石蜡的
密度比水。
(2)点燃蜡烛,观察到蜡烛火焰分为外焰、内焰、焰心三层。
把一根火柴梗放在蜡烛的火
焰中(如右图)约1s后取出可以看到火柴梗的处最先碳化。
蜡烛火焰的层温度最高。
(3)再将一只干燥的烧杯罩在蜡烛火焰上方,烧杯内壁出现水雾。
取下烧杯,迅速向烧杯
内倒入少量澄清的石灰水,振荡,澄清石灰水变浑浊。
石蜡中一定含、
元素。
2.对人体吸入的空气和呼出的气体的探究
三个结论:
(1)二氧化碳可以使澄清石灰水变。
白色浑浊越多,说明气体中二氧化碳。
(2)氧气可使带火星的木条,木条燃烧,说明氧气。
(3)二氧化碳可以使燃着的木条。
实验方法和目的:
向盛有空气和呼出气体的集气瓶中分别滴入数滴澄清石灰水,振荡,均变浑浊,但后者白色浑浊更明显,说明呼出的气体中二氧化碳含量比空气中的更多。
向盛有空气和呼出气体的集气瓶中分别放入燃着的木条,进行比较,燃着的木条在空气中燃烧更旺,燃烧的时间更长,说明呼出的气体中氧气含量比空气中的少。
对一块干燥的玻璃片呼气后,与另一块放在空气中的干燥玻璃片相比较,被呼气的玻璃片上有一层水雾,而空气中的没有,说明呼出的气体中含有较多的水蒸气。
通入人呼出的气体十五秒通入空气十五秒
现象:
变浑浊无明显变化
【例2】:
小明用如图装置进行“人体呼出的气体中的CO2是否比
吸入的空气中的CO2含量多”的探究实验。
实验操作及观察到的
现象如图所示:
(1)根据实验现象,小明得出的结论是。
(2)小明想进一步了解人体呼出和吸入的气体中的CO2含量变化的
原因,通过查阅资料,知道这是由于在人体内的肺泡与血液、血液与组织细胞之间发生了交换。
3、科学探究的一般步骤:
提出问题→猜想与假设→设计实验→实验验证→记录现象与得出结论→反思与评价。
关键:
(提出实验目的)→(实验过程)→(达到实验目的)
【例3】市场上销售的碳酸饮料中,溶有大量的二氧化碳气体。
请你设计实验方案验证打开瓶盖时冒出的气泡中含有二氧化碳。
将实验设计及相关内容填入下表中。
实验过程
【例4】:
小英在做饭时,发现很多因素都能影响食盐在水中溶解的速率。
(1)从你能想到的可能影响食盐在水中溶解的速率的因素中,写出一项,并预测此因素对食盐溶解速率的影响。
因素①____________________,影响_____________________________________;
因素② ,影响 。
(2)从你列出因素中选出一个,通过实验验证你的推测。
你设计的实验方案是?
【例1答案】
(1)小
(2)a外焰(3)碳、氢
【例2答案】:
(1)人体呼出的气体中的CO2比吸入的空气中的CO2含量多
(2)气体
【例3答案】
打开汽水瓶盖,塞上带导管的橡皮塞,导管另一端伸入一支装有澄清石灰水的试管中
冒出的气泡中含有二氧化碳
例4、
(1)(开放性试题,合理即可)①温度;
温度升高(或温度降低)食盐溶解速率加快(或减慢)②晶体颗粒大小;
食盐颗粒越小,溶解速率越快③搅拌;
搅拌能加快食盐的溶解
(2)搅拌影响因素;
在两个烧杯中各放入50mL温度相同的水,分别称取2g颗粒大小相同的食盐,同时放进烧杯中,在一个烧杯中搅拌,观察并记录两个烧杯中的食盐完全溶解所需的时间。
三、走进化学实验室
考点1.药品的取用
(1)取用原则:
①“三不”原则:
不用手摸药品、不凑近闻药品的气味,不尝药品的味道;
②节约原则:
如果没有说明用量时,应按最少量取用:
液体1~2mL,固体只需盖满试管底部;
③处理原则:
实验用剩的药品应放入指定容器内,既不能放回原瓶,也不能随意丢弃。
(2)取用方法:
①固体药品的取用:
取用粉末应用药匙或纸槽,步骤:
“一斜、二送、三缓立”即将试管倾斜,用药匙或纸槽将药品送入试管底部,再把试管缓缓直立起来;
取用块状药品应用镊子夹取,步骤:
“一横、二放、三缓立”即将试管(或容器)横放,把药品放入试管(或容器)口后,再把试管(或容器)缓缓地竖立起来;
②液体药品的取用:
滴管吸取法:
取少量液体时,可用胶头滴管吸取。
倾倒法:
取用较多量时,可用倾倒法,步骤:
先拿下瓶塞,倒放在桌上;
然后拿起瓶子,瓶口紧挨着试管口,使液体缓缓倒入试管。
倾倒液体时要注意以下几点:
a.瓶塞要倒放;
b.试管要倾斜且试剂瓶口紧挨着试管口;
c.试剂瓶上的标签向手心(防止残留的药液流下来腐蚀标签)。
例:
如图实验操作中:
1.正确的操作是(填字母)。
2.指出不正确的实验操作及可能造成的后果。
3.请结合上面的错误示例,探究在平时实验中,因操作不正确可能造成的后果(任举两例)。
①,
②。
A往试管里送入固体粉末B往试管里滴加液体
3.答案:
①倾倒液体时,瓶塞倒放。
否则,易把试剂瓶中的试剂污染②往试管里倾倒液体时,试剂瓶口与试管口紧靠,防止液体洒落。
考点2.物质的加热
(1)酒精灯的使用:
①使用注意“两查、二禁、一不可”。
“两查”是先要检查灯芯和酒精量,不能超过酒精容积的2/3。
“二禁”是绝对禁止向燃着的酒精灯内添加酒精,绝对禁止用一盏酒精灯引燃另一盏酒精灯。
“一不可”,不可用嘴吹灭,必须用灯帽盖灭;
②应用外焰加热;
③酒精在桌上燃烧,应立即用湿抹布扑盖。
(2)给物质加热的方法:
①给物质加热时,应擦干外壁再加热;
烧得很热的玻璃容器,不要立即用冷水冲洗,要垫上石棉网;
②加热时应先预热,后集中加热。
[预热的方法?
];
③用试管给固体加热,试管口一般应略向下倾斜,(为什么?
);
④给液体加热,试管口向上倾斜与桌面约成45°
角。
试管内液体体积不能超过试管容积的1/3,管口切勿对人。
取三支试管,各加入4mL水,将第一支试管的底部与灯芯接触加热;
第二支试管的底部在离酒精灯火焰1-2cm处加热;
第三支试管底部放在酒精灯外焰加热,记录水加热至沸腾时各自所需要的时间。
发现第二支试管所需时间最长,第三支试管所需时间最短,第一支试管所需时间介于另两支试管之间。
你从中发现了什么规律?
考点3.量筒及滴管的使用
(1)量筒的使用:
读数视线与量筒内液体的凹液面最低处保持水平。
若仰视读数,则读数偏小,若俯视读数,则读数偏大,(如图1-4-2所示)。
(2)滴管的使用:
取用少量液体时可用滴管。
取液后的滴管,应保持橡胶帽在上,不要平放或倒置,防止液体倒流,玷污试剂或腐蚀橡胶帽。
考点4.仪器的洗涤
(1)洗涤步骤:
倾倒废液→冷却→水洗→刷洗(转动或上下移动试管刷)→清水洗→晾干。
(2)难溶物的洗涤:
①用热的纯碱溶液或洗衣粉可洗去油脂,再用大量的水冲洗;
②用稀盐酸可以洗去难溶性氧化物或碳酸盐,再用水冲洗。
(3)仪器洗净的标志:
洗过的玻璃仪器内壁附着的水既不成滴,也不成股,表明玻璃仪器已经洗涤干净。
下列各图是初中化学常见的几个实验操作,其中错误的是()
下列实验操作中正确的是()
A.在量筒内稀释浓硫酸B.用剩的药品放回原试剂瓶
C.用燃着的酒精灯引燃另一盏酒精灯D.制取气体前,先检查装置的气密性
化工厂一试剂罐的标签上有下图所示的图标,该试剂罐中装的可能是()
A.NaOHB.NaClC.CuOD.CaCO3
正确的操作能保证实验顺利进行。
请填写下列有关实验操作中的空格:
1)要用酒精灯火焰的________给物质加热;
2)点燃可燃性气体时,都要先_____后点燃;
3)做细铁丝在氧气中燃烧的实验时,集气瓶底应预先________________________;
4)用量筒量取液体度数时,视线与液体凹液面的最低处的位置关系是___________
可在酒精灯火焰上直接加热的玻璃仪器是()
A.量筒B.试管C.滴管D.烧杯
第二单元我们周围的空气
考点1.氧气的实验室制法
在实验室里,通常采用分解过氧化氢溶液,加热氯酸钾或加热高锰酸钾的方法制取氧气。
(1)反应原理:
(2)实验装置:
实验装置包括发生装置和收集装置。
①发生装置包括上图A(固液不加热型)和B(固固加热型)。
发生装置的选择依据:
根据反应物生成物的状态和反应条件选择。
a如果选用过氧化氢和二氧化锰制取氧气,应用装置?
;
b如果选用加热氯酸钾与二氧化锰制取氧气,应用装置?
c如果选用加热高锰酸钾制取氧气,应用装置?
。
②收集装置包括上图C(排水法)、D(向上排空气法)、E(向下排空气法)。
收集装置的选择依据:
根据生成气体的水溶性和密度。
a排水法:
适合收集不易溶于水且不与水发生反应的气体。
如图C;
b向上排空气法;
适合收集密度比空气大且不与空气中的物质发生反应的气体。
如图D;
c向下排空气法;
适合收集密度比空气小且不与空气中的物质发生反应的气体。
如图E。
③验满方法:
a.用向上排空气法收集时把一根带火星的木条,放在集气瓶口,若木条复燃,证明集气瓶内已收集满氧气;
b.用排水法收集时,当气泡从瓶口冒出时证明已收集满。
④操作步骤:
用高锰酸钾制取氧气并用排水法收集气体的一般步骤为:
1组装并检密a.组装好仪器并检查装置的气密性;
2添加药品b.将药品装入试管并在试管口堵上一团棉花,用带导管的单孔橡皮塞塞紧试管;
c.将试管固定在铁架台上;
d.集气瓶里装满水并倒放在水槽中;
3加热e.点燃酒精灯,先预热试管,再对准药品处加热;
4收集气体f.用排水法收集氧气;
g.收集完毕,将导管撤离水槽;
5熄灭酒精灯,结束实验h.熄灭酒精灯。
⑤用高锰酸钾制氧气时的注意事项:
a.试管口微向下倾斜;
c.试管口塞一团棉花;
e.铁夹夹在距试管口的1/3处;
f.伸入试管内的导管略出胶塞即可;
g.用外焰对准药品处加热。
例1.下列关于实验室制取氧气的叙述正确的是()
A.制取氧气的大试管管口应向上倾斜,便于气体迅速排出
B.插入水槽中的导气管管口刚有气泡冒出时,就要立即去收集,否则会造成浪费
C.用排水法收集氧气结束时,应先撤酒精灯,后撤导管
D.收集氧气可用向上排空气法和排水法
2.某气体既能用排水法收集,又能用向上排空气法收集,则该气体具有的物理性质是
()
A.难溶于水,密度比空气大B.难溶于水,密度比空气小
C.易溶于水,密度比空气大D.易溶于水,密度比空气小
3.实验室制取氧气大致可分为以下几个步骤:
a将高锰酸钾装入试管,用带导管的橡皮塞塞紧试管口,并把它固定在铁架台上;
b检查装置的气密性;
c点燃酒精灯给试管加热;
d用排水法收集氧气;
e熄灭酒精灯;
f将导气管从水中取出.正确的操作顺序是()
A.bacdfeB..abcdefC.bacdefD.abcdfe
4.一氧化氮在常温下是一种无色气体,密度比空气稍大,难溶于水,它能跟空气中的氧气反应生成红棕色的二氧化氮。
现要收集一瓶一氧化氮气体,宜采用的方法()
A.向下排空气法B.向上排空气法
C.排水法D.以上三种方法都可以
第三单元自然界的水
课题1水的组成
一、水的组成
1、水的组成:
(考点一)
(1)电解水的实验
化学反应:
文字表达式:
:
水(H2O)
氢气(H2)+氧气(O2)
化学方程式:
2H2O
2H2↑+O2↑
产生位置负极正极
体积比2:
1
质量比1:
8
检验:
O2---出气口置一根带火星的木条----木条复燃
H2---出气口置一根燃着的木条------气体燃烧,发出淡蓝色的火焰
(2)结论:
水是由氢、氧元素组成的。
化学变化中,分子可分而原子不可分。
考点二:
净化水的方法:
沉淀、过滤、吸附、蒸馏
1、沉淀(吸附沉淀):
试剂:
明矾【KAl(SO4)2-12H2O有净水及灭菌的作用】
净水原理:
利用明矾溶于水形成的胶状物对水的杂质进行吸附,从而达到净化的目的。
2、过滤①适用范围:
用于分离难溶性固体与液体(或可溶性固体)
②操作注意事项:
“一贴二低三靠”
③仪器:
铁架台、烧杯、玻璃棒、漏斗玻璃棒的作用:
引流作用
④过滤后,滤液仍然浑浊的可能原因有:
A承接滤液的烧杯不干净B倾倒液体时液面高于滤纸边缘C滤纸破损
3、吸附常用的吸附剂:
活性炭(具有吸附性):
除去水的难溶性杂质、色素和异味。
4、蒸馏:
利用液体沸点不同将液体分离的方法
蒸馏的装置:
见书本
各种静化方法除去的杂质的种类
难溶性杂质
可溶性杂质
降低水的硬度
沉淀
√
过滤
吸附
蒸馏
原水(未作处理的水)中含有泥沙、悬浮物和细菌等杂质,可用次氯酸杀死细菌。
氯气溶于水时可生成次氯酸和盐酸,某水厂自来水的生产净化步骤如下:
ABCD
①可以除去大颗粒悬浮物杂质的步骤为(填编号)。
②能消毒杀菌的步骤为(填编号)
【氯气遇水会产生次氯酸,次氯酸具有净化(漂白)作用,用于消毒--溶于水生成的HClO具有强氧化性。
】
第六单元碳和碳的氧化物
考点.一氧化碳的性质和用途
(1)CO物理性质:
无色、无味、有毒的气体,密度比空气略小,难溶于水。
(2)CO化学性质:
①可燃性:
a.现象:
CO能燃烧,发出蓝色火焰,放出热量,罩在火焰上方的烧杯内壁上附着的澄清石灰水变浑浊;
△
b.化学方程式:
c.注意:
点燃一氧化碳前要验纯。
②还原性:
一氧化碳能将CuO(金属氧化物)还原成铜,同时生成二氧化碳:
CO+CuO=加热=Cu+CO2
一氧化碳用于炼铜和炼铁。
(3)一氧化碳还原氧化铜的实验:
①操作顺序:
先通CO,再加热?
实验完毕,
先停止加热,继续通CO至试管冷却。
?
②尾气处理:
将CO燃烧掉,转化为无毒的CO2或收集备用。
(4)一氧化碳的毒性、产生方式及用途:
①一氧化碳的毒性:
CO和人体血红蛋白的结合力比氧与血红蛋白的结合力强,人吸入CO会造成人体缺氧,严重者会致死。
②产生CO的三种主要方式:
a.碳不完全燃烧:
b.CO2遇到炽热的碳;
c.碳与水蒸气高温条件下反应:
(水煤气)。
③一氧化碳的用途:
作燃料;
冶炼金属,如炼铁等。
考点.二氧化碳的实验室制法
(1)药品:
石灰石(或大理石)和稀盐酸。
(2)反应原理:
CaCO3+2HCl==CaCl2+CO2↑+H2O。
(3)实验装置:
类似于制氢气的装置,选用固液不加热型发生装置。
【为什么?
(4)收集方法:
用向上排空气法收集。
(5)检验方法:
通入澄清石灰水中
(6)验满:
把燃着的木条放在集气瓶口
(7)注意:
实验室制取CO2不能用碳酸钠代替大理石(或石灰石),原因是反应速率太快,不宜收集;
不能用浓盐酸代替稀盐酸,原因是浓盐酸易挥发,使收集的CO2气体中混有较多氯化氢气体;
也不能用稀硫酸代替稀盐酸,原因是生成的CaSO4微溶于水,覆盖在大理石(或石灰石)表面,阻止反应续续进行。
考点.实验室制取气体的总结
(1)实验室制取气体的一般思路:
首先,研究化学反应原理,就是要研究在什么条件下(如常温、加热、加催化剂等),用什么药品、通过什么反应方程来制取这种气体;
即反应方程式。
第二,研究实验装置,包括发生装置和收集装置,有些还涉及到性质检验装置、尾气处理装置、干燥装置等。
第三,验证气体。
(2)气体发生装置:
①选择发生装置的原理:
根据反应物的状态和反应条件。
a.固固加热制气装置;
b.固液不加热制气装置。
②常见实验装置:
氯酸钾和二氧化锰混合加热或高锰酸钾加热选用哪种装置?
木炭还原氧化铜选用哪种装置?
实验室用锌粒与稀盐酸或稀硫酸反应制取H2选用哪种装置?
实验室制CO2(用大理石或石灰与石与稀盐酸反应)选用哪种装置?
(3)气体收集方法:
气体的收集方法取决于所制气体的溶解性和密度等,常见的方法有:
①排水法:
操作时注意事项:
a.导气管刚过集气瓶口即可;
b.集气瓶中要预先装满水,用玻璃片盖住,倒置于水槽中,注意不要留气泡;
c.实验刚开始有气泡冒出不宜立即收集,等气泡连续均匀出现后再收集。
②排空气法可分为:
a.向上排空气法:
气体密度大于空气的密度(相对分子质量>
29),如:
O2、CO2;
b.向下排空气法:
气体密度小于空气的密度(相对分子质量<
H2。
③操作时注意事项:
a.用排空气收集时,导管要伸入试管或集气瓶底部。
考点.检验二氧化碳气体的方法
鉴别CO2气体可根据其性质选用以下方法:
(1)通入澄清石灰水中,(如区别CO2和CO)。
(2)用湿润的紫色石蕊试纸?
或把CO2通入紫色石蕊试液中,(如区别CO2和N2)。
(3)使燃着的木条熄灭的气体为二氧化碳(如区别CO2和O2)。
例.实验室按下图所示装置制取CO2,并实验CO2的性质.试回答以下问题.
(1)实验开始前,应检查装置A的________;
(2)用装置A来制取CO2,所用的药品是(写名称)________;
(3)若要用装置B鉴定CO2,在B中应盛放的试剂名称是________,当将标①和②的导管口连接时,B中看到的实验现象是________;
(4)若要用装置C证明CO2能与水反应生成碳酸,C中除有少量水外,应加入的试剂是________,当将标①和③的导管口连接时,C中看到的实验现象是________;
(5)烧杯D中放在燃着的蜡烛如图所示,当将标①和④的导管口连接时,D中看到的实验现象是________,证明CO2具有_______的性质。
例.通常情况下,氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。
实验室用加热氯化铵和消石灰的固体混合物制取氨气。
下图是实验室常用的装置。
请回答:
(1)实验室制取氨气应选用的发生装置为;
收集氨气应选用的装置为;
(2)制取氨气时为防止多余的氨气逸散到空气中造成环境污染,可以
用来吸收。