山东省济南市莱芜区新高三化学学年一轮复习测试专题Word格式.docx
《山东省济南市莱芜区新高三化学学年一轮复习测试专题Word格式.docx》由会员分享,可在线阅读,更多相关《山东省济南市莱芜区新高三化学学年一轮复习测试专题Word格式.docx(11页珍藏版)》请在冰豆网上搜索。
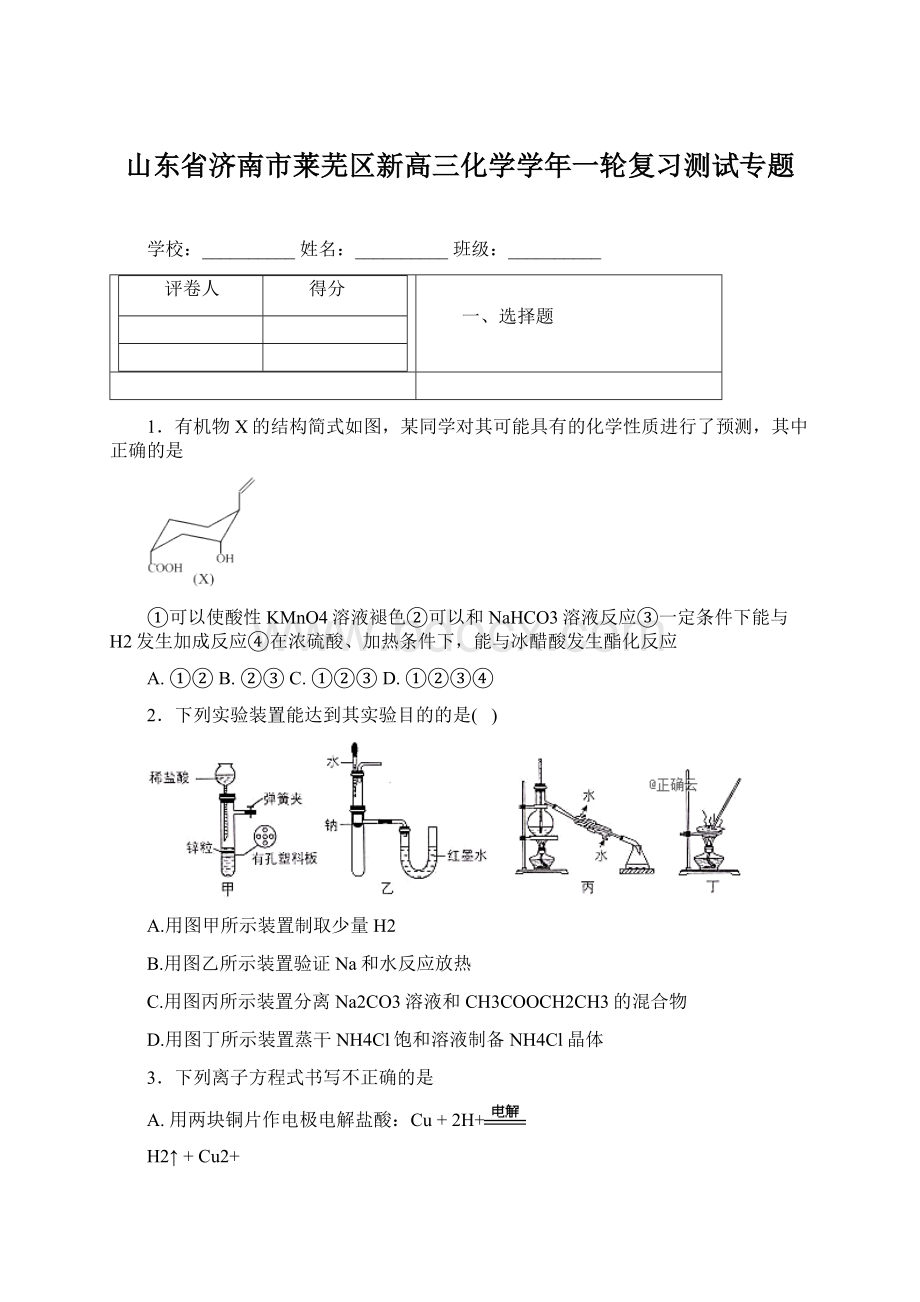
H2↑+Cu2+
B.NaOH溶液与足量的Ca(HCO3)2溶液反应:
2HCO3-+2OH-+Ca2+==CaCO3↓+2H2O
C.等物质的量的FeBr2和Cl2在溶液中的反应:
2Fe2++2Br-+2Cl2==2Fe3++Br2+4Cl-
D.氨水吸收少量的二氧化硫:
2NH3·
H2O+SO2==2NH4++SO32-+H2O
4.元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如下图所示,图中RuII*表示激发态。
下列说法正确的是()
A.电池工作时,直接将太阳能转化为电能
B.镀铂导电玻璃的作用是传递I-
C.电池的电解质溶液中I-和I3-的浓度不断减小
D.电解质溶液中发生反应:
2Ru3++3I-=2Ru2++I3-
5.甲、乙、丙三种有机化合物的键线式如图所示。
下列说法错误的是
A.甲、乙的化学式均为C8H14
B.乙的二氯代物共有7种(不考虑立体异构)
C.丙的名称为乙苯,其分子中所有碳原子可能共平面
D.甲、乙、丙均能使酸性高锰酸钾溶液褪色
6.ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
A.该装置可以在高温下工作
B.X、Y依次为阳离子、阴离子选择性交换膜
C.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D.该装置工作时,电能转化
化学能
7.2019年北京园艺会主题是“绿色生活,美丽家园”。
下列有关园艺会说法正确的是(
A.大会交通推广使用的是利用原电池原理制成太阳能电池汽车,可减少化石能源的使用
B.妫汭剧场里使用的建筑材料第五形态的碳单质——“碳纳米泡沫”,与石墨烯互为同分异构体
C.传统烟花的制作常加入含有铂、铁、钾、钙、铜等金属元素的发光剂,燃放时呈现美丽的颜色,大会庆典禁止使用
D.秸秆经加工处理成吸水性的材料——植物纤维,可用作食品干燥剂,符合大会主题
【答案】D
8.液态金属储能电池是一类成本较低的储能电池,其主体结构由三层密度不同的液体构成,上下两层液态金属分别作为电池两极,中间层的熔融盐在充放电过程中组成均保持不变。
某种液态金属储能电池的结构如图所示,下列说法错误的是()
A.该电池放电过程中钠电极发生氧化反应
B.该电池充电时锌电极发生的反应是Zn-2e-=Zn2+
C.该电池的缺点是需要较高的工作温度
D.该电池充电时电子由电源的负极经导线移向钠电极
【答案】B
【解析】
【详解】A、钠的金属性强于锌,因此钠电极为负极,锌电极为正极,充放电过程中熔融盐组成保持不变,因此放电时钠电极发生氧化反应,电极反应为Na-e-=Na+,锌电极发生还原反应,电极反应为Na++e-=Na,选项A正确;
B、充电时钠电极发生还原反应,电极反应为Na++e-=Na,锌电极发生氧化反应,电极反应为Na-e-=Na+,选项B错误;
C、该电池工作条件为熔融状态,缺点是需要较高的工作温度,选项C正确;
D、该电池充电时电子由电源的负极经导线移向钠电极,选项D正确。
答案选B。
【点睛】本题考查了原电池和电解池原理,根据元素化合价变化确定各个电极上发生的反应,难点是电极反应式的书写。
9.用下图所示装置检验乙烯时不需要除杂的是( )
选项
乙烯的制备
试剂X
试剂Y
A
CH3CH2Br与NaOH乙醇溶液共热
H2O
KMnO4酸性溶液
B
Br2的CCl4溶液
C
C2H5OH与浓H2SO4加热至170℃
NaOH溶液
D
A.AB.BC.CD.D
10.短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,并且可与X的氢化物形成一种共价化合物。
Y是地壳中含量最多的金属元素,Z原子最外层电子数是其内层电子总数的3/5。
下列说法中一定正确的是( )
A.X的简单气态氢化物稳定性比Z的强
B.原子半径大小顺序:
W<
X<
Y<
Z
C.W的氧化物对应水化物为强酸,具有强氧化性
D.工业上一般采取电解Y的熔融氯化物来生产Y的单质
11.三氧化铬(CrO3)又叫铬酸酐,是一种暗红色固体,溶于水会生成铬酸(H2CrO4),200℃以上会部分分解生成氧化铬(Cr2O3)。
I.下图是用铬铁矿(主要成分是FeCr2O4,含A12O3、SiO2等杂质)生产CrO3的传统工艺流程,请回答相关问题。
(1)操作1的名称是____,沉淀X的成分是_____(填化学式)。
(2)高温煅烧时FeCr2O4参与反应的化学方程式是____。
II.某工厂采用了一种新的生产CrO3的工艺流程,与传统工艺流程主要区别如下图所示(中间过程省略)。
(3)液相转化过程发生反应的化学方程式是____。
(4)新工艺与传统工艺相比有多种优点:
可得到价值更高的副产品KNO3;
___;
从绿色化学角度考虑新工艺也存在某种缺点,该缺点是____。
【答案】
(1).溶解、过滤
(2).Al(OH)3、H2SiO3(3).4FeCr2O4+8Na2CO3+7O2
2Fe2O3+8Na2CrO4+8CO2↑(4).K2Cr2O7+2HNO3
2KNO3+2CrO3+H2O(5).能耗较低、产品纯度更高(6).硝酸挥发或分解会产生污染
二、单选题
12.(16分)实验Ⅰ:
下图1为实验室制取氨的实验装置。
(1)写出A中所发生反应的化学方程式____________________________________。
(2)在收集氨时试管口棉花的作用是______________________________________。
(3)另一学生积极思考产生喷泉的其他方法,设计了图3装置。
首先在锥形瓶中分别加入足量的下列物质,反应后产生喷泉的是____________
A.CaCO3粉末和浓盐酸B.NH4HCO3溶液与稀NaOH溶液
C.HCl和AgNO3溶液D.HCl和酚酞溶液
(4)该同学又向锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。
水槽中加入的物质可以是____________
A.硝酸铵B.食盐C.浓硫酸
实验Ⅱ:
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为橙黄色时,夹紧弹簧夹。
Ⅲ.当B中橙黄色溶液颜色变深时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。
(1)A中产生黄绿色气体,其化学方程式是__________________
(2)B中溶液发生反应的离子方程式是____________________
(3)过程Ⅳ的目的为______________________________________
(4)D中出现的现象为____________________________
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:
同主族元素从上到下_________,得电子能力逐渐减弱。
13.A、B两种元素为同一族第三周期和第四周期元素,若A元素的原子序数为x,则B元素的原子序数可能为()
①x+2②x+8③x+18④x+32
A.①③B.②④C.②③D.①②
【参考答案】***试卷处理标记,请不要删除
1.D
解析:
【详解】①该有机物中含有碳碳双键和醇羟基,可以使酸性KMnO4溶液褪色,故正确;
②含有羧基,可以和NaHCO3溶液反应,故正确;
③含有碳碳双键,一定条件下能与H2发生加成反应,故正确;
④含有羟基,在浓硫酸、加热条件下,能与冰醋酸发生酯化反应,故正确;
故选D。
2.B
装置甲中长颈漏斗的末端应该浸没在液面下,A错误;
装置乙中Na和水反应放出的热量使大试管中的空气膨胀,气体压强增大,U形管左侧液面下降,右侧液面上升,可以验证钠与水反应放热,B正确;
Na2CO3在水中的溶解度远大于CH3COOC2H5在水中的溶解度,应该用分液的方法分离,C错误;
NH4Cl受热易分解,应该用冷却NH4Cl热饱和溶液的方法得到其晶体,D错误。
3.B
试题分析:
A、用两块铜片作电极电解盐酸的离子反应为Cu+2H+
H2↑+Cu2+,故A正确;
B、NaOH溶液与足量的Ca(HCO3)2溶液反应的离子反应为HCO3-+OH-+Ca2+═CaCO3↓+H2O,故B错误;
C、等物质的量的FeBr2和Cl2在溶液中反应,由电子守恒可知,亚铁离子全部被氧化,溴离子一半被氧化,离子反应为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故C正确;
D、氨水吸收少量的二氧化硫的离子反应为2NH3•H2O+SO2═2NH4++SO32-+H2O,故D正确;
故选B。
【考点定位】考查离子方程式的书写
【名师点晴】本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意氧化还原反应的离子反应中遵循电子守恒,选项B中量少的完全反应,选项C中等物质的量的FeBr2和Cl2在溶液反应,由电子守恒可知,亚铁离子全部被氧化,溴离子一半被氧化。
4.D
【分析】
由图中电流移动方向可知,镀Pt导电玻璃为正极,I3-在正极上放电发生还原反应生成I-,电极反应式为I3-+2e-=3I-,透明导电玻璃为负极,钌(RuII)的配合物获得太阳能转化为激发态RuII*,激发态RuII*在负极上放电发生氧化反应生成RuIII,I-在电池电解质溶液中部与RuIII反应生成I3-和RuII,电解质溶液中发生反应为2Ru3++3I-=2Ru2++I3-。
【详解】A项、由图可知,透明导电玻璃上钌(RuII)的配合物获得太阳能转化为激发态RuII*,激发态RuII*在负极上放电发生氧化反应生成RuIII,能量转化形式是太阳能先转化为化学能,化学能再转化为电能,故A错误;
B项、镀Pt导电玻璃为正极,I3-在正极上放电发生还原反应生成I-,电极反应式为I3-+2e-=3I-,故B错误;
C项、由电池工作原理可知,I3-在正极上放电发生还原反应生成I-,I-在电池电解质溶液中部与RuIII反应生成I3-和RuII,电池的电解质溶液中I-和I3-的浓度不变,故C错误;
D项、I3-在正极上放电发生还原反应生成I-,激发态RuII*在负极上放电发生氧化反应生成RuIII,I-在电池电解质溶液中部与RuIII反应生成I3-和RuII,电解质溶液中发生反应为2Ru3++3I-=2Ru2++I3-,故D正确。
【点睛】本题考查原电池的工作原理,注意通过电流移动方向判断电池的电极,明确电池工作时能量的转化形式,两极的电极反应式和溶液中发生的化学反应是解答的关键。
5.D
A.根据结构简式判断;
B.乙的二氯代物中两个氯原子可在相同或不同的C原子上;
C.苯为平面形结构,结合三点确定一个平面分析;
D.乙与高锰酸钾不反应。
【详解】A.由结构简式可知甲、乙的化学式均为C8H14,故A正确;
B.乙的二氯代物中两个氯原子可在相同或不同的C原子上,如在不同的C上,用定一移一法分析,依次把氯原子定于-CH2或-CH-原子上,共有7种,故B正确;
C.苯为平面形结构,碳碳单键可以旋转,结合三点确定一个平面,可知所有的碳原子可能共平面,故C正确;
D.乙为饱和烃,与酸性高锰酸钾溶液不反应,故D错误。
6.C
【详解】A.高温能使微生物蛋白质凝固变性,导致电池工作失效,所以该装置不能在高温下工作,A错误;
B.原电池内电路中:
阳离子移向正极、阴离子移向负极,从而达到脱盐目的,所以Y为阳离子交换膜、X为阴离子交换膜,B错误;
C.由图片可知,负极为有机废水CH3COO-的电极,失电子发生氧化反应,电极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+,C正确;
D.该装置工作时为原电池,是将化学能转化为电能的装置,D错误;
故合理选项是C。
不定项选择题:
本题包括5小题,每小题4分,共20分。
每小题只有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该小题得0分;
若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
7.A
【详解】A.太阳能电池是将太阳能转化为电能,不是原电池原理,故A错误;
B.第五形态的碳单质——“碳纳米泡沫”,与石墨烯是同素异形体,而非同分异构体,故B错误;
C.烟花的使用需要从环保、安全等多方面考虑,但禁止使用是错误的,故C错误;
D.植物纤维的成分为糖类,无污染,可再生,可用作食品干燥剂,符合大会主题,故D正确,
8.无
9.B
A.发生消去反应生成乙烯,水吸收乙醇,乙醇能被高锰酸钾氧化,则需要加水除杂,否则干扰乙烯的检验,故A不选;
B.发生消去反应生成乙烯,乙醇与Br2的CCl4溶液不反应,乙烯与Br2的CCl4溶液反应,则不需要除杂,不影响乙烯检验,故B选;
C.发生消去反应生成乙烯,NaOH溶液吸收乙醇,乙醇能被高锰酸钾氧化,则需要NaOH溶液除杂,否则干扰乙烯的检验,故C不选;
D.发生消去反应生成乙烯,乙醇与溴水不反应,但可能混有二氧化硫,二氧化硫、乙烯均与溴水发生反应,则需要除杂,否则可干扰乙烯检验,故D不选;
10.A
11.H
【详解】
(1)铬铁矿与纯碱、空气高温煅烧后的固体通过操作1后得到固体和溶液,故操作1的名称是溶解、过滤;
通过调节pH,使溶液中的偏铝酸根离子和硅酸根离子转化成沉淀,故沉淀X的成分是Al(OH)3、H2SiO3;
(2)高温煅烧时FeCr2O4与纯碱、空气反应生成氧化铁、Na2CrO4和二氧化碳,反应的化学方程式是4FeCr2O4+8Na2CO3+7O2
2Fe2O3+8Na2CrO4+8CO2↑;
(3)液相转化过程K2Cr2O7与硝酸反应生成硝酸钾、CrO3和水,发生反应的化学方程式是K2Cr2O7+2HNO3
2KNO3+2CrO3+H2O;
(4)新工艺最后一步需要温度是90℃,传统工艺是高温,因此新工艺能耗较低;
CrO3200℃以上会部分分解生成Cr2O3,因此新工艺所得CrO3纯度更高;
从绿色化学角度考虑新工艺也存在某种缺点,该缺点是硝酸挥发或分解会产生污染。
12.无
13.C
【详解】同一族第三周期和第四周期元素,原子序数相差可能为8(如19号元素钾与11号元素钠),也可能为18(如31号镓元素与13号铝元素),所以若A元素的原子序数为x,则B元素的原子序数可能为x+8或x+18。
故选C。