预科化学在线课程4化学反应原理Word格式.docx
《预科化学在线课程4化学反应原理Word格式.docx》由会员分享,可在线阅读,更多相关《预科化学在线课程4化学反应原理Word格式.docx(17页珍藏版)》请在冰豆网上搜索。
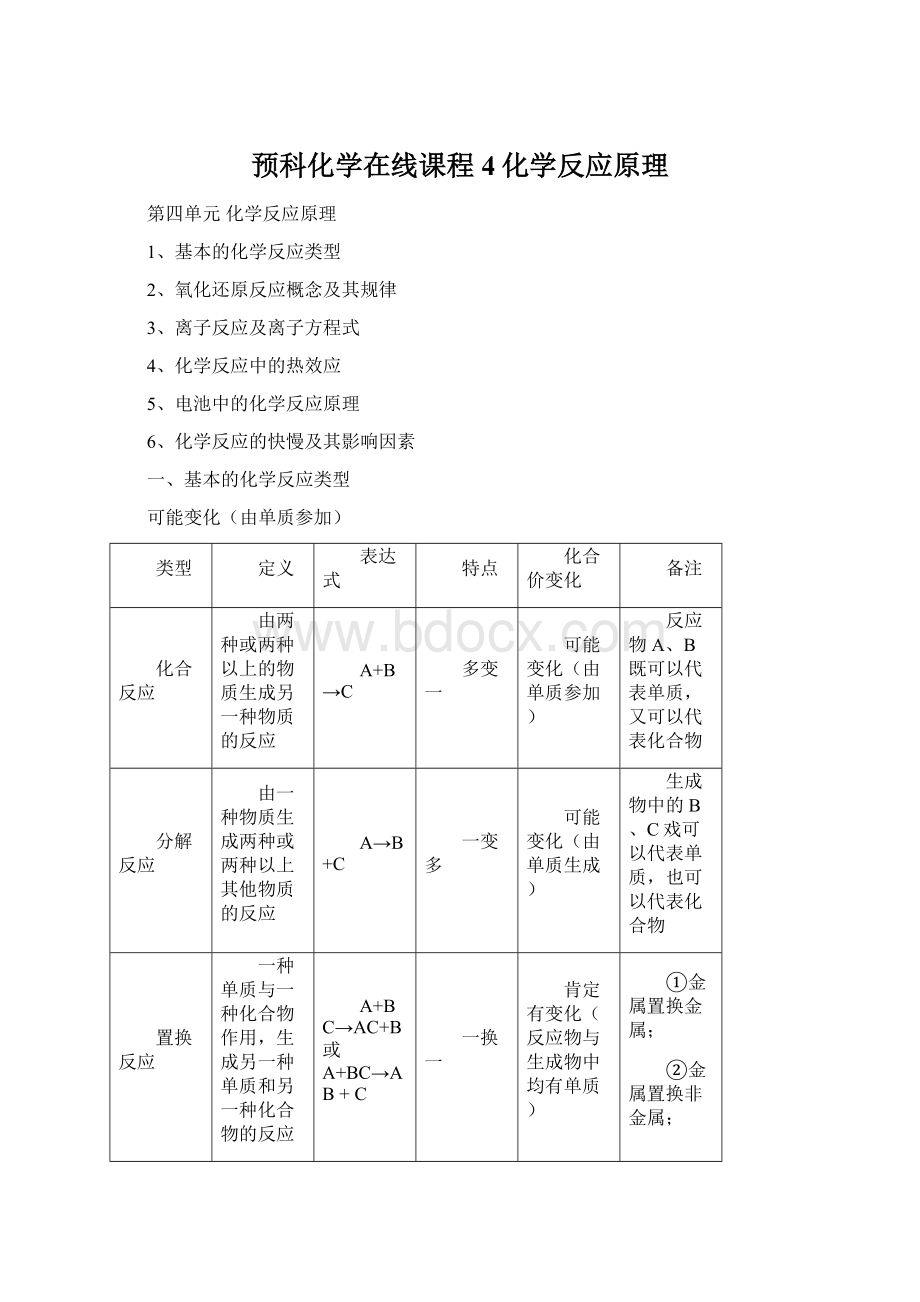
④碱与盐;
⑤碱与碱;
⑥盐与盐
1、四大基本反应——化合反应
⑴金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。
如,常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。
⑵非金属+氧气→非金属氧化物
经点燃,许多非金属都能在氧气里燃烧,生成非金属氧化物。
⑶金属+非金属→无氧酸盐
许多金属能与非金属氯、硫等直接化合成无氧酸盐。
⑷氢气+非金属→气态氢化物.
因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。
⑸碱性氧化物+水→碱
多数碱性氧化物不能跟水直接化合。
能否跟水直接化合的碱性氧化物,对应的碱是可溶的或微溶的。
⑹酸性氧化物+水→含氧酸
除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。
⑺碱性氧化物+酸性氧化物→含氧酸盐 .
大多数碱性氧化物和酸性氧化物可以进行这一反应。
其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
⑻氨+氯化氢→氯化铵
氨气易与氯化氢化合成氯化铵。
如:
NH3+HCl=NH4Cl
⑼硫和氧气在点燃的情况下形成二氧化硫
2、四大基本反应——分解反应
⑴氧化物分解
2H₂O
2H₂↑+O₂↑
⑵含氧酸分解
H₂CO₃===H₂O+CO₂↑
⑶碱的分解
Mg(OH)₂
MgO+H₂O
2Fe(OH)₃
Fe₂O₃+3H₂O
2Al(OH)₃
Al₂O₃+3H₂O
⑷盐的分解
CaCO₃
CaO+CO₂↑
2KClO₃
2KCl+3O₂↑
3、四大基本反应——置换反应
⑴根据反应环境的类别,置换反应有以下2种情况:
①固态置换在加热或高温条件下固体与固体或固体与气体发生的置换反应。
②液态置换在水溶液中进行的置换反应。
①金属跟酸的置换
金属原子与酸溶液中氢离子之间的反应。
Zn+2HCl=ZnCl₂+H₂↑
Zn+H₂SO₄=ZnSO₄+H₂↑
2Al+3H₂SO₄=Al₂(SO₄)₃+3H₂↑
不能用浓硫酸,硝酸,它们有强氧化性,不能发生置换反应。
②金属跟盐溶液的置换
金属原子跟盐溶液中较不活泼金属的阳离子发生置换。
Cu+Hg(NO₃)₂=Hg+Cu(NO₃)₂
Fe+CuSO₄=FeSO₄+Cu
⑴元素种类,置换反应有以下4种情况:
①金属置换金属
Fe+CuSO₄=FeSO₄+Cu
Cu+Hg(NO₃)₂=Hg+Cu(NO₃)₂
2Al+Fe₂O₃
Al₂O₃+2Fe
铝热反应,Al还可与V₂O₅.CrO₃.WO₃.MnO₂等发生置换反应
②金属置换非金属
③非金属置换金属
Cl₂+2NaBr=Br₂+2NaCl
O₂+2H₂S=2S↓+2H₂O
2F₂+2H₂O=4HF+O₂↑
4、四大基本反应——复分解反应
根据反应物类型,复分解反应有以下4种情况:
①酸与盐
2HCl+CaCO₃=CaCl₂+H₂O+CO₂↑
BaCl₂+H₂SO₄=BaSO₄↓+2HCl
AgNO₃+HCl=AgCl↓+HNO₃
Na₂CO₃+H₂SO₄=Na₂SO₄+H₂O+CO₂↑
NaHCO₃+HCl=NaCl+H₂O+CO₂↑和CO₂)
②酸与碱
H₂SO₄+Cu(OH)₂=CuSO₄+2H₂O
H₂SO₄+2NaOH=Na₂SO₄+2H₂O
H₂SO₄+Ba(OH)₂=BaSO₄↓+2H₂O
2HCl+Ca(OH)₂=CaCl₂+2H₂O
③碱与盐
2NaOH+CuSO₄=Na₂SO₄+Cu(OH)₂↓
NaOH+NH₄Cl=NaCl+NH₃↑+H₂O
Na₂CO₃+Ca(OH)₂=CaCO₃↓+2NaOH
3NaOH+FeCl₃=Fe(OH)₃↓+3NaCl
NaHCO3+NaOH=Na2CO3+H2O
④盐与盐
练习1:
下列有关化学反应类型的判断,错误的是
A.SO3+H2O = H2SO4化合反应
B.NH4HCO3 = NH3↑+H2O+CO2↑分解反应
C.2A1+WO3=Al2O3+W置换反应
D.6CO2+6H2O=C6H12O6+6O2复分解反应
练习2、下列化学反应类型的判断,错误的是
二、氧化还原反应及其规律
常见的几个反应
得氧元素
失氧元素
反应的共同特点
C+2CuO
2Cu+CO2↑
C
Cu
有氧元素的得与失,都是氧化还原反应
Fe2O3+3CO
2Fe+3CO2
Fe
CuO+H2
Cu+H2O
H
判断:
它们是氧化还原反应,它们有氧元素得失吗?
⑴Fe+CuSO4=Cu+FeSO4⑵Zn+H2SO4=ZnSO4+H2↑
1、基于化合价降的观点给氧化还原反应概念
⑴元素化合价升高,被氧化,发生氧化反应,反应物为还原剂——升、失、氧、还
元素化合价降低,被还原,发生还原反应,反应物为氧化剂——降、得、还、氧
⑵元素化合价发生变化的化学反应,被叫做氧化还原反应
⑶元素化合价升高与降低的值完全相等
思考、化合价变化与电子得失的关系
Cl2(+2e-)→2Cl-Na(-e-)→Na+
MnO2(+2e-)→Mn2+S(-4e-)→SO2
MnO4-(+5e-)→Mn2+2Cl-(-2e-)→Cl2
SO42-(+2e-)→SO2H2O2(-2e-)→O2
⑴氧化还原反应中失去电子,化合价升高,得到电子,化合价降低,化合价升降数值相等,得失电子总数相等。
每失n个电子,化合价会升高n个单位;
每得到n个电子,化合价会降低n个单位。
⑵氧化还原反应的特征是化合价发生变化,化合价变化的原因是电子得失,氧化还原反应的实质是电子得失;
⑶任何一个氧化还原反应元素化合价有升有降,电子有得有失,而且升降的数值,电子得失数值相等;
⑷化合价升降的观点判断氧化还原反应:
升、失、氧,降、得、还。
练习1、判断下列反应的反应类型及是否是氧化还原反应,如果是氧化还原反应,哪些元素被氧化,哪些元素被还原?
⑴MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
⑵H2+Cl2==2HCl
⑶CaO+H2O=Ca(OH)2
⑷2KClO3
2KCl+3O2↑
⑸CaCO3
CaO+CO2↑
⑹Zn+CuSO4==ZnSO4+Cu
⑺AgNO3+NaCl==AgCl↓+NaNO3
练习2、判断下列说法的正误
⑴有氧元素得失的反应,一定是氧化还原反应;
⑵没有氧元素得失的反应属于非氧化还原反应;
⑶氧化与还原反应属于两个不同的反应;
⑷化学反应中,有元素化合价降低,必然有元素化合价升高;
⑸氧化还原反应中一定有元素化合价变化;
⑹元素化合价变化是氧化还原反应的标志。
2、氧化还原反应规律
⑴分析下列化学反应,找出其中的规律
①SO2+2H2S=2H2O+3S↓
②HClO+HCl=Cl2↑+H2O
规律1、不同价态的同种元素的化合物起反应,生成物中该元素处于中间价态,这就是归中规律。
对非金属元素来说,正价元素与负价元素可以归中为非金属的单质。
⑵下列物质中哪些元素只有氧化性,哪些元素只有还原性,哪些元素既有氧化性,又有还原性?
⑴Cl2、I2;
⑵I-、Cl-;
⑶Fe、Fe3+、Fe2+⑷H2S、SO2
规律2、元素的氧化还原性是由元素的价态决定的。
元素处于最低价态,只有还原性,元素处于最高价态,只有氧化性,元素处于中间价态,既有氧化性,又有还原性。
⑶完成下列氧化还原反应的配平
⑴NH3+Cl2——NH4Cl+N2
⑵Mg+HNO3——Mg(NO3)2+NH4NO3+H2O
在氧化还原反应的发生过程中,氧化剂所得电子完全来自于还原剂所失,即氧化剂得电子总数等于还原剂失电子总数。
练习1、下列有关氧化还原反应的叙述正确的是
A.肯定有一种元素被氧化,另一种元素被还原
B.在反应中不一定所有元素的化合价都发生变化
C.置换反应一定属于氧化还原反应
D.化合反应和复分解反应中不可能包含氧化还原反应
练习2、下列有关氧化还原反应的叙述中正确的是
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原反应的本质是元素化合价的升降
C.失电子的反应物在反应中作氧化剂,反应中被还原
D.金属单质在化学反应中一定作还原剂
三、离子反应及离子方程式
1、溶液中发生的离子反应
[判断]
⑴电解质是因为导电才发生了电离;
⑵电解质必须先电离才能导电;
⑶电解质在水溶液中与熔化状态下电离出离子完全相同;
⑷能发生电离的化合物,叫做电解质,不发生电离的化合物叫做非电解质;
⑸电解质在溶解的过程中,即发生了电离;
⑹凡是水溶液能导电的化合物,都能发生电离。
思考:
复分解反应发生的条件是什么?
复分解反应在本质上有什么共同特点?
电解质在水溶液中发生的离子之间的反应,叫做离子反应。
下列各组物质相混合,有什么现象?
写出表示现象的化学方程式,分别说明溶液中哪些离子参与了反应?
⑴盐酸与NaOH(aq)
⑵AgNO3(aq)+盐酸
⑶Na2SO4(aq)+BaCl2(aq)
⑷MgCl2(aq)+NaOH(aq)
关于离子反应的结论:
⑴有离子参加(至少一种离子);
⑵电离状态下(自由离子之间)发生;
⑶在水溶液中发生。
完成下列表格:
实验
现象
化学方程式
参加反应的离子
1.向盛有2mLCuSO4溶液的试管里加入2mL稀NaOH溶液
2.向盛有2mLNaOH溶液的试管里滴入几滴酚酞,再往试管中慢慢滴入稀盐酸,至溶液恰好变色为止。
3.向盛有2mLNa2CO3溶液的试管里加入2mL稀盐酸。
结论:
⑴水溶液中发生的复分解反应,都是离子反应;
⑵复分解型的离子反应:
必须生成沉淀、气体或水;
⑶没有生成沉淀、气体或水的离子,即没有参加离子反应;
⑷复分解型离子反应的特点:
离子数目减少。
2、离子方程式的书写
⑴离子方程式的概念
用实际参加反应的离子符号来表示离子反应的式子叫离子方程式。
⑵离子方程式的书写步骤——写→拆→删→查
①写:
书写出正确的化学方程式;
②拆:
除难溶物、难电离物、气体以外,一律拆成离子形式;
③删:
删除方程式两边相同的离子符号;
④查:
质量是否守恒,电荷是否守恒,表示是否规范。
强调:
书写离子方程式的关键是把易溶于水、易电离物质改写成离子形式,而难溶于水、难电离的物质以及气体仍用化学式表示。
练习1、按离子方程式书写步骤,写出下列反应离子方程式
⑴碳酸钙固体溶于盐酸;
⑵碳酸钠溶液与稀硫酸反应;
⑶向硝酸银溶液中加入盐酸;
⑷氯化钠溶液中加入到硝酸银溶液中。
练习2、写出下列离子方程式对应的化学反应方程式
⑴CO32-+2H+=CO2↑+H2O
⑵Ba2++SO42-=BaSO4↓
⑶Ag++Cl-=AgCl↓
⑷H++OH-=H2O
离子反应方程式不仅可以表示一个具体的反应,还可以表示一类反应。
如,H++OH-=H2O,可以表示
⑴盐酸+NaOH(aq)
⑵KOH(aq)+H2SO4(aq)
⑶H2SO4(aq)+NaOH(aq)
⑷HNO3(aq)+NaOH(aq)
练习3、指出下列离子方程式的错误
⑴硫酸溶液与氢氧化钡溶液反应的离子方程式
A.H++OH-=H2O
B.Ba2++SO42-=BaSO4↓
C.Ba2++H++SO42-+OH-=BaSO4↓+H2O
⑵氢氧化钡溶液与盐酸溶液反应的离子方程式
2H++2OH-=2H2O
⑶氯化铁溶液与铁粉反应的离子方程式
Fe3++Fe=2Fe2+
3、离子共存判断
离子之间,凡是生成沉淀、生成气体,或生成难电离的物质,均不可以大量共存!
练习1、下列各组离子在水溶液中能大量共存的是
A.Na+、Ba2+、Cl-、SO42-
B.Ca2+、HCO3、C1-、K+
C.Mg2+、Ag+、NO3、Cl-
D.H+、Cl-、Na+、CO32-
练习2、能在水溶液中大量共存的一组离子是
A.H+、I-、NO3-、CO32-
B.Ag+、Fe3+、Cl-、SO42-
C.K+、SO42-、Cu2+、NO3-
D.NH4+、OH-、Cl-、HCO3-
四、化学反应中的热效应
1、溶解过程中的放热与吸热现象
任何物质溶解于水都要发生溶质的扩散过程和水合过程。
扩散过程要吸收热量,水合过程要放出热量。
硝酸铵溶于水温度降低,是因为硝酸铵扩散过程吸收的热量大于水合过程放出的热量,并不是只发生溶质的扩散过程.而氢氧化钠溶于水温度升高,是因为氢氧化钠扩散过程吸收的热量小于水合过程放出的热量,并不是只发生了溶质的水合过程。
氯化钠溶于水后,扩散过程吸收的热量等于水合过程放出的热量,所以溶液温度无明显变化。
2、化学反应中的放热与吸热过程
吸热反应
放热反应
化学反应过程中放出热量的反应
化学反应过程中吸收热量的反应
能量变化
反应物总能量小于生成物总能量,热能转化成了化学能
反应物总能量大于生成物总能量,热能转化成了化学能
图示
举例
①大多数的分解反应;
②C、CO、H2参加的氧化还原反应;
③Ba(OH)2·
8H2O和NH4Cl反应;
④盐的水解反应
①金属和水或酸的反应;
②金属氧化物和水或酸的反应;
③可燃物的燃烧及缓慢氧化;
④酸和碱的中和反应;
⑤铝热反应。
3、化学反应中的能量转化形式
能量转化形式
条件
实例
热能转化为化学能
加热
C+2CuO
2Cu+CO2
不需外加条件
Ba(OH)2·
8H2O+2NH4Cl= BaCl2+10H2O+2NH3↑
化学能转化为热能
加热或点燃
2H2+O2
2H2O
2Na+2H2O=2NaOH+H2↑
经验规律
持续加热的反应为吸热反应
结论
吸热反应和放热反应与反应条件没有必然关系
练习、下列说法中错误的是
A.化学反应中的能量变化通常表现为热量的变化
B.放热反应在常温下一定很容易发生
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量相对大小决定了反应是放热反应还是热反应
五、电池中的化学反应原理
思考、我们身边有形形色色的电池,大家知不知道这些电池是如何工作的呢?
电池,又称化学电源:
化学能转化为电能的一种装置。
分类:
一次性使用的电池,一次电池,如,普通干电池;
可以反复充电使用的电池,二次电池,如,手机电池。
[实验]锌铜原电池反应原理
步骤1:
把一块锌片和铜片同时插入盛有稀硫酸的烧杯里。
步骤2:
用导线将锌片和铜片连起来,并接入一个灵敏电流计。
铜片与锌片连接以后:
铜片:
2H++2e-=H2↑发生还原反应,电子流入,电流流出,做正极;
锌片:
Zn-2e-=Zn2+发生氧化反应,电子流出,电流流入,做负极。
我们把这种将化学能转化为电能的装置叫做原电池。
⑴原电池内发生的是何种化学反应?
⑵原电池原理的本质是什么?
⑶锌铜原电池的正负极如何确定?
⑷原电池有哪几部分构成?
1、让氧化还原反应中转移的电子通过导线,形成电流,就构成了原电池;
2、原电池负极发生氧化反应,失去电子,正极发生还原反应,得到电子。
3、原电池的构成:
容器、电解质溶液、两支相互连接着的电极。
练习1、下列关于原电池的叙述正确的是
A.原电池是将化学能转变成电能的装置
B.在原电池中失去电子的一极是阴极
C.原电池的两极一定是由活动性不同的两种金属组成
D.原电池的负极发生的是还原反应
练习2、下列装置属于原电池的是
六、化学反应的快慢及其影响因素
化学反应的快慢,是由物质本身性质决定的。
1、定性表示化学反应的快慢
⑴沉淀的速度单位时间沉淀的多少
⑵颜色变化的速度单位时间色差大小
⑶气体产生速度单位时间气泡多少
⑷质量的变化速度单位时间消耗或生成的物质多小
⑸固体的减少速度单位时间内固体质量变化大小
练习、以盐酸与锌反应为例,关于反应的快慢错误的是
A.如A图所示,1的反应快
B.如B图所示,2的反应快
C.消耗2g锌比消耗1g的反应快
D.产生H2气体体积大的反应快
2、定量表示化学反应的快慢
思考、如何定量表示化学的快慢呢?
用单位时间内反应物量的减少或生成物量的增加来表示。
若单位时间内反应量减少的多,则化学反应快,反之,则化学反应慢;
若单位时间内生成物量增加的多,则化学反应快,反之,则化学反应慢。
3、影响化学反应快慢的因素
思考、下列情况对化学反应速率如何产生影响,原因是什么?
①汽车加大油门;
②向炉堂鼓风;
③用煤粉代替煤块;
④把食物放在冰箱里;
⑤在塑胶中放入搞老化剂;
⑥往过氧化氢中加入MnO2。
⑴浓度对化学反应速率的影响
硫在纯氧、空气中燃烧,哪个反应更剧烈一些?
为什么?
当其它条件不变时,增加反应物的浓度增大反应速率,减小反应物的浓度反应速率减慢。
⑵压强对化学反应速率的影响
如图相同数目的气体分子,哪个浓度大?
其它条件不变的情况下,对于有氧化参加的化学反应来说,增大压强反应速率增大,减小压强反应速率减小。
⑶温度对化学反应速率的影响
为什么夏天食物更容易腐败?
在其它条件不变情况下,升高温度化学反应要加快,降低温度,化学反应减慢。
⑷催化剂对化学反应速率的影响
用过氧化氢制氧气时,为什么要加入MnO2?
其他条件不变的情况下,使用催化剂可以加快化学反应速率。
⑸其它因素
同样材质的木块与木屑,哪个燃烧得更快?
还有光、波、表面积、溶剂等也对化学反应速率产生影响。
①化学反应快慢,是由本身性质决定的;
②外界条件对化学反应速率只能在一定范围内有限地改变,决不能让不可能发生反应的反应发生。
练习1、下列关于化学反应速率的说法不正确的是
A.一定时间内任何一种反应物质量的减少或任何一种生成物质量的增加都可以表示化学反应的快慢
B.化学反应速率表示为0.8g·
s-1是指1s内反应物质量减少0.8g;
C.硝酸银与盐酸反应时,可以根据单位时间内生成沉淀的多少判断化学反应进行的快慢
D.对于任何化学反应来说,反应越快,反应现象就越明显
练习2、下列关于影响化学反应速率的条件说法正确是
A.增大压强一定能加快化学反应速率
B.使用催化剂,一定可以加快化学反应速率
C.浓的过氧化氢产生的氧气一定比稀的过氧化氢快
D.升高温度,一定能加快化学反应速率