芯芯化学选修四总结Word文件下载.docx
《芯芯化学选修四总结Word文件下载.docx》由会员分享,可在线阅读,更多相关《芯芯化学选修四总结Word文件下载.docx(11页珍藏版)》请在冰豆网上搜索。
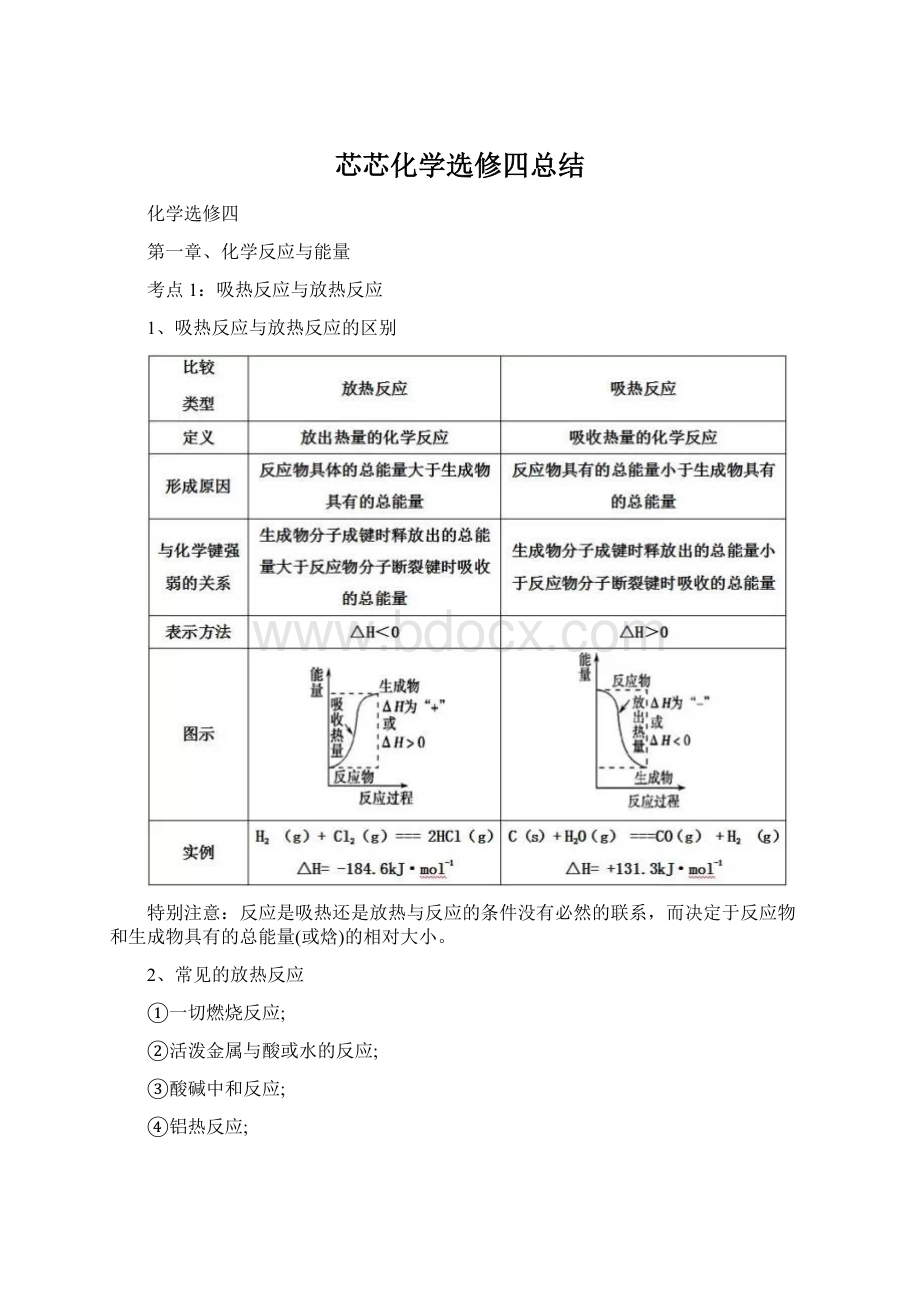
等等也是吸热反应
④水解反应
考点2:
反应热计算的依据
1.根据热化学方程式计算
反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量计算
ΔH=E生成物-E反应物。
3.根据键能计算
ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律计算
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:
①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。
5.根据物质燃烧放热数值计算:
Q(放)=n(可燃物)×
|ΔH|
第2章、化学反应速率与化学平衡
化学反应速率
1、化学反应速率的表示方法
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。
表达式
:
v(A)=△c(A)/△t。
其常用的单位是mol/(L·
s)或mol/(L·
min)。
2、影响化学反应速率的因素
1)内因(主要因素)
反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)
3、理论解释——有效碰撞理论
(1)活化分子、活化能、有效碰撞
①活化分子:
能够发生有效碰撞的分子。
②活化能:
如图
图中:
E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。
(注:
E2为逆反应的活化能)
③有效碰撞:
活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
化学平衡
1、化学平衡状态:
一定条件(恒温、恒容或恒压)下的可逆反应里,正反应和逆反应的速率相等,反应混合物(包括反应物和生成物)中各组分的浓度保持不变的状态。
2、判断化学平衡状态的依据
考点3:
化学平衡的移动
1、概念
可逆反应中旧化学平衡的破坏、新化学平衡的建立,由原平衡状态向新化学平衡状态的转化过程,称为化学平衡的移动。
2、化学平衡移动与化学反应速率的关系
(1)v正>
v逆:
平衡向正反应方向移动。
(2)v正=v逆:
反应达到平衡状态,不发生平衡移动。
(3)v正<
平衡向逆反应方向移动。
3、“惰性气体”对化学平衡的影响
①恒温、恒容条件
原平衡体系体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温、恒压条件
原平衡体系容器容积增大,各反应气体的分压减小―→体系中各组分的浓度同倍数减小
4、勒夏特列原理
定义:
如果改变影响平衡的一个条件(如C、P或T等),平衡就向能够减弱这种改变的方向移动。
原理适用的范围:
已达平衡的体系、所有的平衡状态(如溶解平衡、化学平衡、电离平衡、水解平衡等)和只限于改变影响平衡的一个条件。
勒夏特列原理中“减弱这种改变”的解释:
外界条件改变使平衡发生移动的结果,是减弱对这种条件的改变,而不是抵消这种改变,也就是说:
外界因素对平衡体系的影响占主要方面。
第四章、电化学
原电池
1.概念和反应本质
原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
2.工作原理
以铜锌原电池为例
3.原电池的构成条件
(1)一看反应:
看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(2)二看两电极:
一般是活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:
①电解质溶液;
②两电极直接或间接接触;
③两电极插入电解质溶液。
电解池
1、电解定义
在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
2、能量转化形式
电能转化为化学能。
3、电解池的构成条件
①有与电源相连的两个电极。
②电解质溶液(或熔融盐)。
③形成闭合回路。
4、电解池的电极名称及电极反应式(如图)
5、电子和离子的移动方向
6、电解时电极产物的确定
(1)阳极产物的判断
首先看电极
如果阳极是活性电极(金属活动顺序表Ag以前的金属),则阳极电极材料失电子,电极溶解,溶液中的阴离子不能失电子。
如果是惰性电极(Pt、Au、石墨),则再看溶液中的阴离子的失电子能力。
此时阴离子放电顺序:
活泼电极>
S2->
I->
Br->
Cl->
OH->
含氧酸根离子。
(2)阴极产物判断
阳离子放电顺序:
Ag+>
Fe3+>
Cu2+>
H+(酸)>
Fe2+>
Zn2+>
H+(水)>
Al3+>
Mg2+>
Na+>
Ca2+>
K+
7、电解不同溶液的情况对比
8、电解池的应用
1)电解饱和食盐水
(1)电极反应
阳极反应式:
2Cl--2e-===Cl2↑(氧化反应)
阴极反应式:
2H++2e-===H2↑(还原反应)
(2)应用:
氯碱工业制烧碱、氯气和氢气。
2)电镀
以金属表面镀银为例
(1)镀件作阴极,镀层金属银作阳极。
(2)电解质溶液是AgNO3溶液等含镀层金属阳离子的盐溶液。
(3)电极反应:
阳极:
Ag-e-===Ag+;
阴极:
Ag++e-===Ag。
(4)特点:
阳极溶解,阴极沉积,电镀液的浓度不变。
3)电解精炼铜
(1)电极材料:
阳极为粗铜;
阴极为纯铜。
(2)电解质溶液:
含Cu2+的盐溶液。
Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+、Cu-2e-===Cu2+;
Cu2++2e-===Cu。
4)电冶金
利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等。
(1)冶炼钠
电极反应:
2Cl--2e-===Cl2↑;
2Na++2e-===2Na。
(2)冶炼铝
6O2--12e-===3O2↑;
4Al3++12e-===4Al。
金属的腐蚀和保护
1.金属腐蚀的本质
金属原子失去电子变为金属阳离子,金属发生氧化反应。
2.金属腐蚀的类型
(1)化学腐蚀与电化学腐蚀
(2)析氢腐蚀与吸氧腐蚀
以钢铁的腐蚀为例进行分析:
3.金属的防护
(1)电化学防护
①牺牲阳极的阴极保护法—原电池原理
a.负极:
比被保护金属活泼的金属;
b.正极:
被保护的金属设备。
②外加电流的阴极保护法—电解原理
a.阴极:
被保护的金属设备;
b.阳极:
惰性金属。
(2)改变金属的内部结构,如制成合金、不锈钢等。
(3)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。