高考化学真题与模拟类编专题10水溶液中的离子平衡含答案Word文档下载推荐.docx
《高考化学真题与模拟类编专题10水溶液中的离子平衡含答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《高考化学真题与模拟类编专题10水溶液中的离子平衡含答案Word文档下载推荐.docx(25页珍藏版)》请在冰豆网上搜索。
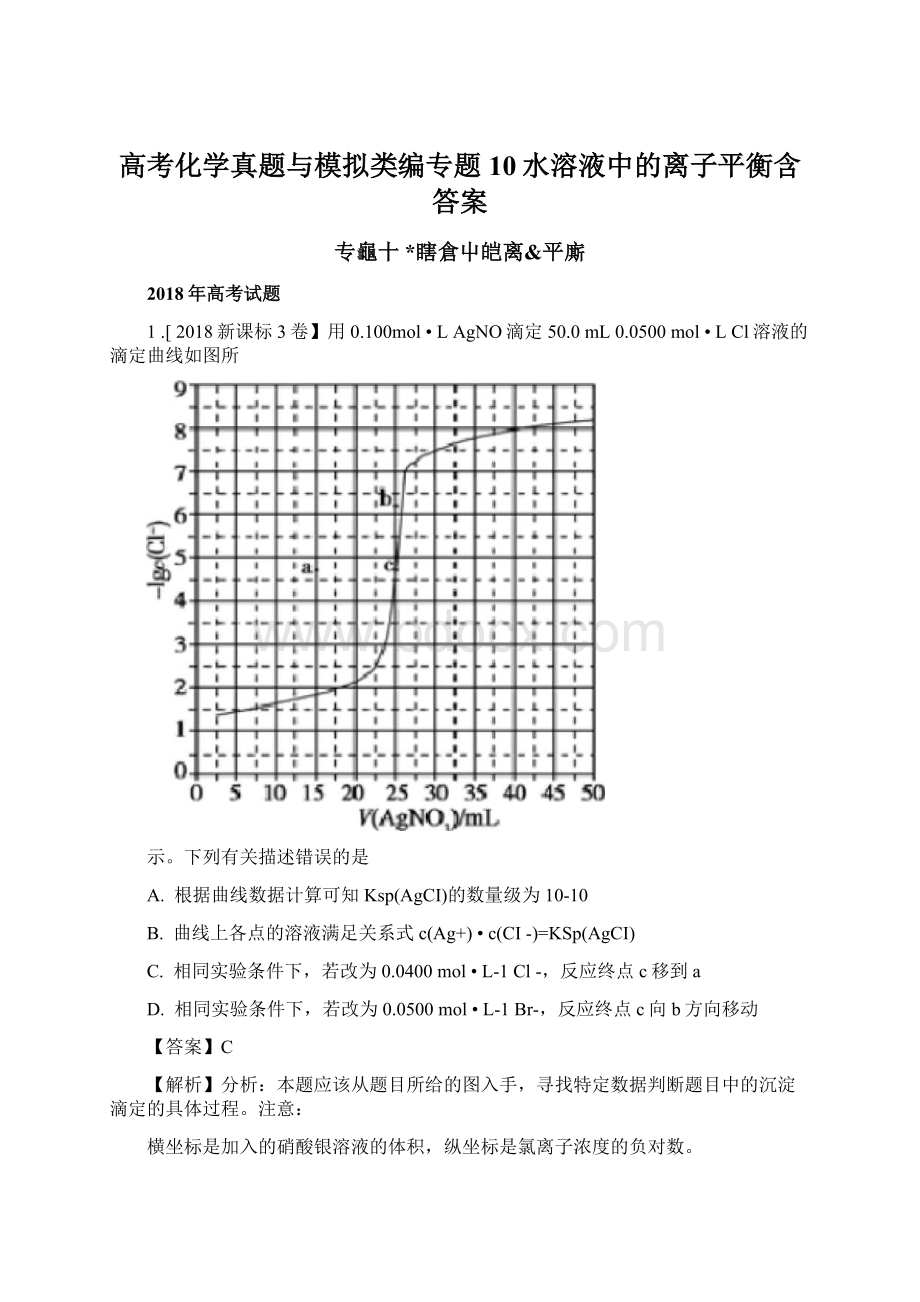
本题虽然选择了一个学生不太熟悉的滴定过程一一沉淀滴定,但是其内在原理实际和酸碱中和滴定
是一样的。
这种滴定的理论终点都应该是恰好反应的点,酸碱中和滴定是酸碱恰好中和,沉淀滴定就
是恰好沉淀,这样就能判断溶液发生改变的时候,滴定终点如何变化了。
2.【2018北京卷】测定0.1mol•L-1NazSO溶液先升温再降温过程中的pH,数据如下。
时刻
①
②
③
④
温度/C
25
30
40
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCb溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A.N&
SQ溶液中存在水解平衡:
区丐]+H2O'
」$°
d+OH
B.④的pH与①不同,是由于险5J浓度减小造成的
C.①t③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的Kw值相等
A项,N&
SQ属于强碱弱酸盐,SQ2-存在水解平衡;
B项,取①④时刻的溶液,加入盐酸酸化的BaCb溶液做对比实验,④产生白色沉淀多,说明实验过程中部分NqSQ被氧化成N@SQ,①与④
温度相同,④与①对比,SQ-浓度减小,溶液中c(QH),④的pH小于①;
C项,盐类水解为吸热过程,
①t③的过程,升高温度SQ2-水解平衡正向移动,c(SQ2-)减小,水解平衡逆向移动;
D项,Kw只与
温度有关。
A项,Na2SQ属于强碱弱酸盐,SQ2-存在水解平衡:
SQ2-+H^=HSQ+QH、HSQ+H^^HSQ+QH,
A项正确;
B项,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多,说
明实验过程中部分NS2SO被氧化成NstSQ,①与④温度相同,④与①对比,SO2-浓度减小,溶液中c(OH),
2
④的pH小于①,即④的pH与①不同,是由于SO-浓度减小造成的,B项正确;
C项,盐类水解为吸热过程,①t③的过程,升高温度SO2-水解平衡正向移动,c(SO2-)减小,水解平衡逆向移动,温度和
浓度对水解平衡移动方向的影响相反,C项错误;
D项,Kw只与温度有关,①与④温度相同,&
值相等;
答案选Co
本题考查盐类水解离子方程式的书写、外界条件对盐类水解平衡的影响、影响水的离子积的因素、
SO2-的还原性。
解题时注意从温度和浓度两个角度进行分析。
3.【2018天津卷】LiH2PO4是制备电池的重要原料。
室温下,LiHzPQ溶液的pH随c初始(HbPQ-)的变化如
图1所示,HPQ溶液中H2PO「的分布分数3随pH的变化如图2所示,£
总匚含卩元素的粒子)下列有关LiHzPQ溶液的叙述正确的是
A.溶液中存在3个平衡
B.含P元素的粒子有"
PQ-、HPG2-、PO3-
C.随C初始(HPQ-)增大,溶液的pH明显变小
.■1
D.用浓度大于1mol•L的HPQ溶液溶解Li2CQ,当pH达到4.66时,HPQ几乎全部转化为LiHzPQ
【答案】D
本题考查电解质溶液的相关知识。
应该从题目的两个图入手,结合磷酸的基本性质进行分
析。
A.溥濺中存在HPOT的电宫平鞠口水解平衡,存在HP6"
的电寓平衡「存在水的电离平衡,
所以至少存在4个平衡.选项A错误。
含P元素的粒子有ttPOT、HPW、和圧P5°
选B错误。
C.从图1中得到随着Q硏(HjPOT)増犬厂滚渝的田不过从门顺小到4-瓯谈不上明显变小,同
时达到斗■師的pH值以后就不娈了o所以选顷C错误o
D.由图2得到,pH=4.66的时候,3=0.994,即溶液中所有含P的成分中HPQ-占99.4%,所以此时HPQ
几乎全部转化为LiH2PQ。
选项D正确。
本题中随着c初始(HPQ-)增大,溶液的pH有一定的下降,但是达到一定程度后就基本不变了。
主
要是因为H2PQ4-存在电离和水解,浓度增大电离和水解都会增加,影响会互相抵消。
4.【2018天津卷】下列叙述正确的是
A.某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小
B.铁管镀锌层局部破损后,铁管仍不易生锈
C.反应活化能越高,该反应越易进行
D.不能用红外光谱区分C2HOH和CHQCH
【答案】B
本题是对化学理论进行的综合考查,需要对每一个选项的理论表述进行分析,转化为对应
的化学原理,进行判断。
佯律A.相拥『迤弱越水解玛的愿理,ha的花握卜代表HA極弱,所以直的水解越强,应该是NaA的水解常数)越大。
选顶A错误。
B.铁管镀锌层局削破损后,形成蒔辛册电池』因为锌比铁活濒』所以锌为员根』对正极卡罐到了保护作用,延缓了铁管的橋蚀。
迭总正确。
C.厦应的活化育豳高’该反应进行的应该是越困难(可以简单理解为霜要幅翻越鬥的山峰越高,飜越”越困难/选项C错误。
D.红外光谱是用来检测有机物中的官能团或特定结构的,C2H5QH和CHOCH的官能团明显有较大差异,
所以可以用红外光谱区分,选项D错误。
反应的活化能是指普通分子达到活化分子需要提高的能量,则活化能越大,说明反应物分子需要吸
收的能量越高(即,引发反应需要的能量越高),所以活化能越大,反应进行的就越困难。
从另一个角
度理解,课本中表述为,活化能越大,反应的速率应该越慢,这样也可以认为活化能越大,反应越困
难。
5.【2018江苏卷】根据下列图示所得出的结论不正确的是
A.图甲是CO(g)+fO(g)^=CQ(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的AH<
B.图乙是室温下H2Q催化分解放出氧气的反应中c(H2Q)随反应时间变化的曲线,说明随着反应的进
行HC2分解速率逐渐减小
C.图丙是室温下用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1某一元酸HX的滴定曲线,
说明HX是一元强酸
D.图丁是室温下用NqSQ除去溶液中Ba2^到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系曲线,说明溶液中c(SO42-)越大c(Ba2+)越小
A项,升高温度,lgK减小,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反
应,该反应的厶匚。
;
B项,根据图像,随着时间的推移,c(HaQ)变化趋于平缓,随着反应的进行
H2Q分解速率逐渐减小;
C项,根据图像,没有滴入NaOH溶液时,0.1000mol/LHX溶液的p—1,HX
为一元弱酸;
D项,根据图像可见横坐标越小,纵坐标越大,-lgc(SQ2-)越小,-lgc(Ba2+)越大,
22+
说明c(SQ-)越大c(Ba)越小。
A项,升高温度」廊减小,平衡向逆反应方向移动.逆反应为吸热反应,正反应为放热反应'
该反应的AH<
0,A项正确$BI巫根拯團像』随看时间的推移,<
(耳。
)变化超于平缓』随看反应的逬行吐6分解速率逐渐减儿B项正确i粗据團像』没有滴入NaOH溶港时,0.100taol/LHX
熔濟的pH>
l7HX为一元弱酸,口页错误;
D项『根拯團像可见横坐标越小,纵坐标越大『T餉〔口旷)越小,-1即(时〉越大』说明c(SO<
^)越尢c越小,D项正确」答案选Co
本题考查图像的分析,侧重考查温度对化学平衡常数的影响、化学反应速率、酸碱中和滴定pH曲线
的分析、沉淀溶解平衡曲线的分析,掌握有关的原理,明确图像中纵、横坐标的含义和曲线的变化趋势是解题的关键。
6.【2018江苏卷】H2C2Q为二元弱酸,Ka1(H2C2C4)=5.4X10-2,心(H2C2Q)=5.4X10-5,设H2C2Q溶液中
21
c(总)=c(H2C2C4)+c(HC2C4-)+c(C2C4-)。
室温下用NaOH溶液滴定25.00mL0.1000mol•L-HGC4溶液至
终点。
滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
-1、、+-12--
A.0.1000mol•LH2C2O4溶液:
c(H)=0.1000mol•L+C(C2O)+qOH)-C(H2QO)
B.c(Na+)=c(总)的溶液:
c(Na+)>
c(H2C2O4)>
c(C2Q2-)>
c(H+)
C.pH=7的溶液:
c(Na+)=0.1000mol•L-1+c(C2O2-)-c(H2GO)
D.c(Na+)=2c(总)的溶液:
c(OH)-c(H+)=2c(H2C2O4)+c(HC2O4-)
【答案】AD
A顼,HiGOi溥逾中的电荷守恒为c(hr}=c(HCJa-)+-2c(C3O|2-)-^(Otr)J0.1000md*L
・LHiGCn潯滿中0-1000ftidl/r=c(HsCiOk)+MHGCV”,两式整理得&
H*)=0_lOOOmol/r-c
Y〔QdO乜(OtT);
BJ页小(Na)y(总)时潯液中溶质为NiHCjOi,既存在
电囱平衡又存在水解匚衝,HCMU冰解的离子方程式为HC^+HiOHaCiOi-NDH-,HGOf水睥當u(HGOJ兰(OH〉u(HqQQQ-u〔0片)-匚(附)
数3C(HC1O4J
=C恥处MH)=K11說皿二;
:
爲-八妙叩g
(ftGOi”HCaOiK电离程度大于水解程度』则cCQW)帀(曲GQhC项』滴人NaQH;
§
^后,
溶液中的电荷守恒^c(N巧址(H7)=<
<
HC2<
\)+2c〈QW)+c(OIF),室温pH=7即c(H*)=c
(50,则c(Na*>
=c(HG3)+2v(GOT》n(总)+c(GWJ-c(H1GO1),由于溥瀏麴?
变Aic(总)<
0.lOQOmol/LjD项』c(Na-)=2c(总)时滚液中瀋质为皿Qg滚液中的电荷守恒为c(Na*)+c(H)之(HCdCV)斗加CGOZ)+c<
OK);
物料守恒为c(Na"
)=2[c(HaGd)HGOO
十c(CjCM2-)b两或整理得c(QIT)c(R)=2c(H2C2O4)光〈HQCMS
+21
A项,H2GO溶液中的电荷守恒为c(H)=c(HCQ-)+2c(GO-)+c(OH),0.1000mol•L-H2GO
2+
溶液中0.1000mol/L=c(H2C2Q4)+c(HCQ-)+c(C2O4-),两式整理得c(H)=0.1000mol/L-c(H2C2Q4)
+c(C2Q)+c(OH),A项正确;
B项,c(Na)=c(总)时溶液中溶质为NaHGQ,HCQ-既存在电离平
c(H;
CjO4)*c(OH)
c(HgQjOJ■cCOH)-c(H-)
1x1014
=c(HCQCMIT)=
k」i旧角O4)
?
4xID
衡又存在水解平衡,HCO-水解的离子方程式为HCO-+HO^=H2C2O+OH,HCO-水解常数
=1.85一10-13一
Ka2(HGO),HCO-的电离程度大于水解程度,则c(C2O2-)一c(H2GO),B项错误;
C项,滴入NaOH
溶液后,溶液中的电荷守恒为c(Nh)+c(H+)=c(HCO-)+2c(C2O42-)+c(OH),室温pH=7即c(H+)
=c(OH),贝yc(Na)=c(HCO-)+2c(GO-)=c(总)+c(GO-)-c(H2GO),由于溶液体积变大,
c(总)_0.1000mol/L,c(Na^J0.1000mol/L+c(C2O42-)-c(H2C2Q),C项错误;
D项,c(Nai)
++2
=2c(总)时溶液中溶质为NqGO,溶液中的电荷守恒为c(Na)+c(H)=c(HCO-)+2c(GQ-)+c
(OH),物料守恒为c(Na+)=2[c(HGO)+c(HGO-)+c(GO2-)],两式整理得c(OH)-c(H+)
=2c(HOO)+c(HGO-),D项正确;
答案选AD
本题考查溶液中粒子浓度的大小关系。
确定溶液中粒子浓度大小关系时,先确定溶质的组成,分析
溶液中存在的平衡,弄清主次(如B项),巧用电荷守恒、物料守恒和质子守恒(质子守恒一般可由电荷守恒和物料守恒推出)。
注意加入NaOH溶液后,由于溶液体积变大,c(总)||0.1000mol/L。
2018届高考模拟试题
t*1
7.【2018届扬州市三模】向湿法炼锌的电解液中同时加入Cu和CuSO,可生成CuCl沉淀除去Cl—,降低对
电解的影响,反应原理如下:
2++-1
Cu(s)+Cu(aq)2Cu(aq)AH=akJ•mol
+1
Cl(aq)+Cu(aq)CuCl(s)A-2=bkJ•mol-
实验测得电解液pH对溶液中残留c(Cl_)的影响如图所示。
下列说法正确的是
7
2O〔■-I电卿一
A.向电解液中加入稀硫酸,有利于Cl的去除
B.溶液pH越大,Ksp(CuCI)增大
C.反应达到平衡增大c(Cu2+),c(Cl—)减小
丄丄2+1
D.Cu(s)+Cu(aq)+CI(aq)CuCI(s)的△!
■!
=(a+2b)kJ•mo「
A.根据图像分析pH与氯离子浓度的关系;
B.根据溶度积常数只与温度有关系;
C.根据外界条件对平衡的影响分析;
D.根据盖斯定律计算。
A.根据图像,溶液的pH越小,溶液中残留c(Cl—)越大,因此向电解液中加入稀硫酸,不利于
Cl-的去除,A错误;
B.Ksp(CuCI)只与温度有关,与溶液pH无关,B错误;
2++2++
C.根据Cu(s)+Cu(aq)=-2Cu(aq)可知增大c(Cu),平衡正向移动,使得c(Cu)增大,促进
Cl—(aq)+Cu+(aq)CuCI(s)右移,c(CI—)减小,C正确;
D.已知①Cu(s)+Cu2+(aq)2Cu+(aq)AH=akJ•mol-1,②Cl(aq)+Cu+(aq)CuCI(s)AI-2=b
—
kJ•mol-1,根据盖斯定律,将①x1/2+②得反应Cu(s)+CiT(aq)+CI(aq)=_CuCI(s)的AH=
(a/2+b)kJ•mol-1,D错误;
答案选C。
8.【2018届厦门外国语学校三模】室温下,某二元碱X(0H)2水溶液中相关组分的物质的量分数随溶液pH
变化的曲线如图所示,下列说法错误的是
&
『a9io11
A.K.2的数量级为10-8
B.X(OH)NO水溶液显碱性
C.等物质的量的X(NQ)2和X(OH)NO混合溶液中c(X2+)>
c[X(OH)+]
D.在X(OH)NO水溶液中,C[X(OH)2]+c(OH'
)=c(X)+c(H)
本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分
析图示时要随时注意考查的是多元碱的分步电离。
佯解:
A.选取團中左侧的交点数拐,此时,pH-6.2;
c[X(OH^=c(.^,所以
=cQOn~}=1旷〔1—巧^10TB=1.58丸1旷豊选1页A正确s
B.X(OH)NO3中X的主要存在形式为X(OW,由图示X(OH)*占主导位置时,pH为7到?
之间,诘液显减性』选项B正确。
C.等物质的量的X(NO3)^nX(OH)NO5混合熔液中£
盼和cfXCOH)*]近似相等,根据固示此时滚
液的pH约为®
所以溶濟显釀性X「的水解占主导「所以此时选项C错误a
D.在X(OH)NO水溶液中,有电荷守恒:
C(NQ-)+C(OHJ=2c(X2+)+c(H+)+c[X(OH)]+,物料守恒:
C(NO-)=C(X2+)+c[X(OH)2]+c[X(OH)]+,将物料守恒带入电荷守恒,将硝酸根离子的浓度消去,得到该溶
2++
液的质子守恒式为:
C[X(OH)2]+c(OHj=C(X)+C(H)。
__一1—1
9.【2018届莆田市二模B卷】向10mL1mol•L的HCOO溶液中不断滴加1mol•L的NaOH溶液,并一
直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。
c水(H+)为溶液中水电离的c(H+)。
下列说
常温下,Ka(HCOOH的数量级为10-4
A.
法不正确的是
B.a、b两点pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
A.根据起始时甲酸溶液中水电离出的氢离子为10一12mol/L计算;
B.根据a、b溶液中的溶质判断;
C.根据酸碱盐对水电离平衡的影响分析;
D.根据影响溶液导电性的因素分析。
徉解:
A.申酸潯液中水电嵩出的氢离子为lOFinol/L,则溶械中氢离子浓度为O.MinolL所決常温口JUHOOOHU号曇二iL,因此数量级为10'
S査正确;
B.圮点甲釀过童,水电离出的氢离子为1旷'
iiiolZU濬潘b点氢氧化钠过量,pH>
7,
UAU直到b点』溶港中的滝质由甲釀和甲酸钠变対甲酸钠,然后又变対甲酸钠和钠』所以水的电离程度先増大后減小,cie确;
D.溶液的导电能力强弱取决于溶液中离子浓度的大小和离子所带电荷的多少,离子浓度越大,离子所
带的电荷越多,溶液的导电性越强。
甲酸是弱酸,生成的甲酸钠以及氢氧化钠均是强电解质,所以混
合溶液的导电性逐渐增强,D正确。
答案选Bo
10.[2018届莆田市二模】常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度
变化的关系如下图所示,下列有关说法错误的是
【解析】详解:
A.随着pH的增大,H2Y的电离程度逐渐增大,溶液中
逐渐增大,
(HY)
逐渐减小,
【答案】
lg逐渐增大,lg
(HY
逐渐减小,因此曲线M表示pH与的关系,故A正确;
B•吕点濬濟中存在电荷守恒:
£
耐)址90=肚怦・)+"
时曲9页),因此c«
r)-<
tOK)=2c(r
—眞K)故B正确j
C.州》时」器牛13则血(压丫)二驾笄耳箸i(rq故c正陽
D.交点b的溶潘中存曲因此需詩>
23即只厂)5(时),故D错误;
综台臥上分析,本题选6
11.【2018届黄冈中学三模】下列有关电解质溶液的说法正确的是()
11
A.10mL0.1mol•LNstCO溶液逐滴滴加到10mL0.1mol•L盐酸中,混合溶液中各离子浓度的大小关系:
c(Na+)>
c(CI-)>
c(HCO3-)>
c(CO32-)
B.NHHCO溶液中存在:
C(NH4)=C(HCO-)+C(CO3-)+C(H2CG)
C.常温下,测得某纯CaSO与水形成的浊液pH为9,已知Ka1(H2SO)=1.8X10-,K^NSO)=6.0X10-,忽略SO2-的第二步水解,则K^CaSQ)=3.6X10-10
D.若两种盐溶液的浓度相同且pH(NaX)>
pH(NaY),贝Uc(X「)+c(OH「)vc(Y「)+c(OH「)
A中考察碳酸钠溶液滴加到盐酸中生成氯化钠和二氧化碳;
B中主要考察水解的盐溶液中存
在的物料守恒规律,注意铵根离子、碳酸氢根离子均能发生水解;
C中先计算出亚硫酸根离子的水解平
衡常数,再计算出溶液中钙离子和亚硫酸根离子浓度,然后根据Ksp(CaSQ)进行近似计算;
D根据两种
盐的水解程度不同,水解能力强的,溶液的碱性强,氢离子浓度小,然后利用电荷守恒规律进行解析。
W:
ILOmLO.lmol-L^N^COi溶酒逐滴滴力倒TOmLO.I