版5年高考3年模拟人教新课标版高考化学专题九 水的电离和溶液酸碱性Word下载.docx
《版5年高考3年模拟人教新课标版高考化学专题九 水的电离和溶液酸碱性Word下载.docx》由会员分享,可在线阅读,更多相关《版5年高考3年模拟人教新课标版高考化学专题九 水的电离和溶液酸碱性Word下载.docx(21页珍藏版)》请在冰豆网上搜索。
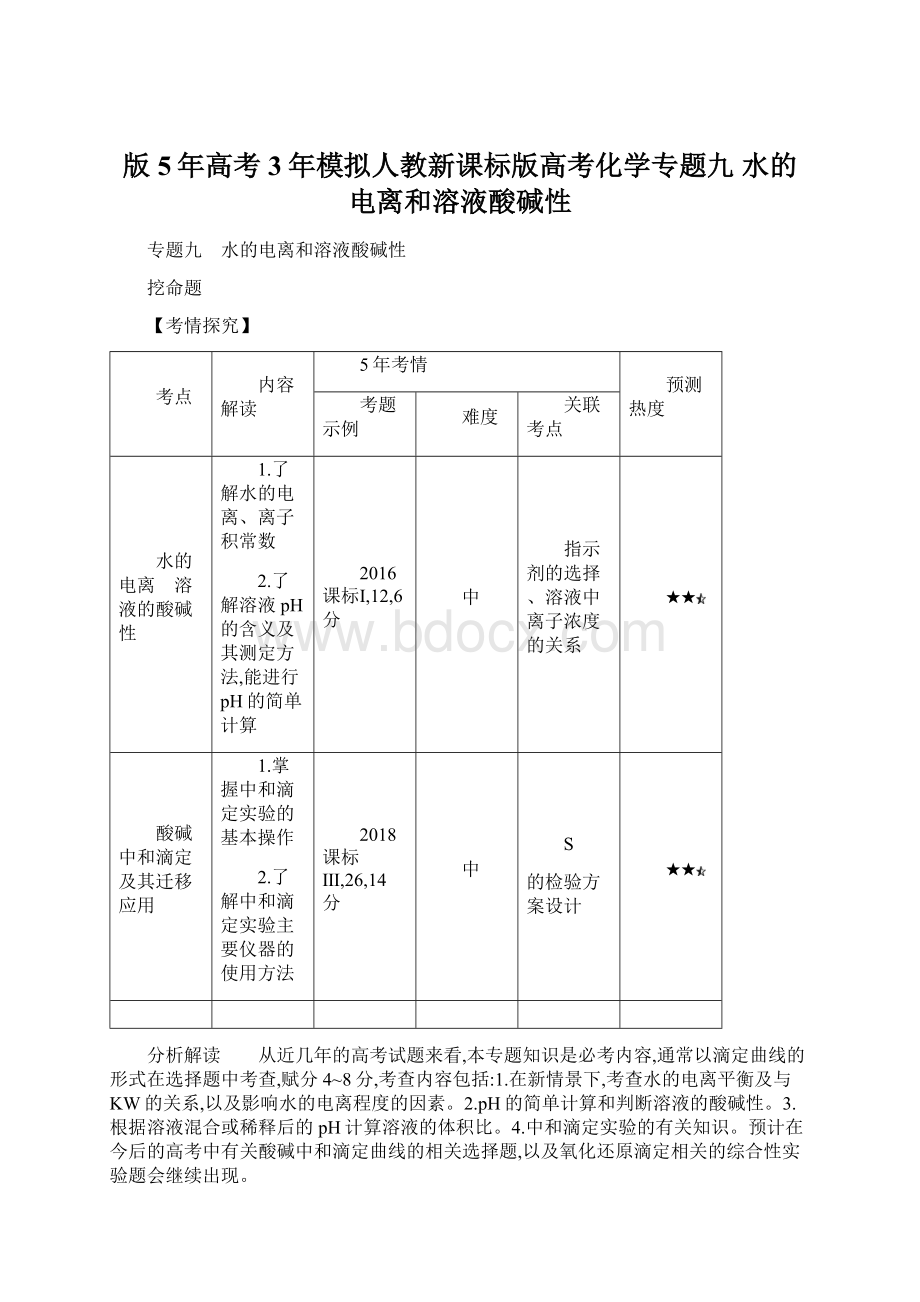
D.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
答案 D
2.(2019届辽宁六校协作体期初联考,14)已知100℃时,水的离子积常数KW=1×
10-12。
对于该温度下pH=11的氨水,下列叙述正确的是( )
A.向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B.温度降至25℃,该氨水中H2O电离出的H+浓度小于10-11mol/L
C.该氨水中加入NH4Cl溶液,NH3·
H2O的电离程度增强
D.滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:
NH4HSO4(aq)
N
(aq)+H+(aq)+S
(aq)
答案 B
3.(2018河南洛阳第一次统考,13)能影响水的电离平衡,并使溶液中的c(H+)>
c(OH-)的措施是( )
A.向水中通入SO2
B.将水加热煮沸
C.向纯水中投入一小块金属钠
D.向水中加入NaCl
答案 A
4.(2018湖北鄂东南省级示范高中联盟学校联考,14)下列说法中正确的是( )
A.NaHSO4和NaHSO3都属于酸式盐,二者不发生反应
B.95℃纯水的pH<
7,说明加热可导致水呈酸性
C.在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4,使之转化为疏松、易溶于酸的CaCO3
D.中和100mLpH=1的醋酸溶液和100mLpH=1的盐酸所消耗的NaOH的物质的量相等
答案 C
5.(2017河南南阳等六市联考,13)某温度下,向一定体积0.1mol·
L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示。
下列说法不正确的是( )
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(N
)+c(NH3·
H2O)=c(Cl-)
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,
变小
考点二 酸碱中和滴定及其迁移应用
1.(2019届四川顶级名校入学考试,6)下列实验误差分析错误的是( )
A.用湿润的pH试纸测某稀碱性溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
2.(2018湖北部分重点中学联考,7)常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是( )
A.滴定过程的任何时刻都存在:
c(H+)+c(Na+)=c(OH-)+c(Cl-)
B.曲线b是氢氧化钠溶液滴定盐酸的滴定曲线
C.氢氧化钠溶液的溶质物质的量浓度为0.1mol·
L-1
D.P点时恰好完全中和,溶液呈中性
3.(2018河南天一大联考阶段检测五,13)室温时,用0.0200mol·
L-1稀盐酸滴定20.00mL0.0200mol·
L-1NaY溶液,溶液中水的电离程度随所加稀盐酸体积的变化曲线如图所示(忽略滴定过程中溶液的体积变化),则下列有关说法中正确的是[已知:
K(HY)=5.0×
10-11]( )
A.可选择酚酞作为滴定指示剂
B.M点溶液的pH>
7
C.图中Q点水的电离程度最小,KW<
10-14
D.M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
4.(2018河北石家庄一模,13)常温下,向20.00mL0.1mol·
L-1HA溶液中滴入0.1mol·
L-1NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示。
下列说法中不正确的是( )
A.常温下,Ka(HA)约为10-5
B.M、P两点溶液对应的pH=7
C.b=20.00
D.M点后溶液中均存在c(Na+)>
c(A-)
炼技法
方法集训
方法 溶液pH的计算方法
1.(2017天津和平期末,10)一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中:
c(H+)=c(HS-)=1×
10-5mol/L
B.稀释氨水至原体积的10倍后,其c(OH-)为原来的
C.pH之和为14的H2C2O4与NaOH溶液混合:
c(Na+)+c(H+)=c(OH-)+c(HC2
D.将等物质的量的Na2CO3和NaHCO3混合溶于水中:
<
1
2.(2018陕西西安长安一中六检,15)某温度时,测得0.01mol·
L-1的NaOH溶液的pH=11,下列说法错误的是( )
A.该温度下水的离子积常数KW=10-13
B.该温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合,所得溶液为中性,若a=12,b=2,则Va∶Vb=1∶10
C.该温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合,所得溶液为中性,若a+b=12,则Va∶Vb=10∶1
D.该温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合,所得溶液为中性,若Va∶Vb=100∶1,则a+b=10
3.(2017山东师大附中三模,13)常温下,下列叙述正确的是( )
A.pH=a的氨水,稀释至10倍后,其pH=b,则a=b+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl溶液至恰好无色,则此时溶液的pH<
C.向10mL0.1mol·
L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,
将减小
D.向10mLpH=11的氨水中加入10mLpH=3的H2SO4溶液,所得混合液的pH=7
过专题
【五年高考】
A组 统一命题·
课标卷题组
(2016课标Ⅰ,12,6分)298K时,在20.0mL0.10mol·
L-1氨水中滴入0.10mol·
L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
已知0.10mol·
L-1氨水的电离度为1.32%,下列有关叙述正确的是 ( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(N
)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<
12
B组 自主命题·
省(区、市)卷题组
1.(2015广东理综,11,4分)一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×
10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
2.(2015重庆理综,3,6分)下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25℃时,0.1mol·
L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
3.(2018江苏单科,13,4分)根据下列图示所得出的结论不正确的是( )
A.图甲是CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000mol·
L-1NaOH溶液滴定20.00mL0.1000mol·
L-1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(S
)的关系曲线,说明溶液中c(S
)越大c(Ba2+)越小
4.(2016天津理综,6,6分)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·
L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:
KHA>
KHB>
KHD
B.滴定至P点时,溶液中:
c(B-)>
c(Na+)>
c(HB)>
c(H+)>
c(OH-)
C.pH=7时,三种溶液中:
c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:
c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
5.(2015广东理综,12,4分)准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·
L-1NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
6.(2017天津理综,9,18分)用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100mL0.1000mol·
L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.加入25.00mL0.1000mol·
L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000mol·
L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。
三次测定数据如下表:
实验序号
2
3
消耗NH4SCN标准溶液体积/mL
10.24
10.02
9.98
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有 。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是 。
(3)滴定应在pH<
0.5的条件下进行,其原因是 。
(4)b和c两步操作是否可以颠倒 ,说明理由
。
(5)所消耗的NH4SCN标准溶液平均体积为 mL,测得c(I-)= mol·
L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为 。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果 。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果 。
答案 (18分)
(1)250mL(棕色)容量瓶、胶头滴管
(2)避免AgNO3见光分解
(3)防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解)
(4)否(或不能) 若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点
(5)10.00 0.0600
(6)用NH4SCN标准溶液进行润洗
(7)偏高 偏高
7.(2015山东理综,31,19分)毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·
2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是 。
实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯b.容量瓶c.玻璃棒d.滴定管
(2)加入NH3·
H2O调pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。
加入H2C2O4时应避免过量,原因是 。
已知:
Ksp(BaC2O4)=1.6×
10-7,Ksp(CaC2O4)=2.3×
10-9
Ca2+
Mg2+
Fe3+
开始沉淀时的pH
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.1
3.2
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
2Cr
+2H+
Cr2
+H2O Ba2++Cr
BaCrO4↓
步骤Ⅰ:
移取xmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·
L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL。
步骤Ⅱ:
移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·
L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。
BaCl2溶液的浓度为 mol·
若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
答案
(1)增大接触面积从而使反应速率加快 a、c
(2)Fe3+ Mg(OH)2、Ca(OH)2 H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少
(3)上方
偏大
C组 教师专用题组
1.(2013天津理综,5,6分)下列有关电解质溶液的说法正确的是 ( )
A.在蒸馏水中滴加浓H2SO4,KW不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
2.(2013山东理综,13,4分)某温度下,向一定体积0.1mol·
L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )
A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>
c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
3.(2013大纲全国,12,6分)下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)×
c(OH-)=KW
B.M区域内任意点均有c(H+)<
C.图中T1<
T2
D.XZ线上任意点均有pH=7
4.(2013课标Ⅱ,13,6分)室温时,M(OH)2(s)
M2+(aq)+2OH-(aq) Ksp=a。
c(M2+)=bmol·
L-1时,溶液的pH等于( )
A.
lg(
)B.
C.14+
lg(
)D.14+
5.(2014山东理综,13,5分)已知某温度下CH3COOH和NH3·
H2O的电离常数相等,现向10mL浓度为
0.1mol·
L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(N
)=c(CH3COO-)
6.(2014四川理综,6,6分)下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:
)>
c(HC
B.20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中:
c(CH3COO-)>
c(Cl-)>
c(CH3COOH)>
c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:
c(Cl-)+c(H+)>
c(N
)+c(OH-)
D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:
c(OH-)>
c(H+)+c(CH3COOH)
7.(2014重庆理综,9,15分)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g·
某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
图1
(1)仪器A的名称是 ,水通入A的进口为 。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为
。
(3)除去C中过量的H2O2,然后用0.0900mol·
L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ;
若滴定终点时溶液的pH=8.8,则选择的指示剂为 ;
若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号) (①=10mL,②=40mL,③<
10mL,④>
40mL)。
图2
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:
g·
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施
。
答案
(1)冷凝管或冷凝器 b
(2)SO2+H2O2
H2SO4
(3)③ 酚酞 ④
(4)0.24
(5)原因:
盐酸的挥发;
改进措施:
用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响
【三年模拟】
一、选择题(每题6分,共54分)
1.(2017江西红色七校一联,3)用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
2.[2018陕西渭南质量检测(Ⅰ),12]下列说法中不正确的是( )
A.常温下用pH=3的某酸溶液与pH=11的某碱溶液等体积混合,若混合溶液的pH=4,则反应生成的盐可能为强碱弱酸盐
B.石灰乳中存在下列平衡:
Ca(OH)2(s)
Ca2+(aq)+2OH-(aq),恒温条件下,向石灰乳中加入少量生石灰时,pH增大
C.常温下pH=4的NH4Cl溶液和盐酸,由水电离的氢离子的浓度的比为106∶1
D.常温下将0.1mol·
L-1的醋酸溶液加水稀释,溶液中c(CH3COO-)/c(CH3COOH)的值增大
3.(2019届安徽皖中地区摸底,10)室温下,向10mLpH=3的CH3COOH溶液中加入下列物质,对所得溶液的分析正确的是( )
选项
加入的物质
对所得溶液的分析
A
90mLH2O
由水电离出的c(H+)=10-10mol·
B
0.1molCH3COONa固体
c(OH-)比原CH3COOH溶液中的大
C
10mLpH=1的H2SO4溶液
CH3COOH的电离程度不变
D
10mLpH=11的NaOH溶液
c(Na+)=c(CH3COO-)>
c(OH-)=c(H+)
4.(2019届河南顶级名校二联,14)常温下,向20mL0.010mol·
L-1的HA溶液中逐滴加入0.010mol·
L-1的NaOH溶液,溶液中lg
与所加NaOH溶液的体积的关系如图所示。
A.常温下,Ka(HA)≈1.0×
10-6
B.N点溶液中存在:
c(Na+)+c(H+)=c(A-)+c(OH-)
C.P点后的溶液中均存在:
c(A-)>
D.水的电离程度:
M<
N<
P
5.(2019届安徽合肥调研,13)浓度均为0.1mol·
L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积为V,pH随lg
的变化关系如图所示。
下列叙述正确的是( )
A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.相同温度下,电离常数K(HX):
a>
b
C.常温下,由水电离出的c(H+)·
c(OH-):
a<
D.lg
=3,若同时微热两种溶液,则
减小
6.(2018江西西路片七校一联,9)下列叙述正确的是( )
A.某溶液的pH=7,则该溶液为中性溶液
B.一定温度下,向AgCl饱和溶液中加入少量NaCl固体,Ksp(AgCl)减小
C.常温下,反应X(s)+Y(l)
2Z(g)不能自发进行,则该反应的ΔH>
D.常温下,0.01mol·
L-1的NaOH溶液中由水电离的c(H+)=1.0×
10-2mol·
7.(2017湖北四地