中考化学压轴试题汇编推断题文档格式.docx
《中考化学压轴试题汇编推断题文档格式.docx》由会员分享,可在线阅读,更多相关《中考化学压轴试题汇编推断题文档格式.docx(10页珍藏版)》请在冰豆网上搜索。
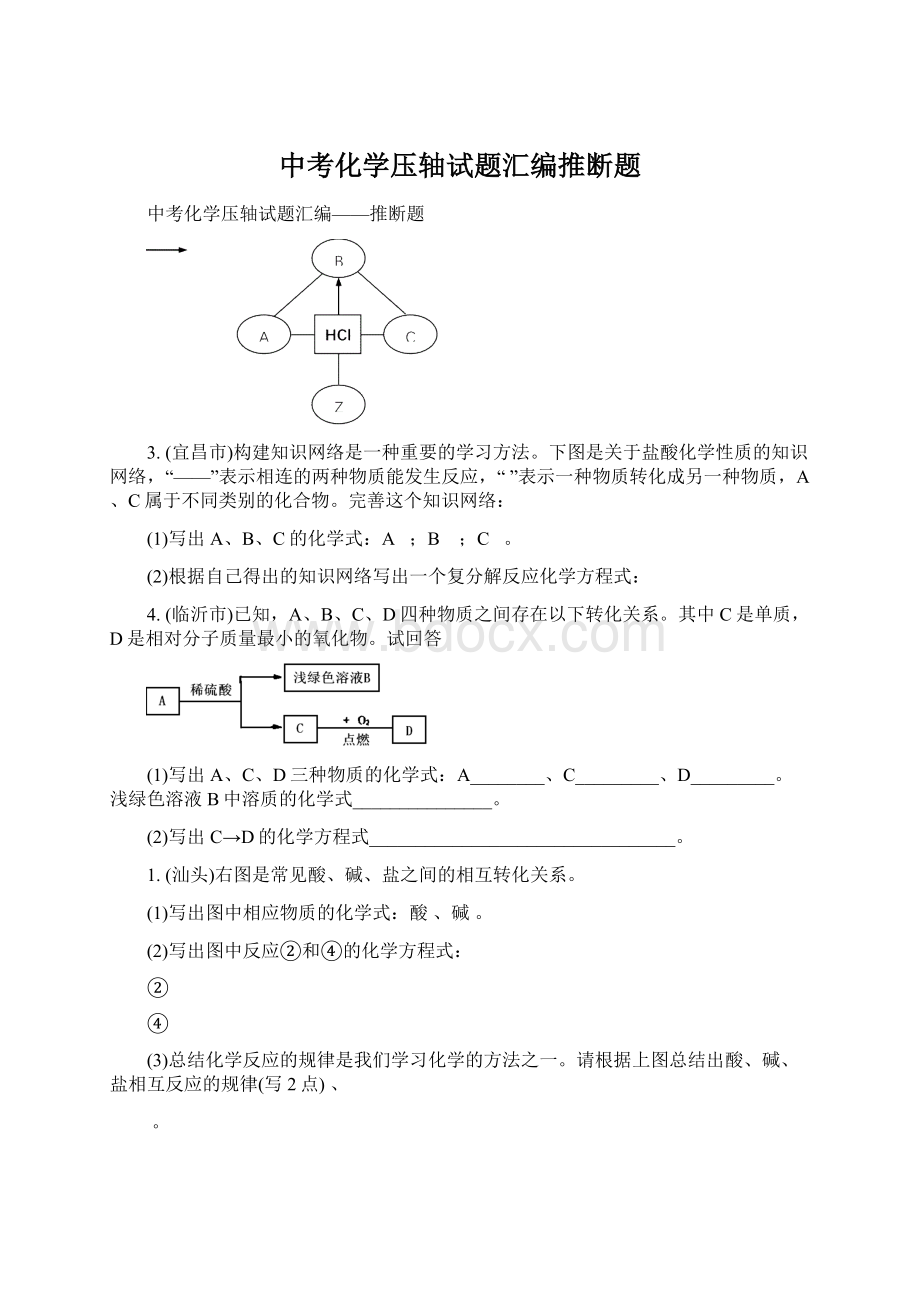
②
④
(3)总结化学反应的规律是我们学习化学的方法之一。
请根据上图总结出酸、碱、盐相互反应的规律(写2点)、
。
2.(河北省)A~H都是初中化学中的常见物质,它们之间的转化关系如图14所示。
A是天然气的主要成分,E是一种常见的食品干燥剂。
请回答:
(1)A的化学式为;
(2)反应③的基本反应类型是;
(3)反应②的化学方程式为;
(4)反应④的化学方程式为。
5.(泰安市)今年年初,我国南方出现了大面积的冰雪灾害,在除雪过程中,融雪剂发挥了很大的作用。
某公司生产的融雪剂是由氯化钠、硝酸钠、氯化镁、硫酸铜中的两种或两种以上的物质组成的。
小佳同学为探究其成分,设计并完成了以下实验:
请你根据以上设计过程,完成下列空白:
(1)该融雪剂中一定含有(写化学式,下同),一定不含有,可能含有;
(2)加入硝酸银溶液发生反应的化学方程式是。
6.(苏州市)小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一墨绿色物质,他想将其除掉。
经查阅资料得知:
铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜(俗称铜绿),于是他和几个同学按如下方案进行了实验。
(1)实验①是向铜绿中加入适量常见无色液体B,再加热至沸,沉淀仍然不变色。
实验②、③中C是一种常见的无色气体,B的化学式为▲。
为满足实验③反应所需的外界条件,应该使用关键仪器名称是▲。
(2)写出实验②反应的化学方程式▲,
在此过程中,判断铜绿没有完全反应的现象是▲。
(3)将A的溶液5~9滴滴入5mL10%的氢氧化钠溶液中得到蓝色絮状沉淀,稍加热即变
△
黑色沉淀D。
写出蓝色絮状沉淀转变为D的化学方程式▲。
(4)已知2Ca(HCO3)====CaCO3↓+H2O+CO2↑,则热稳定性CaCO3>
Ca(HCO3),由此推理上述实验中铜绿、蓝色絮状沉淀、物质D三种化合物热稳定性由强至弱的顺序是:
▲>
▲>
▲(均写化学式)。
(5)经过讨论.同学们建议小彤可以用▲除去镜架上的绿色物质。
7.(肇庆市)实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。
于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。
实验过程如下:
(1)滤液A和滤液B含有相同的溶质,其名称是;
固体B的化学式为。
(2)写出步骤①其中一个反应的化学方程式;
步骤④发生反应的化学方程式为。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是
。
(4)若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量:
废液的质量和。
8.(常州市))A、B、C、D、E五种物质均为初中化学中所涉及的常见物质,它们存在如右图的转化关系,“→”表示可以向箭头所指方向一步转化,弧线表示两种物质间可以发生反应,C是常见气体,D是常见单质,(反应条件与其他物质均已略去)。
请回答下列问题:
(1)若A在常温下为液体,则C的化学式为;
(2)若A在常温下为气体,则C的化学式为;
(3)无论A在常温下为液体还是气体,B的化学式均为,D的化学式均为;
(4)写出A→E的化学方程式:
9.(青岛市)为了除去氯化钠样品中的碳酸钠杂质,某兴趣小组将样品溶解后进行如下实验:
(1)A溶液中溶质可能为____________(只写一种);
(2)将无色溶液与沉淀B分离的操作①的方法名称是_____________;
(3)从无色溶液得到固体物质C的操作②的方法名称是____________;
(4)因为A溶液过量,此方案得到的固体物质C中混有新的杂质,为了既能除去杂质碳酸钠,又能有效地防止新杂质的引入,可向样品溶液中加入过量的_____________后,直接进行操作②即可得到纯净的氯化钠固体。
10.(黄石市)A.、B、C、D、E、F、G、H、I都是初中化学学过的物质。
其中E、F、H均为黑色固体B为紫红色固体,D为混合物。
他们之间有下图的转化关系(部分生成物已省去)
(1)用化学式表示D的组成、
(2)F→G的反应类型
(3)写出F→E的化学方程式
(4)指出B的一种用途
11.(黄冈市)物质A~F都是初中化学中的常见物质,它们有如图所示的转化关系。
回答下列问题:
(1)若A为固体非金属单质,E为红色固体单质,则B、D的化学式为:
B、D写出下列反应化学方程式:
A+B:
(2)若E为一种盐,则A、C的化学式可能是、;
写出下列反应化学方程式:
B+C:
12.(宿迁市)有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。
某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。
方案流程如下:
(1)步骤②中:
需加入的物质是,分离所得混合物的方法是。
(2)步骤③中:
需加入的物质是,发生反应的化学方程式是。
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理?
,理由是.
(4)步骤④的操作是,溶液2和溶液3为什么要混合?
.
13.(南昌市)右图表示的是物质A-H相互间的关系(“→”表示物质间的转化关系,“——”表示两端的物质能发生化学反应)。
A、C都是单质,气体C常用于灭火,F是一种蓝色溶液,可用于配制农药波尔多液。
请你回答:
(1)C的化学式,H可能是;
(2)写出标号①、②、③、④的化学方程式:
①②
③④
14.(乐山市)在下面关系图中,A、B、C、D是初中化学中常见的单质,甲、乙分别是酒精燃烧时一定会产生的两种物质,丁是常用建筑材料的主要成分,G为无色有刺激性气味的气体,能使紫色石蕊变蓝,J是赤铁矿的主要成分。
(1)写出化学式:
甲是,G是;
(2)写出H与J反应的化学方程式:
;
(3)J溶解于稀盐酸中,溶液呈黄色,反应完全后,再向溶液中加入纯净的D的粉末,溶液逐渐变成浅绿色,写出有关变化的化学方程式:
15.(南京市)右图是初中化学中常见物质问的转化关系,其中甲、乙、丙均为非金属单质;
A、B、E和丁均为化合物;
B和E为能产生温室效应的气体。
甲;
乙
(2)写出丙和正反应生成A和B的化学方程式
(3)D和A是组成元素相同的化合物,写出D在丁做催化剂条件下,分解生成A和丙的化学方程式:
16.(南通市)下图中A、B、C、D、E、F、G、H分别代表相关反应的一种物质。
已知:
X、H为黑色固体单质,D是大理石的主要成分,Y为红棕色粉末。
常温下C、E、F、G均为无色气体,图中有部分生成物未标出。
请填写以下空白:
(1)写出下列两种物质的化学式:
E_____________,X______________。
(2)写出下列反应的化学方程式:
①DC的反应:
_________________________________。
②CD的反应:
③F与H的反应:
______________________________________。
④G与Y的反应:
17.(自贡市)如图,A、B、C、D、E各代表铁、水、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。
常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。
请填空:
(1)写出下列物质的化学式:
A,B,D。
(2)相连环物质间发生的反应,没有涉及的基本反应类型是______________________。
18.眉山市)
(1)“奥运在我心中”。
整理归纳物质性质之间的相互联系是学习化学的一种有效方法。
请你从学习过的单质、氧化物、酸、碱、盐中分别选一种代表物(不能重复选用),用化学式填写在下列的奥运标志五圆环中(两环相连表两种物质之间能相互发生反应)。
19.(盐城市)A、B、C、D四种物质在一定条件下有如下转化关系(反应条件已省去)。
请各写一例符合要求的化学方程式:
①A是非金属单质,D是金属;
②该反应类型是中和反应。
20.(镇江市)两种溶液混合,生成了一种沉淀。
用酸碱盐的知识回答下列问题。
(1)若两种溶液均为无色,生成的白色沉淀不溶于稀硝酸,则两种溶液中的溶质可能是和;
(2)若两种溶液均为无色,生成的白色沉淀溶于稀硝酸且有气体产生,则两种溶液中的溶质可能是和;
(3)若一种溶液有色,另一种无色,生成的沉淀溶于稀盐酸且无气体产生,沉淀可能是。
21.(镇江市)右图表示某些物质间转化关系(反应条件和部分产物已省略)。
其中A、E为固体氧化物,且A为黑色粉末;
B、D是由相同元素组成的无色液体,且B具有消毒杀菌作用;
C、Y、Z为无色气体,其中Y有毒;
X是最常见的金属。
(1)反应①中A物质的作用是;
(2)反应③、④的化学方程式:
③;
④;
(3)在日常生活中为防止反应②的发生,可采取的措施是(写一点即可);
(4)在自然界中普遍存在反应⑤,其名称为。
参考答案
1.
(1)(2分)H2SO4Ba(OH)2
(2)H2SO4+BaCl2==BaSO4↓+2HCl(2分,其它合理答案都给分)Ba(OH)2+Na2CO3===BaCO3↓+2NaOH(2分,其它合理答案都给分)(3)(4分)酸与碱反应生成盐和水;
酸与盐反应生成新酸和新盐;
碱与盐反应生成新碱和新盐;
盐与盐反应生成两新盐(写对一点给2分。
任意两点均可,其它合理答案都给分)
2.
(1)CH4
(2)化合反应(3)2NaOH+CO2=Na2CO3+H2O(4)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
3.NaOH、CuCl2、Na2CO3NaOH、HNO3、Fe2O3【说明:
B物质对得1分,A与B、HCl全对得1分,C与B、HCl全对得1分;
若B物质错则不得分。
填物质名称不得分。
本题属开放性答案,其它合理答案也可】
(2)Na2CO3+2HCl==2NaCl+H2O+CO2↑[或NaOH+HCl==NaCl+H2O或2NaOH+CuCl2==Cu(OH)2↓+2NaCl或Na2CO3+CuCl2==CuCO3↓+2NaCl等]【说明:
所写化学方程式要与45、46、47三空对应,只有得分的物质,该化学方程式才能得分,否则不给分】
4.
(1)FeH2H2OFeSO4
(2)2H2+O2
2H2O
5.(3分)
(1)MgCl2CuSO4NaCl和NaNO3
(2)AgNO3+NaCl=AgCl↓+NaNO3(每空1分)
6.
7.(8分)
(1)(2分)硫酸锌(1分)Fe(1分)
(2)(2分)Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4==ZnSO4+Fe(1分)Zn+H2SO4=ZnSO4+H2↑(1分)(3)(2分)取步骤④的滤渣于试管中加入少量稀硫酸(1分),若有气泡产生则酸不足量(或若无气泡产生,则酸已足量,1分)(4)(2分)硫酸锌的质量(1分)、锌粉的质量(1分)[或硫酸锌、固体B、固体C、铜的质量,每说到2个给1分、全对给2分]
8.(6分)
(1)H2(1分)
(2)CO(1分)(3)H2CO3(1分)O2(1分)(4)6CO2+6H2O
C6H12O6+6O2(2分)
9.
(1)氯化钙
(2)过滤(3)结晶(4)盐酸
10.⑴Cu(OH)2BaSO4⑵化合反应⑶⑷作导线
11.(共6分)
(1)B:
CuO(1分)D:
CO2(1分);
A+B:
C+2CuO
2Cu+CO2↑(1分)
(2)A:
H2SO4(1分)C:
CuSO4(1分)B+C:
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓(1分)
12.
(1).Fe过滤
(2).稀硫酸Fe+H2SO4=FeSO4+H2↑(3).不合理因为要使Ag+完全置换出来,必须加入过量的铁(4).两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用(其他合理答案也可)
13.(6分)
(1)CO2HCl等(合理即可)(3)①2C+
2CO②2NaOH+CO2=Na2CO3+H2O③Na2CO3+Ca(OH)2=CaCO3↓+2NaOH④Fe+CuSO4=Cu+FeSO4
14.(5分)
(1)H2O,NH3;
(2)Fe2O3+3CO=2Fe+3CO2;
(3)Fe2O3+6HCl=2FeCl3+3H2O;
2FeCl3+Fe=3FeCl2。
15.(本题共4分,每空1分)
(1)H2C
(2)CH4十202===CO2十2H2O(3)2H202====2H2O+O2(催化剂可以写成:
Fe20a或CuO等)
16.
(1)H2C
(2)①CaCO3CaO+CO2↑②Ca(OH)2+CO2=CaCO3↓+H2O③3Fe+2O2点燃Fe3O4④Fe2O3+3CO高温2Fe+3CO2
17.(每空1分,共4分)
(1)A:
FeB:
CuSO4D:
CO2
(2)分解反应
18.
(1)从左到右依次为CO2NaOHHClFeCuSO4(该题答案不唯一,只要合理均给分)
19.⑵①H2+CuO====Cu+H2O等②NaOH+HCl====NaCl+H2O等
20.(共5分,每空1分)
(1)AgNO3和NaCl(或Ba(NO3)2和Na2SO4等)
(2)BaCl2和Na2CO3(Ca(OH)2和Na2CO3等)(3)Cu(OH)2或Fe(OH)2或Fe(OH)3注:
其它合理答案均给分,写名称或名称符号混写也可。
21.(共7分)
(1)催化作用(写“催化剂”、“催化”、“催化性”也给分);
(1分)
(2)③Fe2O3+6HCl===2FeCl3+3H2O(2分)④3CO+Fe2O3高温2Fe+3CO2(2分)(3)涂油(或刷漆、电镀等,其它合理答案均给分)(1分)(4)光合作用(1分)