备战高考化学 氧化还原反应综合试题含答案解析文档格式.docx
《备战高考化学 氧化还原反应综合试题含答案解析文档格式.docx》由会员分享,可在线阅读,更多相关《备战高考化学 氧化还原反应综合试题含答案解析文档格式.docx(35页珍藏版)》请在冰豆网上搜索。
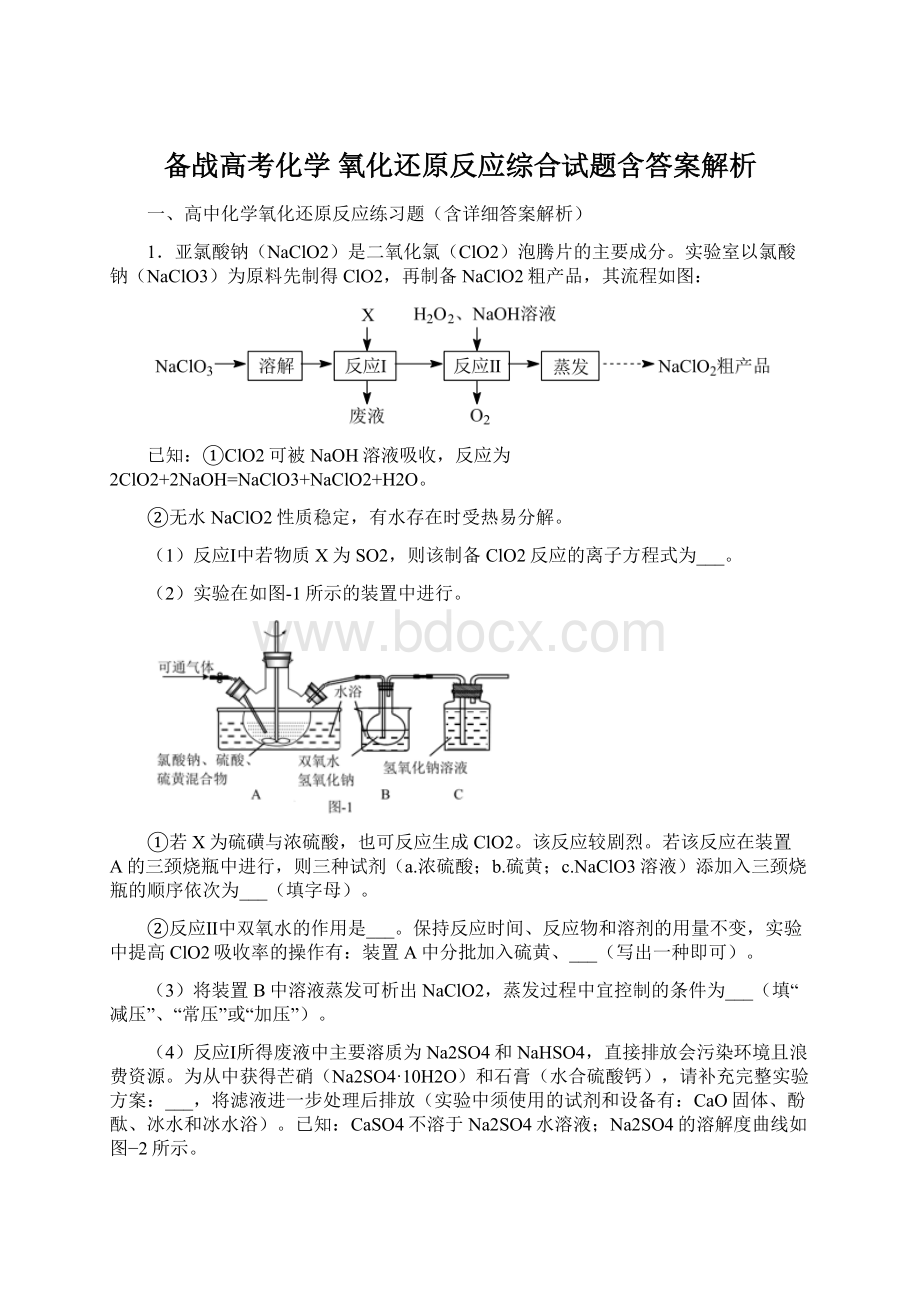
【答案】2ClO3-+SO2═2ClO2+SO42-cab作还原剂水浴加热时控制温度不能过高(或加一个多孔球泡等)减压向废液中分批加入适量CaO固体并搅拌,用冰水浴控制反应温度,对浊液取样并滴加酚酞,至溶液呈浅红色时停止加入CaO。
静置后过滤,用水洗涤沉淀2-3次得到石膏;
滤液蒸发浓缩,冷却结晶至32.4℃以下,接近0℃,过滤,所得晶体用冰水洗涤2-3次,低温干燥得到芒硝
【解析】
【分析】
用二氧化硫将NaClO3还原制得ClO2,ClO2和NaOH反应制得NaClO3和NaClO2,再用过氧化氢将NaClO3还原成NaClO2制得NaClO2粗品。
【详解】
(1)SO2作还原剂,S化合价升高2,被氧化成SO42-,ClO3-作氧化剂,被还原成ClO2,Cl化合价降低1,结合电子得失守恒、电荷守恒、原子守恒可书写离子方程式:
2ClO3-+SO2═2ClO2+SO42-,故答案为:
2ClO3-+SO2═2ClO2+SO42-;
(2)①反应剧烈,浓硫酸只能在最后添加,结合流程图可知先加NaClO3,所以顺序为:
先加NaClO3,再加S,最后加浓硫酸,故答案为:
cab;
②反应Ⅱ中NaOH和ClO2反应生成NaClO3和NaClO2,过氧化氢的作用是将NaClO3还原成NaClO2,过氧化氢会分解,温度不宜太高,所以控制A中水浴加热时温度不过高,或者在B中搅拌、或者加一个多孔球泡,故答案为:
作还原剂;
水浴加热时控制温度不能过高(或加一个多孔球泡等);
(3)无水NaClO2性质稳定,有水存在时受热易分解,应该减压,让水分尽快蒸发,故答案为:
减压;
(4)加入一定量CaO使NaHSO4反应成CaSO4,为了保证NaHSO4反应完,所加CaO需稍过量,CaO过量溶液就显碱性了,可以用酚酞作指示剂,当溶液变为浅红色时停止加CaO,CaSO4不溶于Na2SO4水溶液,此时可用过滤、洗涤的方法得到石膏,此时滤液为Na2SO4溶液,还不是芒硝,从图上看,可将温度调整32.4℃以下,形成芒硝,析出芒硝晶体,过滤、洗涤、干燥就可得芒硝了,为了使芒硝产率较高,可用冰水洗涤,降低因溶解损失的量,故答案为:
向废液中分批加入适量CaO固体并搅拌,用冰水浴控制反应温度,对浊液取样并滴加酚酞,至溶液呈浅红色时停止加入CaO。
滤液蒸发浓缩,冷却结晶至32.4℃以下,接近0℃,过滤,所得晶体用冰水洗涤2-3次,低温干燥得到芒硝。
【点睛】
结合图像,温度低于32.4℃以下,硫酸钠结晶得到芒硝,温度降低,芒硝的溶解度减小,可用冰水洗涤减小损失率。
2.硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:
Na2S2O3的制备。
工业上可用反应:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:
(1)仪器a的名称是_______,仪器b的名称是_______。
b中利用质量分数为70%〜80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。
c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______(写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:
探究Na2S2O3与金属阳离子的氧化还原反应。
资料:
Fe3++3S2O32-⇌Fe(S2O3)33-(紫黑色)
装置
试剂X
实验现象
Fe2(SO4)3溶液
混合后溶液先变成紫黑色,30s后几乎变为无色
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。
从化学反应速率和平衡的角度解释实验Ⅱ的现象:
_______
实验Ⅲ:
标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:
用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g∙mol-1)0.5880g。
平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32-=2I-+S4O62-,三次消耗Na2S2O3溶液的平均体积为25.00mL,则所标定的硫代硫酸钠溶液的浓度为_______mol∙L-1
【答案】分液漏斗蒸馏烧瓶
硫化钠和碳酸钠的混合液调节酸的滴加速度若SO2过量,溶液显酸性.产物会发生分解加入铁氰化钾溶液.产生蓝色沉淀开始生成Fe(S2O3)33-的反应速率快,氧化还原反应速率慢,但Fe3+与S2O32-氧化还原反应的程度大,导致Fe3++3S2O32-⇌Fe(S2O3)33-(紫黑色)平衡向逆反应方向移动,最终溶液几乎变为无色0.1600
(1)a的名称即为分液漏斗,b的名称即为蒸馏烧瓶;
b中是通过浓硫酸和Na2SO3反应生成SO2,所以方程式为:
;
c中是制备硫代硫酸钠的反应,SO2由装置b提供,所以c中试剂为硫化钠和碳酸钠的混合溶液;
(2)从反应速率影响因素分析,控制SO2生成速率可以调节酸的滴加速度或者调节酸的浓度,或者改变反应温度;
(3)题干中指出,硫代硫酸钠在酸性溶液中会分解,如果通过量的SO2,会使溶液酸性增强,对制备产物不利,所以原因是:
SO2过量,溶液显酸性,产物会发生分解;
(4)检验Fe2+常用试剂是铁氰化钾,所以加入铁氰化钾溶液,产生蓝色沉淀即证明有Fe2+生成;
解释原因时一定要注意题干要求,体现出反应速率和平衡两个角度,所以解释为:
开始阶段,生成
的反应速率快,氧化还原反应速率慢,所以有紫黑色出现,随着Fe3+的量逐渐增加,氧化还原反应的程度变大,导致平衡逆向移动,紫黑色逐渐消失,最终溶液几乎变为无色;
(5)间接碘量法滴定过程中涉及两个反应:
①
②
反应①I-被氧化成I2,反应②中第一步所得的I2又被还原成I-,所以①与②电子转移数相同,那么滴定过程中消耗的
得电子总数就与消耗的
失电子总数相同;
在做计算时,不要忽略取的基准物质重铬酸钾分成了三份进行的滴定。
所以假设c(Na2S2O3)=amol/L,列电子得失守恒式:
,解得a=0.1600mol/L。
3.过硫酸钠(Na2S2O8)具有极强的氧化性,且不稳定,某化学兴趣小组探究过硫酸钠的相关性质,实验如下。
已知SO3是无色易挥发的固体,熔点16.8℃,沸点44.8℃。
(1)稳定性探究(装置如图):
分解原理:
2Na2S2O8
2Na2SO4+2SO3↑+O2↑。
此装置有明显错误之处,请改正:
______________________,水槽冰水浴的目的是____________________;
带火星的木条的现象_______________。
(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为______________________,该反应的氧化剂是______________,氧化产物是________。
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是___________________________。
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·
L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为______mol·
L-1,若Na2S2O8有剩余,则测得的紫红色离子浓度将________(填“偏高”“偏低”或“不变”)。
【答案】试管口应该略向下倾斜冷却并收集SO3木条复燃2Mn2++5S2O
+8H2O
2MnO
+10SO
+16H+S2O
MnO
用玻璃棒引流,向漏斗中加蒸馏水至没过沉淀,使蒸馏水自然流下,重复操作2~3次(合理即可)0.06偏高
(1)在试管中加热固体时,试管口应略微向下倾斜;
根据SO3、氧气的性质进行分析;
(2)X为MnO4-,向所得溶液中加入BaCl2溶液可以产生白色沉淀,则产物中有SO42-,据此写出离子方程式,并根据氧化还原反应规律判断氧化剂、氧化产物;
(3)根据沉淀洗涤的方法进行回答;
(4)根据得失电子守恒可得到关系式:
5H2C2O4---2MnO4-,带入数值进行计算;
Na2S2O8也具有氧化性,氧化H2C2O4。
(1)在试管中加热固体时,试管口应略微向下倾斜,SO3的熔、沸点均在0℃以上,因此冰水浴有利于将SO3冷却为固体,便于收集SO3,由Na2S2O8的分解原理可知,生成物中有氧气,所以在导管出气口的带火星的木条会复燃,故答案为:
试管口应该略向下倾斜;
冷却并收集SO3;
木条复燃;
(2)X为MnO4-,向所得溶液中加入BaCl2溶液可以产生白色沉淀,则产物中有SO42-,则反应的离子方程式为2Mn2++5S2O
+16H+,根据该反应中元素化合价的变化可知,氧化剂是S2O82-,氧化产物是MnO4-,故答案为:
2Mn2++5S2O
+16H+;
S2O82-;
MnO4-;
(3)沉淀洗涤时,需要用玻璃棒引流,并且所加蒸馏水需要没过沉淀,需要洗涤2~3次,故答案为:
用玻璃棒引流,向漏斗中加蒸馏水至没过沉淀,使蒸馏水自然流下,重复操作2~3次(合理即可);
则
,Na2S2O8具有氧化性,消耗的H2C2O4溶液增多,导致测得的结果偏高,故答案为:
0.06;
偏高。
4.碳酸亚铁可用于制备补血剂。
某研究小组制备了FeCO3,并对FeCO3的性质和应用进行了探究。
已知:
①FeCO3是白色固体,难溶于水②Fe2++6SCN-
Fe(SCN)64-(无色)
Ⅰ.FeCO3的制取(夹持装置略)
实验i:
装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a是_____。
(2)向Na2CO3溶液通入CO2的目的是_____。
(3)C装置中制取FeCO3的离子方程式为_____。
(4)有同学认为C中出现白色沉淀之后应继续通CO2,你认为是否合理并说明理由________。
Ⅱ.FeCO3的性质探究
实验ii
实验iii
(5)对比实验ⅱ和ⅲ,得出的实验结论是_____。
(6)依据实验ⅱ的现象,写出加入10%H2O2溶液的离子方程式_____。
Ⅲ.FeCO3的应用
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁([CH3CH(OH)COO]2Fe,相对分子质量为234)补血剂。
为测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,树德中学化学实验小组准确称量1.0g补血剂,用酸性KMnO4溶液滴定该补血剂,消耗0.1000mol/L的KMnO4溶液10.00mL,则乳酸亚铁在补血剂中的质量分数为_____,该数值异常的原因是________(不考虑操作不当以及试剂变质引起的误差)。
【答案】饱和NaHCO3溶液降低溶液中OH-浓度,防止生成Fe(OH)22HCO3-+Fe2+=FeCO3↓+CO2↑+H2O不合理,CO2会和FeCO3反应生成Fe(HCO3)2(或合理,排出氧气的影响)Fe2+与SCN-的络合(或结合)会促进FeCO3固体的溶解或FeCO3固体在KSCN溶液中的溶解性比KCl溶液中大6Fe(SCN)64-+3H2O2=2Fe(OH)3↓+4Fe(SCN)3+24SCN-或6Fe2++3H2O2+12SCN-=2Fe(OH)3↓+4Fe(SCN)3或6Fe2++3H2O2=2Fe(OH)3↓+4Fe3+117%乳酸根中的羟基被KMnO4氧化,也消耗了KMnO4
I.装置A中碳酸钙和稀盐酸反应生成的二氧化碳中混有挥发的氯化氢气体,需要利用装置B中盛装的饱和碳酸氢钠溶液除去,装置C中,向碳酸钠溶液(pH=11.9)通入一段时间二氧化碳至其pH为7,滴加一定量硫酸亚铁溶液产生白色沉淀,过滤,洗涤,干燥,得到FeCO3;
II.(5)根据Fe2++6SCN-
Fe(SCN)64-分析FeCO3在KCl和KSCN两种不同溶液中的溶解度不同判断;
(6)实验ii中溶液显红色且有红褐色沉淀生成,说明加入10%过氧化氢溶液后有Fe(OH)3和Fe(SCN)3生成;
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,根据得失电子守恒和元素守恒建立关系式进行计算;
乳酸根中有羟基,也能被高锰酸钾溶液氧化。
I.
(1)装置A中制取的CO2中混有HCl,欲除去CO2中混有的HCl,B中盛装的试剂a应是饱和NaHCO3溶液,故答案为:
饱和NaHCO3溶液;
(2)向Na2CO3溶液中通入CO2的目的是利用CO2和Na2CO3反应生成的NaHCO3,提高溶液中HCO3-的浓度,抑制CO32-的水解,降低溶液中OH-的浓度,防止生成Fe(OH)2,故答案为:
降低溶液中OH-浓度,防止生成Fe(OH)2;
(3)装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,此时溶液中溶质主要为NaHCO3,再滴加FeSO4溶液,有FeCO3沉淀生成,发生反应的离子方程式为2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O,故答案为:
2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O;
(4)FeCO3沉淀能溶解在CO2的水溶液中,生成可溶于水的Fe(HCO3)2,降低产物的量,则当出现白色沉淀之后不应继续通入CO2,或者:
出现白色沉淀之后继续通CO2,可防止空气中氧气氧化FeCO3,提高产物的纯度,故答案为:
不合理,CO2会和FeCO3反应生成Fe(HCO3)2(或合理,排出氧气的影响);
Ⅱ.(5)通过对比实验ii和iii,可知Fe2+与SCN-的络合生成可溶于水的Fe(SCN)64-,会促进FeCO3固体的溶解,故答案为:
Fe2+与SCN-的络合(或结合)会促进FeCO3固体的溶解或FeCO3固体在KSCN溶液中的溶解性比KCl溶液中大;
(6)依据实验ⅱ的现象,可知在含有Fe2+的溶液中滴加10%的过氧化氢溶液后,有Fe(OH)3和Fe(SCN)3生成,发生反应的离子方程式为6Fe(SCN)64-+3H2O2=2Fe(OH)3↓+4Fe(SCN)3+24SCN-或6Fe2++3H2O2+12SCN-=2Fe(OH)3↓+4Fe(SCN)3或6Fe2++3H2O2=2Fe(OH)3↓+4Fe3+;
故答案为:
6Fe(SCN)64-+3H2O2=2Fe(OH)3↓+4Fe(SCN)3+24SCN-或6Fe2++3H2O2+12SCN-=2Fe(OH)3↓+4Fe(SCN)3或6Fe2++3H2O2=2Fe(OH)3↓+4Fe3+;
Ⅲ.(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁([CH3CH(OH)COO]2Fe补血剂,可得关系式MnO4~5Fe2+~5[CH3CH(OH)COO]2Fe,则乳酸亚铁的物质的量为0.1000mol/L×
0.01L×
5=0.005mol,则乳酸亚铁的质量分数
,由于乳酸根中含有羟基,也可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾溶液的量增多,而计算中只按Fe2+被氧化,故计算所得乳酸亚铁的质量偏大,导致产品中乳酸亚铁的质量分数大于100%,故答案为:
117%;
乳酸根中的羟基被KMnO4氧化,也消耗了KMnO4。
5.锂离子电池能够实现千余次充放电,但长时间使用后电池会失效,其中的化学试剂排放至环境中不仅会造成环境污染,还会造成资源的浪费。
实验室模拟回收锂离子电池中的Co、Ni、Li的流程如图。
LiCoO2难溶于水,易溶于酸。
回答下列问题:
(1)LiCoO2中Co的化合价是__。
(2)LiCoO2在浸出过程中反应的离子方程式是__。
(3)浸出剂除了H2O2外,也可以选择Na2S2O3,比较二者的还原效率H2O2__(填“>
”或“<
”)Na2S2O3(还原效率:
还原等物质的量的氧化剂消耗还原剂的物质的量)。
(4)提高浸出效率的方法有__。
(5)利用Cyanex272萃取时,pH对钴、镍萃取分离效果的影响如图。
从图中数据可知,用Cyanex272萃取分离时,最佳pH是__。
(6)反萃取的离子方程式为2H++CoR2=Co2++2HR,则反萃取剂的最佳选择是__。
(7)常温下,若水相中的Ni2+的质量浓度为1.18g·
L-1,则pH=__时,Ni2+开始沉淀。
[Ksp(Ni(OH)2=2×
10-15]
(8)参照题中流程图的表达,结合信息设计完成从水相中分离Ni和Li的实验流程图(如图)___。
提供的无机试剂:
NaOH、Na2CO3、NaF。
【答案】+32LiCoO2+6H++H2O2=2Co2++O2↑+2Li++4H2O<
适当升高温度,适当增加H2SO4浓度5.5H2SO47.5①NaOH②Ni(OH)2③NaF
(1)通过化合物中各元素化合价代数和为0进行计算;
(2)由流程图中有机相反萃取得到CoSO4,可知LiCoO2与H2O2在酸性条件下发生氧化还原反应,根据氧化还原反应的规律写出化学方程式;
(3)根据等物质的量H2O2和Na2S2O3作为还原剂转移电子的多少进行判断;
(4)提高浸出效率即提高化学反应速率;
(5)分离Co2+和Ni2+时,由于Co2+进入有机相,Ni进入水相,因此,应该选择钴的萃取率高而镍的萃取率低的pH范围;
(6)将钴洗脱进入水相中时,应该使反应向正反应方向移动,同时不能引入新杂质;
(7)根据Ksp(Ni(OH)2的表达式进行计算;
(8)根据表格中所给物质溶解度信息,调节pH应该用碱性物质,但要考虑分离Ni和Li元素不能使Ni和Li元素同时沉淀。
(1)LiCoO2中O元素为-2价,Li为+1价,根据化合物中各元素化合价代数和为0进行计算得Co的化合价为+3价;
(2)由流程图中有机相反萃取得到CoSO4,可知LiCoO2与H2O2在酸性条件下发生氧化还原反应,化学方程式为:
2LiCoO2+6H++H2O2=2Co2++O2↑+2Li++4H2O;
(3)1molH2O2作为还原剂转移2mol电子,1molNa2S2O3作为还原剂转移8mol电子,则Na2S2O3的还原效率更高;
(4)提高浸出效率可以适当升高温度,适当增加H2SO4浓度等;
(5)分离Co2+和Ni2+时,由于Co2+进入有机相,Ni进入水相,因此,应该选择钴的萃取率高而镍的萃取率低的pH范围,所以最佳pH是5.5;
(6)将钴洗脱进入水相中时,应该使反应向正反应方向移动,同时,为不引入新杂质,反萃取剂最好选择H2SO4;
(7)c(Ni2+)=
mol/L=0.02mol/L,则开始沉淀时,c(OH-)=
=
=10-6.5mol/L,则pH=14-6.5=7.5;
(8)根据表格中所给物质溶解度信息,调节pH应该用碱性物质,但要考虑分离Ni和Li元素不能使Ni和Li元素同时沉淀,所以选用NaOH,则Ni(OH)2先沉淀,过滤后滤液中加入NaF生成LiF沉淀。
本题(5)选择合适的pH时,注意读懂图中信息,要根据实验的具体操作情况来分析。
6.草酸(HOOC-COOH)是一种常见的有机酸,利用淀粉制备草酸的实验流程如图:
回答下列问题:
(1)“水解”时,检验淀粉是否水解完全,所用的试剂是____;
“水解”及“氧化”步骤中适宜的加热方式是________________。
(2)“氧化”时实验装置如图所示(夹持及加热装置已略):
①仪器Q的名称是________.
②三口烧瓶中生成H2C2O4·
2H2O的化学方程式为____________。
③装置B的作用是___________,装置C的作用是_______________。
(3)已知在20℃、70℃时,草酸的溶解度依次为为9.5g/(l00g水),84.5g/(l00g水),则粗草酸“精制”需采用的提纯方法为___________________。
(4)探究H2C2O4的性质:
①向NaHCO3溶液中加入草酸溶液,产生大量气体,可得出草酸的酸性比碳酸_____(填“强”或“弱”)。
②向草酸中加入足量C2H5OH和适量浓硫酸加热,产生有芳香气味的油状物。
该生成物为___________(写结构简式)。
③向K2Cr2O7溶液中加入H2C2O4·
2H2O析出K[Cr(C2O4)2(H2O)2]晶体,该反应的化学方程式为_____________________。
【答案】碘水水浴加热球形冷凝管C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O做安全瓶,防止倒吸吸收尾气中的NO和NO2,防止污染空气重结晶强C2H5OOC-COOC2H5K2Cr2O7+7H2C2O4·
2H2O=2K[Cr(C2O4)2(H2O)2]+6CO2↑+17H2O
淀粉在稀硫酸催化下控制温度在70℃到80℃发生水解,得到葡萄糖,加入60%硝酸,在60℃下发生氧化,得到草酸,硝酸的还原产物有N