选修4人教版第四章第三节+电解池教师用Word下载.docx
《选修4人教版第四章第三节+电解池教师用Word下载.docx》由会员分享,可在线阅读,更多相关《选修4人教版第四章第三节+电解池教师用Word下载.docx(18页珍藏版)》请在冰豆网上搜索。
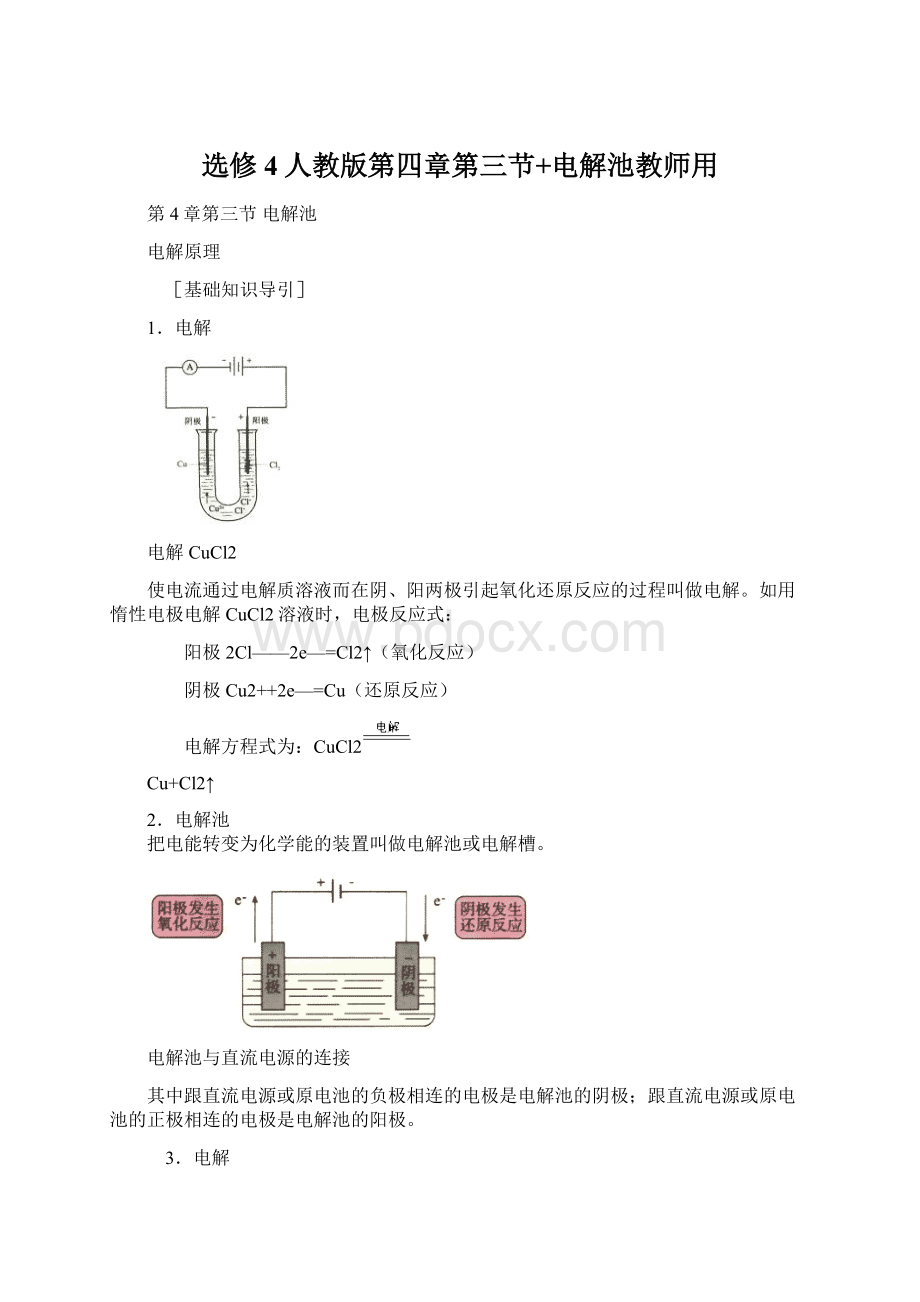
电解过程总反应方程式叫电解方程式(指电解时总的化学方程式或离子方程式)。
要正确书写电解方程式,首先要正确写出电极反应式,然后分析参加电极反应的离子来自何种物质,这样才能正确写出反应物、生成物,配平且在等号上方注明“电解”或“通电”。
书写的具体步骤:
⑴先查阳极电极材料和确定溶液中的离子种类
如用C电极电解CuSO4溶液:
溶液中有CuSO4=Cu2++SO42—;
H2O
H++OH-。
溶液中存在Cu2+、H+、OH—、SO42—共4种离子。
⑵由放电顺序确定放电产物和电极反应
C电极为惰性电极,不参加反应。
放电能力 Cu2+>H+ Cu2+放电生成Cu
OH—>SO42—,OH—放电生成O2
电极反应:
阴极 2Cu2++4e—=2Cu阳极 4OH—-4e—=2H2O+O2↑
溶液中余下的H+和SO42—结合成新物质H2SO4。
⑶由电极反应产物,写出总反应式――电解方程式
如上述反应中的反应物为CuSO4和H2O,产物是Cu、O2和H2SO4,电解方程式为:
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
6、电解时电极放电顺序的判断
离子在电极上得失电子的能力与离子的性质、溶液的浓度和温度、电流的大小、电极的材料及电极间的距离等都有关系。
中学阶段我们一般只讨论电极材料的性质、离子的氧化性强弱和还原性强弱对它们得失电子能力的影响。
⑴阳极放电顺序
1看电极,如果是活性电极(指金属活动顺序表Ag及Ag以前的金属)则电极材料失电子,电极被溶解,溶液中的阴离子不能失电子。
②如果是惰性电极(Pt、Au、石墨),则要再看溶液中的阴离子的失电子能力,此时根据阴离子放电顺序加以判断。
阴离子放电顺序:
S2—>I—>Br—>Cl—>OH—>含氧酸根>F—(实际上在水溶液中的电解,OH—后面的离子是不可能放电的,因为水提供的OH—会放电)
⑵阴极放电顺序
阴极本身被保护,直接根据阳离子放电顺序进行判断,阳离子放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>(H+)>Al3+>Mg2+(类似,在水溶液中的电解,H+后面的离子一般是不放电的,因为水提供的H+会放电;
Pb2+>Sn2+>Fe2+>Zn2+浓度很大时排在H+前面,离子的放电顺序往往还与溶液的酸碱性、温度、离子的浓度等有关)
7、电解质溶液的电解规律(惰性电极)
被电解的物质
电解质实例
阴 极
阳 极
总方程式
溶液的pH
备注
H2O
强碱的含氧酸盐Na2SO4
4H++4e—=2H2↑
4OH——4e—=O2↑+2H2O
2H2O
2H2↑+O2↑
不 变
电解质起导电作用,其量不变,水减少
含氧酸H2SO4
降 低
强碱KOH
升 高
电解质自身
弱碱的非含氧酸盐(氟化物除外)CuCl2
Cu2++2e—=Cu↓
2Cl——2e—=Cl2↑
具体看金属阳离子水解能力与生成的气体溶于水后的反应。
此处Cl2溶于水的酸性强于Cu2+水解的酸性,所以pH下降
相当于电解质分解,水不参加反应
非含氧酸(HF除外)HBr
2H++2e—=H2↑
2Br——2e—=Br2
2HBr
Br2+H2↑
电解质自身和水
强碱的非含氧酸盐NaCl
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
产生碱或酸
弱碱的含氧酸盐CuSO4
Cu2++42e—=2Cu↓
2CuSO4+2H2O
2H2SO4+2Cu+O2↑
8、电解质溶液电解时(均为惰性电极),pH变化情况,电解液复原所需加入物质及电解类型(与上面的9相互对照补充)
(1)分解水型:
含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4、K2SO4等)的电解。
阴极:
4H++4e-=2H2↑阳极:
4OH--4e-=O2↑+2H2O总反应:
2H2↑+O2↑
阴极产物:
H2;
阳极产物:
O2。
电解质溶液复原加入物质:
H2O。
pH变化情况:
原来酸性的溶液pH变小,原来碱性的溶液pH变大,强酸(含氧酸)强碱的正盐溶液pH不变。
(2)分解电解质型:
无氧酸(除HF外)、不活泼金属的无氧酸盐(氟化物除外)的电解,如HCl、CuCl2等。
Cu2++2e-=Cu阳极:
2Cl--2e-=Cl2↑总反应:
酸为H2,盐为金属;
卤素等非金属单质。
电解液复原加入物质为原溶质,如电解CuCl2溶液,需加CuCl2。
如电解无氧酸溶液pH变大但不会超过7;
如为盐溶液的电解则视无氧酸根的情况而定(如:
电解CuCl2溶液时,由于生成的Cl2溶于水产生的酸性强于Cu2+水解产生的酸性,所以pH下降;
电解Na2S溶液时,由于生成NaOH使pH升高)。
(3)放氢生碱型:
活泼金属的无氧酸盐(氟化物除外)溶液的电解,如NaCl、MgBr2等。
2H++2e-=H2↑阳极:
2NaOH+H2↑+Cl2↑
碱和H2;
电解饱和食盐水的产物分别为NaOH和H2以及Cl2。
电解液复原加入物质为卤化氢。
电解饱和食盐水,要使电解质溶液复原需加入HCl。
电解液pH显著变大
(4)放氧生酸型:
不活泼金属的含氧酸盐溶液的电解,如CuSO4、AgNO3等。
2Cu2++4e-=Cu阳极:
4OH--4e-=O2↑+2H2O
总反应:
析出不活泼金属单质;
阳极产物是该盐对应的含氧酸和氧气,本例中分别是Cu以及H2SO4、O2。
电解液复原加入物质为不活泼金属的氧化物(金属价态与原盐中相同)。
如电解CuSO4溶液,复原需加入CuO。
pH变化情况:
溶液pH显著变小。
9、实验分析:
电解CuCl2溶液
(1)电极材料
阴极可用惰性电极甚至较活泼的金属,但阳极需使用惰性电极,否则会发生氧化反应而溶解。
(2)惰性电极一般指金、铂、石墨电极,而银、铜等均是活性电极。
(3)实验现象:
通电后,电流表指针发生偏转,阴极石墨棒上析出一层红色固体,阳极表面有气泡放出,可闻到刺激性气味。
(4)淀粉碘化钾试纸的作用:
检验阳极产物是否为Cl2。
使用时应先润湿并缠于玻棒端或用镊子夹持,作用时间不宜太久,否则变蓝后的试纸又会失去蓝色。
12、电解原理的应用
⑴氯碱工业
如电解饱和食盐水可制得NaOH、Cl2、H2,而电解稀NaCl溶液可制备NaClO。
[典型例题剖析]
例2.如图所示A为一张浸透淀粉碘化钾溶液并滴有酚酞试剂的滤纸,a、b为两张紧贴在滤纸上的铂片,并用导线和直流电源M、N两极相连接,通电后,在a周围观察到无色溶液变为蓝色。
(1)电源哪一个极是正极?
哪极是负极?
(2)b周围可观察到什么现象?
为什么?
[分析]本题装置实际上是电解KI溶液,由于a、b为铂电极是惰性电极,则在阳极上放电的应是I-,其电极反应为:
2I--2e-=I2;
阴极是水电离出来的H+放电,其电极反应为:
2H++2e-=H2↑,由于H+在阴极上不断放电,破坏了水的电离平衡,使阴极附近OH-浓度增大。
从题给条件分析可知,a周围观察到蓝色,说明有I2生成,所以a为阳极、b为阴极,而与之相连中的电源M极为正极,N极为负极,b周围酚酞试液变红色。
答案:
(1)M是电源的正极,N为负极,
(2)b极周围可看到溶液红色,因为b极为阴极,其电极反应为2H++2e-=H2↑,由于H+不断放电破坏了水的电离平衡,c(OH-)增大,使得b极附近碱性增大,酚酞变红。
例3.若在铁片上镀锌,以下叙述中错误的是(A )
A.可把铁片与电源的正极相连B.电解质必须用含有锌离子的可溶性盐
C.锌极发生氧化反应D.铁极的电极反应式为Zn2++2e-=Zn
[分析]电镀时一般以镀层金属为电解池的阳极,待镀件为阴极,含镀层金属离子的电解溶液为电镀液。
电镀过程中镀层金属发生氧化反应而成为离子溶入电解液,其离子则在待镀件上发生还原反应而析出,且电解质溶液浓度一般不变。
故而本题只有A项不正确。
例4.串联电路中的四个电解池分别装有0.1mol·
L-1的下列溶液,用铂电极电解,连接直流电源一段时间后,溶液的pH最小的是(C )
A.CuCl2 B.NaCl C.AgNO3 D.KNO3
[分析]在电解时,如果H+或OH-在电极上放电往往会导致电极附近溶液H+或OH-浓度发生改变,从而引起电极附近pH变化。
对于电解CuCl2溶液,尽管H+或OH-都没有在阴极或阳极上放电,但由于CuCl2是强酸弱碱盐,水解后溶液呈酸性,因此若CuCl2完全电解后,如果不考虑Cl2溶于水生成HCl和HClO,溶液呈中性,pH增大(实际上由于生成HCl、HClO,溶液呈微酸性)。
电解NaCl溶液H+在阴极上放电,阴极附近OH-浓度增大;
阳极上Cl-放电,阳极区域H+、OH-浓度基本不变,因而电解后整个溶液pH会变大,电解AgNO3溶液,阴极Ag+放电;
阳极是OH-放电,阳极区域H+浓度变大,溶液pH会显著变小(相当于生成稀HNO3)。
电解KNO3实质是电解水,pH不变。
例5.将两个铂电极插入500mLCuSO4(aq)中进行电解,通电一段时间后,某一电极上增重0.064g(设电解时无H2放出,且不考虑水解和溶液体积的变化),此时溶液中氢离子的物质的量浓度约为( )
A.1×
10-3mol·
L-1 B.4×
L-1C.2×
L-1 D.1×
10-7mol·
L-1
[分析]由于最后溶液中的H+主要由电解CuSO4溶液产生,所以要计算c(H+),可依据电解的离子方程式2Cu2++2H2O
2Cu+O2↑+4H+进行解题。
题中电极增重0.064g必为阴极反应生成Cu所致,即n(Cu)=0.064g÷
64g·
mol-1=0.0010mol,然后依据离子方程式中各物质之间的化学计量数之比,求出生成的c(H+)。
2Cu2++2H2O
2Cu+O2↑+4H+
2mol 4mol
0.0010mol c(H+)×
0.50 c(H+)=
=4.0×
B
例7.(04广东、11)pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>
a,则该电解质可能是( )
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
A
解析:
用惰性电极Na2SO4溶液,pH不变,电解H2SO4溶液和AgNO3溶液,pH减小,故选A。
例8.(05天津、12)金属镍有广泛的用途。
粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:
Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
D
提示:
根据电解精炼铜原理知,电解制备高纯度Ni时要用NiSO4做电解质溶液,且电解前后Ni2+浓度基。
例9.在玻璃圆筒中盛有两种无色的互不相溶的中性液体。
上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如图。
接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。
停止通电,取出电极,用搅棒上下剧烈搅动。
静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。
根据上述实验回答:
(1)阳极电极反应式为__________________
(2)阴极电极反应式为_______________
(3)原上层液体是_______________________________________。
(4)原下层液体是_______________________________________。
(5)搅拌后两层液体颜色发生变化的原因是:
________________________________。
(6)要检验上层液体中含有的金属离子,其方法是:
_____________,现象是:
________
(1)2
=I2
(2)2
=H2↑
(3)KI(或NaI等)水溶液(4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
(6)焰色反应 透过蓝色钴玻璃观察火焰呈紫色(其它合理答案同样给分。
例如,若③中答NaI水溶液,这里答火焰呈黄色。
)
2.电解的几种情况与pH变化
(1)氯化铜溶液电解
(2)盐酸电解
(3)硫酸钾溶液电解
(4)溴化钙溶液电解
(5)硫酸铜溶液、以铜为电极的电解
【典型例题】
[例1]实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极Pb+SO42-=PbSO4+2e-正极PbO2+4H++SO42-+2e-=PbSO4+2H2O,今若制Cl20.050mol,这时电池内消耗H2SO4的物质的量至少是()
A.0.025molB.0.050molC.0.10molD.0.20mol
C
根据电源和电解池中转移电子数相同来解题。
[例2]下图各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是()
A.④>
②>
①>
③B.②>
③>
④
C.④>
①D.③>
④>
①
A
考察原电池、电解池中金属电极的消耗情况比较。
[例3]近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。
以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
。
下列有关说法正确的是()
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:
I––6e–+3H2O=IO3–+6H+
C.溶液调节至强酸性,对生产有利
D.电解前后溶液的pH几乎不变
BD
考察基本电解原理的应用。
[例4]①某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在右边画出能够实验这一反应的装置图。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。
请你分析其原因:
。
②两极与电源的正负极接反了,或铜棒接电源的负极了等。
考察对于电解原理的分析。
[例5]在下图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;
当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。
请回答下列问题:
(1)A接的是电源的极,B是该装置。
(2)写出电解时反应的总离子方程式。
(3)电解后溶液的pH为;
要使电解后溶液恢复到电解前的状态,则需加入,其质量为。
(假设电解前后溶液的体积不变)
(1)负极;
阳极;
(2)2Cu2++2H2O2Cu+O2↑+4H+(3)1;
CuO,2g
考察电解池中离子放电顺序的应用。
[例6]用惰性电极电解M(NO3)x的水溶液,当阴极增重ag,阳极同时产生bLO2(STP),从而知M的相对分子质量为()
A.(22.4ax)/bB.(11.2ax)/bC.(5.6ax)/bD.(2.5ax)/b
考察电解池中电极反应的基本判断。
[例7]用铂电极电解x下列溶液一段时间后,再加入一定量的某物质(括号内),能与原来溶液浓度一样的是()
A.
(CuCO3)B.NaOH(NaOH)
C.NaCl(HCl)D.CuSO4[
]
AC
考察溶液的复原方法。
[例8]从H+、Cu2+、Na+、SO42-、Cl-五种离子中恰当地组成电解质,按下列要求进行电解:
(1)以石墨为电极进行电解,使电解质质量减少,水质量不变,可采用的电解质是__________________
(2)以石墨为电极进行电解,使电解质质量不变,水质量减少,可采用的电解质是________________
(3)以碳棒为阳极,铁棒为阴极进行电解,使电解质和水的质量都减少,可采用的电解质是______________________
(1)HCl、CuCl2
(2)NaHSO4、Na2SO4、H2SO4(3)NaCl、CuSO4
考察电解中根据放电离子的选择来确定物质。
【模拟试题】
(答题时间:
30分钟)
1.某种蓄电池的充放电过程可表示为:
Fe+NiO2+2H2O,该电池充电时,阳极是,电极反应式为。
2.将质量分数为0.052(5.2%)的NaOH溶液1L(密度为1.06g·
cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是()
NaOH的质量分数
阳极析出物的质量(g)
阴极析出物的质量(g)
0.062
19
152
C
0.042
1.2
9.4
3.电镀和电解精炼的原理来源于电解,但与通常意义上的电解又有所不同。
(1)电镀时,须用镀层金属作极,镀件作极,电镀液中含有。
电镀过程中,电镀液中金属离子浓度理论上保持不变。
(2)电解精炼制高纯度金属时,须用粗金属作极,纯金属作极,电解液中含该金属的离子。
4.下列关于铜电极的叙述不正确的是()
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜作阳极
C.在镀件上电镀铜时,用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
5.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应
①Br2+2e-=2Br- ②2Br--2e-=Br2
③Zn–2e-=Zn2+ ④Zn2++2e-=Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是( )
A.②和③ B.②和①C.③和① D.④和①
6.用铂电极电解下列物质的水溶液,工作一段时间后溶液pH变小的是()
A.稀硫酸B.Na2SO4C.AgNO3D.KI
7.石墨作电极电解下列溶液,阴阳两极产生的气体体积比为2:
1,且电解液pH增大的是()
A.KClB.NaOHC.Na2SO4D.H2SO4
8.工业上为了处理含有Cr2O72-酸性工业废水,采用下面的处理方法:
往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有
和
沉淀生成,工业废水中铬(Cr)的含量已低于排放标准。
(1)电极反应式:
阳极___________,阴极_____________
(2)写出Cr2O72-变为Cr3+的离子方程式______________
(3)工业废水pH升高的原因_________________________
(4)____(填“能”或“不能”)改用石墨电极,原因______________
9.用质量为100g的铜作电极电解AgNO3溶液,电解一段时间后,两极的质量相差28g,此时两极质量分别是:
阳极________________,阴极________________
10.关于铜电极的叙述正确的是()
B.用电解法精练粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
11.同一电路分别电解足量CuCl2溶液和AgNO3溶液,如果析出64g铜,则可析出银的质()
A.108gB.54gC.216gD.64g
12.同一电路串联四个电解槽,分别电解以下四种物质的水溶液,阴极析出物质质量最多的是()
A.CuSO4B.
C.KNO3D.NaOH
【试题答案】
1.
;
+2OH--2e-=NiO2+2H2O
2.B3.
(1)阳;
阴;
镀层金属离子;
(2)阳;
阴。
4.D5.A6.AC7.B
8.
(1)Fe-2e-=Fe2+;
2H++2e-=H2↑
(2)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++14H2O阴极反应消耗H+,溶液中的氧化还原反应也消耗H+,使溶液pH升高。
(3)不能;
若用石墨做电极,则无法产生还原剂Fe2+,使Cr2O72-还原为Cr3+,变成沉淀除去
9.93.6g;
121.6g10.AC11.C12.A
【试题解析】
1.二次电池的放电过程是原电池原理,充电过程是电解池原理,所以阳极