中考化学化学方程式Word下载.docx
《中考化学化学方程式Word下载.docx》由会员分享,可在线阅读,更多相关《中考化学化学方程式Word下载.docx(9页珍藏版)》请在冰豆网上搜索。
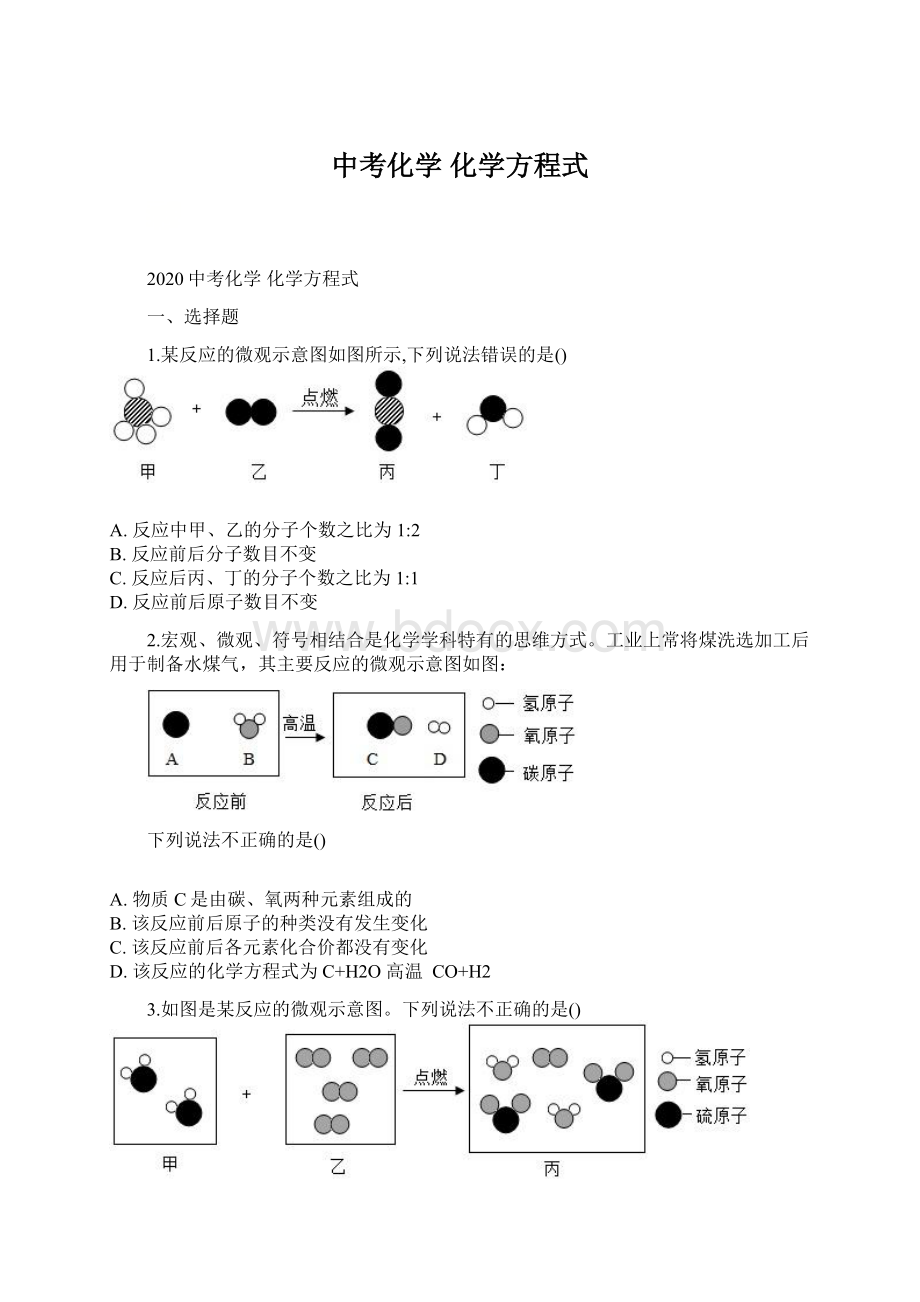
CO+H2
3.如图是某反应的微观示意图。
A.反应后硫元素化合价升高
B.生成物均为氧化物
C.反应后分子总数减少
D.参加反应的甲、乙分子个数比为1:
4.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。
下列说法中不正确的是()
物质
甲
乙
丙
丁
反应前物质质量/g
8
32
5
4
反应后物质质量/g
16
X
24
A.X=5
B.乙物质中至少有两种元素
C.丙一定是该反应的催化剂
D.反应中甲、乙两物质的质量比为2:
7
5.在密闭容器内,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是()
A.该反应符合质量守恒定律
B.生成的甲,丙两物质的质量比为8:
C.乙可能是该反应的催化剂
D.参加反应的丁的质量等于生成的甲和丙的质量之和
6.丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化的微观示意图如图。
下列说法正确的是()
A.甲中碳、氢元素质量比为3:
B.乙和丙的元素组成相同
C.
44g甲完全燃烧至少需160g乙
D.生成的丙与丁的分子个数比为1:
7.某同学取8gZnO、Al2O3、Cu的混合固体,与73g20%的稀盐酸混合后恰好完全反应,则该混合固体中金属元素的百分含量为()
A.
70%
B.
40%
30%
D.
60%
8.对一定量氯酸钾和二氧化锰的混合物加热,下列图像能正确表示对应变化关系的是(
)
A.
B.
C.
D.
9.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中两个时刻各物质的质量如图所示,图中a、b、c、d分别表示相应物质的质量。
b的数值为14
B.该反应为复分解反应
C.反应过程中乙与丁发生改变的质量比为5:
6
D.充分反应后生成丙的质量为37.5g
10.一定质量的
CaCO3样品高温煅烧,若样品分解了75.0%,则剩余固体中含
Ca
元素的质量分数为()
53.3%
71.4%
59.7%
34.6%
11.工业上,利用溶液X(溶质为CuCl2和HCl)在50℃时与Cu反应制作电路。
CuCl2消耗后,HCuCl2经处理又能转化为CuCl2,流程如图。
下列说法错误的是()
已知:
①反应I
CuCl2+Cu+2HCl=2HCuCl2
②反应Ⅱ2HCuC12+H2O2=2CuCl2+2H2O
A.反应I和Ⅱ涉及的元素中仅Cu、O元素的化合价发生了变化
B.反应Ⅱ中生成的CuCl2质量与溶液X中CuCl2质量一定相同
C.工业上,每溶解6.4kg
Cu时,外界只需提供34kg
10%的双氧水就能使生成的
HCuCl2全部转化为CuCl2
D.若由Cu、CuCl、CuCl2中的若干种组成的10.66g混合物中,铜元素为6.4g,则该混合物中一定含CuCl2
12.盛有等质量、等质量分数稀盐酸的两只烧杯,放在托盘天平的左右两盘,天平平衡,在左盘烧杯中加入10gCaCO3,恰好完全反应,若要使天平重新平衡,则右盘烧杯中应加入的下列物质是()
5.6g铁和锌
10g镁和氧化镁
10g碳酸镁
10g碳酸镁和碳酸锌
二、填空解答题
1.如图是氢气和氧气发生反应的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)A图所示物质属于___(填物质分类),从微观角度说明理由是___;
(3)画出比氧元素多一个周期少一个族的元素的原子结构示意图___.
2.华为公司作为我国高新科技的代表,一直致力于核心技术的研发,其自主研制的“麒麟”芯片已达到世界领先水平,该芯片的主要材料为高纯度的单质硅。
请回答以下与硅有关的问题:
(1)如图是硅元素在元素周期表中的相关信息及其原子结构示意图。
硅元素属于___(填“金属”或“非金属”)元素,硅原子的最外层上有___个电子;
(2)工业上制粗硅原理:
二氧化硅与碳单质在高温条件下生成单质硅和一种可燃性气体物质,请写出该反应的化学方程式:
___。
3.质量相等的四种物质①H2O2②KMnO4③KClO3④H2O,完全分解后所制得氧气的质量由大到小的顺序为___(填序号,下同);
四种金属①Zn②Mg③Al④Fe分别投入质量相等且足量的稀硫酸中,充分反应后所得四种溶液的质量相等,则投入金属的质量由小到大的顺序为___。
三、实验探究题
1.小英同学从资料中得知:
质量守恒定律的发现经历了漫长、曲折的过程。
【实验回顾】
1756年,俄国化学家罗蒙诺索素夫将金属锡放在密闭容器里煅烧,冷却后在密闭容器里称量,发现总质量和煅烧前没有变化。
1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气,得到了与罗蒙诺索夫相同的结论,拉瓦锡还通过这个实验研究了___,成就了化学史上的另一经典实验。
【实验重现】
小英同学在老师的指导下,将铁粉、活性炭粉、食盐按一定比例加水混合后,涂在用铁片折成的连续的Z形架表面,然后放入盛满氧气的集气瓶中。
通过如图所示装置对“化学反应中,反应物与生成物的质量关系”进行实验探究,实验过程中做到操作规范,准确称量和细致观察。
(1)证明化学反应发生且体现质量守恒定律的现象有:
___,___。
(2)此实验用氧气替代空气的主要目的是___。
(3)实验室里现有过氧化氢溶液,二氧化锰粉末,以及下列仪器:
①写出编号仪器的名称:
B___。
②利用上述药品,仅器:
制取少量纯净氧气,其简易制取装置应选择的仪器有___(填序号),反应的化学方程式为___,能否组装一套制氧气的装置,以控制反应的发生和停止。
___(填“能”或“否”),并说明理由___。
【总结与反思】
1663年,英国化学家波义耳将金属汞放在密闭容器里煅烧,冷却后称量时打开了盖,得出的结论是物质的总质量增加了,导致波义耳与质量守恒定律失之交臂,你认为质量增大的原因是:
四、计算题
1.侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下:
NaCl+CO2+NH3+H2O═NaHCO3+NH4Cl,请计算:
(1)氯化铵中氮元素的质量分数。
(2)生产8.4t碳酸氢钠,理论上需要氯化钠的质量。
参考答案
1.C2.C3.D4.C5.B6.C7.D8.C9.A10.C11.BC12.C
1.
(1)由质量守恒定律反应前后原子的种类及数目不变可知,在B图中应补充一个水分子和一个氢分子,图示是:
(2)A图所示物质属于混合物,从微观角度说明理由是:
A中的物质是由不同种分子构成的;
(3)比氧元素多一个周期少一个族的原子,该原子的核外应有三个电子层、最外层的电子数是5,该原子应是磷原子,原子结构示意图为:
。
2.
(1)硅元素属于非金属元素,硅原子的最外层上有4个电子;
(2)二氧化硅与碳单质在高温条件下生成单质硅和一种可燃性气体一氧化碳,该反应的化学方程式:
SiO2+2C
Si+2CO↑。
故填:
非金属;
4;
3.④①③②;
①④②③。
1.【实验回顾】拉瓦锡还通过这个实验研究了空气的成分或空气中氧气的含量等,成就了化学史上的另一经典实验;
故答案为:
空气的成分或空气中氧气的含量等;
(合理即可)
铁片上的物质变红或有红色物质生成;
天平平衡或质量不变;
铁片上的物质变红或有红色物质生成:
(2)此实验用氧气替代空气的主要目的是:
加快反应的速率或增大反应物的浓度等;
(3)①锥形瓶是常用的反应容器;
制取少量纯净氧气,其简易制取装置应选择的仪器有:
CDHIA;
过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;
不能组装一套制氧气的装置,以控制反应的发生和停止,因为二氧化锰是粉末状,无法实现固液分离;
①锥形瓶;
②CDHIA;
2H2O2
MnO2
2H2O+O2↑;
否;
二氧化锰是粉末状,无法实现固液分离;
【总结与反思】导致波义耳与质量守恒定律失之交臂,我认为质量增大的原因是:
有空气进入;
1.
(1)氯化铵中氮元素的质量分数为1414+1×
4+35.5×
100%≈26.2%。
(2)生产8.4t碳酸氢钠,设理论上需要氯化钠的质量为x
NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl。
58.5
84
x
8.4t
58.584=x8.4t
x=5.85t
(1)26.2%;
(2)5.85t。