专题17 电化学原理综合应用三年高考化学试题分项版解析附解析801399Word下载.docx
《专题17 电化学原理综合应用三年高考化学试题分项版解析附解析801399Word下载.docx》由会员分享,可在线阅读,更多相关《专题17 电化学原理综合应用三年高考化学试题分项版解析附解析801399Word下载.docx(11页珍藏版)》请在冰豆网上搜索。
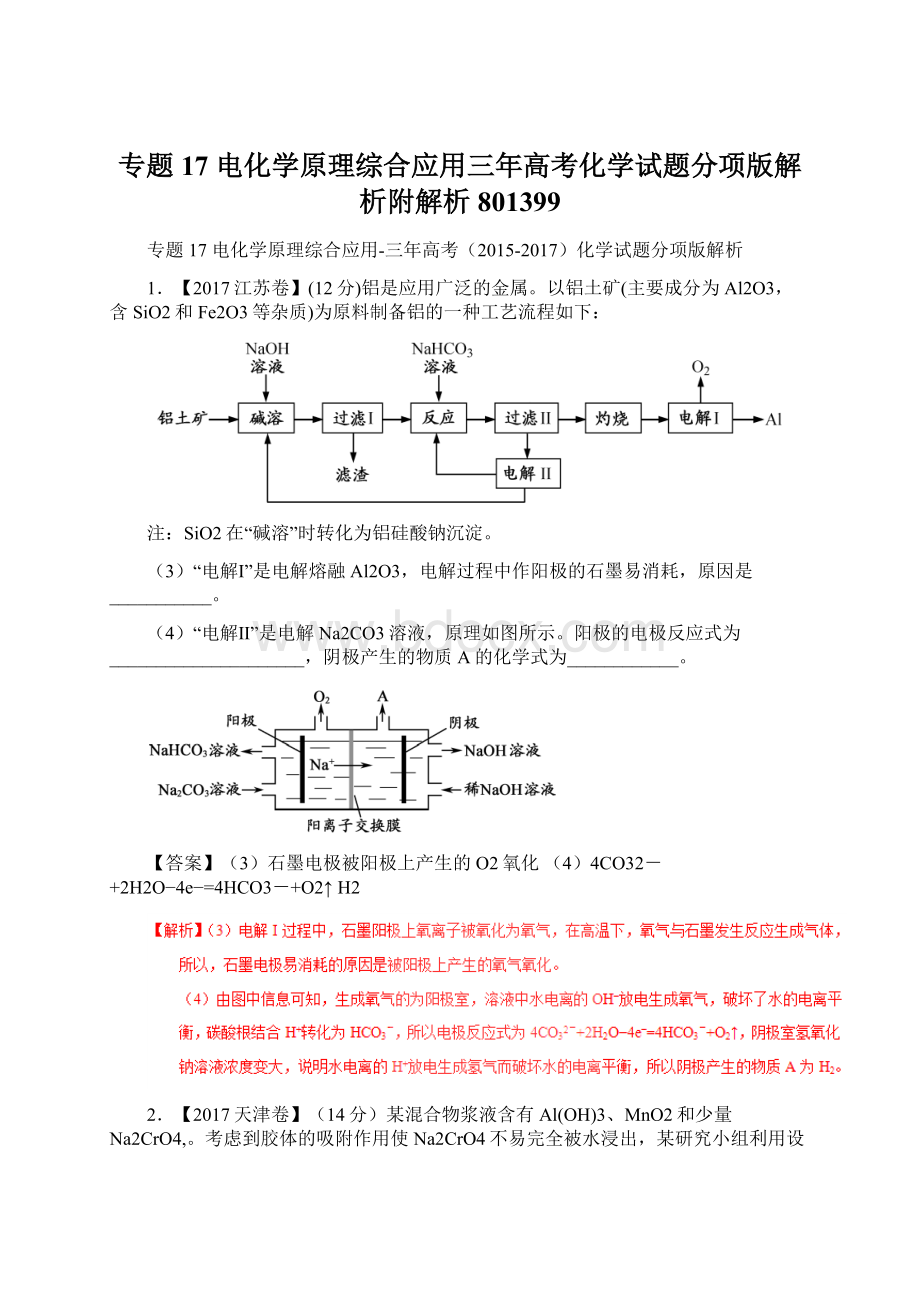
阴极室生成的物质为___________(写化学式)。
(4)在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液
CrO42-和Cr2O72-NaOH和H2
3.【2016新课标1卷】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是______。
(3)NaOH溶液;
Na2CO3溶液;
ClO2−(或NaClO2);
【解析】
(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;
向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
4.【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH
pH=2.5
pH=4.5
NO3—的去除率
接近100%
<50%
24小时pH
接近中性
铁的最终物质形态
pH=4.5时,NO3—的去除率低。
其原因是________。
(4)其他条件与
(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
约10%
约3%
1小时pH
与
(2)中数据对比,解释
(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:
__________。
(1)①铁②NO3-+8e-+10H+=NH4++3H2O
(2)因为铁表面生成不导电的FeO(OH),阻止反应进一步发生
(4)Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全,初始pH高时,产生的Fe2+浓度小,从而造成NO3—去除率和铁的最终物质形态不同。
(1)①Fe是活泼的金属,根据还原水体中的NO3-的反应原理图可知,Fe被氧化作负极;
②正极发生得到电子的还原反应,因此正极是硝酸根离子被还原为NH4+,该溶液为酸性电解质溶液,结合元素和电荷守恒可知电极反应式为:
NO3-+8e-+10H+=NH4++3H2O;
(2)从pH对硝酸根去除率的影响来看,初始pH=4.5时去除率低,主要是因为铁离子容易水解生成FeO(OH),同时生成的Fe3O4产率降低,且生成的FeO(OH)不导电,所以NO3-的去除率低;
(4)Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全;
初始pH高时,由于Fe3+的水解,Fe3+越容易生成FeO(OH),产生的Fe2+浓度小,从而造成NO3—去除率和铁的最终物质形态不同。
5.【2016江苏卷】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。
将含有Cr2O72–的酸性废水通过铁炭混合物,在微电池正极上Cr2O72–转化为Cr3+,其电极反应式为_____________。
(1)Cr2O72–+6e-+14H+=2Cr3++7H2O
6.【2016天津卷】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。
(1)但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:
____。
(5)化工生产的副产氢也是氢气的来源。
电解法制取有广泛用途的Na2FeO4,同时获得氢气:
Fe+2H2O+2OH−
FeO42−+3H2↑,工作原理如图1所示。
装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。
若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。
已知:
Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH−)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:
_____________。
(1)H2+2OH--2e-=2H2O(5)①阳极室②防止Na2FeO4与H2反应使产率降低
③M点:
c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:
c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低)。
7.【2016浙江卷】催化还原CO2是解决温室效应及能源问题的重要手段之一。
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。
(5)阴CO2+6H++6e−==CH3OH+H2O
(5)二氧化碳变甲醇,碳元素的化合价降低,得到电子,说明其在阴极反应,其电极反应为:
CO2+6H++6e-=CH3OH+H2O
8.【2015安徽卷】
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
(4)2H++NO3-+e-=NO2↑+H2O,正,Al在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
(4)正极得电子发生还原反应,故电极反应式为:
2H++NO3-+e-=NO2↑+H2O;
在电场作用下,阳离子向电池正极移动;
由图像得t1时刻电流方向改变,说明电负极发生变化,Al因为发生钝化不再进一步反应。
9.【2015北京卷】
(14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理:
。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。
处理至合格的方法是。
(4)①a室:
2H2O-4e-=O2↑+4H+,H+通过阳离子膜进入b室,发生反应:
HCO3-+H+=CO2↑+H2O。
②c室的反应:
2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至接近装置入口海水的pH
10.【2015新课标2卷】
(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp近似值
10-17
10-39
(1)该电池的正极反应式为,电池反应的离子方程式为
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zng。
(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;
滤渣的主要成分是MnO2、______和,欲从中得到较纯的MnO2,最简便的方法是,其原理是。
(1)MnO2+e—+H+=MnOOH;
Zn+2MnO2+2H+=Zn2++2MnOOH
(2)0.05g
(3)加热浓缩、冷却结晶;
铁粉、MnOOH;
在空气中加热;
碳粉转变为CO2,MnOOH氧化为MnO2
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵。
根据表中数据可知氯化锌的溶解度受温度影响较大,因此两者可以通过结晶分离回收,即通过蒸发浓缩、冷却结晶实现分离。
二氧化锰、铁粉、MnOOH均难溶于水,因此滤渣的主要成分是二氧化锰、碳粉、MnOOH。
由于碳燃烧生成CO2,MnOOH能被氧化转化为二氧化锰,所以欲从中得到较纯的二氧化锰,最简便的方法是在空气中灼烧。
11.【2015新课标2卷】
(15分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
①电解时发生反应的化学方程式为。
(2)①NH4Cl+2HCl
3H2↑+NCl3
(2)①根据流程图可知电解时生成氢气和NCl3,则电解时发生反应的化学方程式为NH4Cl+2HCl
3H2↑+NCl3。
12.【2015重庆卷】
(14分)我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是(填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为;
③若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为L(标准状况)。
(5)①c②2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓③0.448
13.【2015四川卷】
(16分)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:
FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。
请回答下列问题:
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。
该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是。
(5)FeS2+4e-=Fe+2S2-
(5)正极得电子,化合价降低,可得正极方程式:
FeS2+4e-=Fe+2S2-。
14.【2015上海卷】
(本题共12分)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。
下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为:
、。
(3)精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中位置流出(选填“a”、“b”、“c”或“d”)。
(1)2Cl-+2H2O
Cl2↑+H2↑+2OH-。
(2)阻止OH-进入阳极室,与Cl2发生副反应:
2NaOH+Cl2=NaCl+NaClO+H2O;
阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)a;
d;
(2)图中的离子交换膜只允许阳离子通,是阳离子交换膜,可以允许阳离子通过,不能使阴离子通过,这样就可以阻止阴极溶液中的OH-进入阳极室,与氯气发生反应,阻止Cl-进入阴极室,使在阴极区产生的NaOH纯度更高。
同时可以阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)随着电解的进行,溶质NaCl不断消耗,所以应该及时补充。
精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出;
水不断消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。
15.【2015山东卷】
(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料。
LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。
B极区电解液为________溶液(填化学式),阳极电极反应式为_________,电解过程中Li+向_____电极迁移(填“A”或“B”)。
(1)LiOH;
2Cl‾—2e‾=Cl2↑;
B
16.【2015海南卷】
(9分)
(4)右图所示原电池正极的反应式为。
(4)Ag++e-=Ag
(4)该原电池的实质是Cu与银离子发生置换反应生成Ag单质,所以正极是生成Ag单质的还原反应。