精校普通高等学校招生全国统一考试安徽卷化学Word格式.docx
《精校普通高等学校招生全国统一考试安徽卷化学Word格式.docx》由会员分享,可在线阅读,更多相关《精校普通高等学校招生全国统一考试安徽卷化学Word格式.docx(12页珍藏版)》请在冰豆网上搜索。
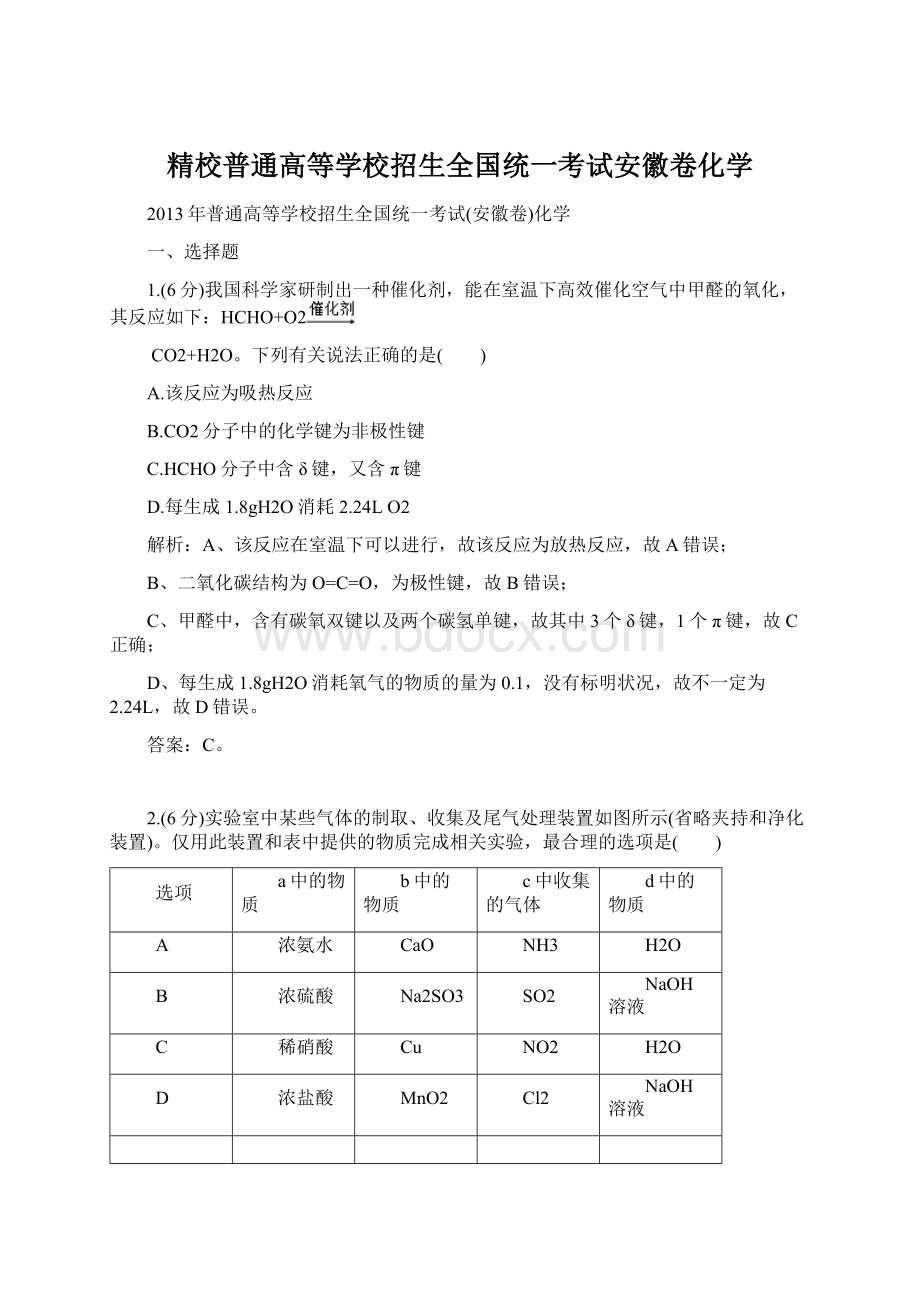
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
D
浓盐酸
MnO2
Cl2
A.A
B.B
C.C
D.D
A、氨气的密度比空气小,不能使用向上排空气法,故A错误;
B、SO2气体的密度比空气大,能使用向上排空气法,SO2气体能与氢氧化钠迅速反应,所以吸收时要防倒吸,故B正确;
C、铜与稀硝酸反应需要加热,且产生的气体为NO,不能用水吸收,故C错误;
D、制取氯气需要加热,氯气的密度比空气大,能使用向上排空气法,氯气用氢氧化钠溶液吸收时不需要防倒吸,故D错误。
B。
3.(6分)下列分子或离子在指定的分散系中能大量共存的一组是( )
A.银氨溶液:
Na+、K+、NO3﹣、NH3•H2O
B.空气:
CH4、CO2、SO2、NO
C.氢氧化铁胶体:
H+、K+、S2﹣、Br﹣
D.高锰酸钾溶液:
H+、Na+、SO42﹣、葡萄糖分子
A。
银氨溶液在氨水中能稳定存在,在碱性条件下该组离子不发生任何反应,能大量共存,故A正确;
空气的氧气与NO反应生成NO2,反应的化学方程式为2NO+O2=2NO2,不能大量共存,故B错误;
氢氧化铁胶体在酸性条件下离子反应为Fe(OH)3+3H+═Fe3++3H2O,氢氧化铁胶体中的三价铁可氧化具有还原性的硫离子,不能大量共存,故C错误;
D。
高锰酸钾溶液在酸性条件下具有强氧化性,葡萄糖分子具有还原性,高锰酸钾与葡萄糖能发生氧化还原反应,不能大量共存,故D错误。
4.(6分)热激活电池可用作火箭、导弹的工作电源。
一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能。
该电池总反应为:
PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
A.正极反应式:
Ca+2Cl﹣﹣2e﹣=CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7gPb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
A.正极发生还原反应,电极方程式为PbSO4+2e﹣+2Li+=Li2SO4+Pb,故A错误;
B.放电过程中阳离子向正极移动,故B错误;
C.根据电极方程式PbSO4+2e﹣+2Li+=Li2SO4+Pb,可知每转移0.1mol电子,理论上生成0.05molPb,质量为10.35g,故C错误;
D.常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,故D正确。
5.(6分)一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)⇌MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
x
y
温度
容器内混合气体的密度
CO的物质的量
CO2与CO的物质的量之比
SO2的浓度
平衡常数K
MgSO4的质量(忽略体积)
CO的转化率
该反应为正方向体积增加且吸热。
A、升高温度,平衡正向移动,气体的质量增加,密度增大,故A正确;
B、增加CO的量,平衡正向移动,但压强增大,转化的量,没有上一平衡多,故比值减小,故B错误;
C、平衡常数只与温度有关,浓度变化平衡常数不变,故C错误;
D、因MgSO4为固体,增加其量,对CO的转化率无影响,故D错误。
6.(6分)我省盛产矿盐(主要成分是NaCl,还含有SO42﹣等其他可溶性杂质的离子)。
A.由矿盐生产食盐,除去SO42﹣最合适的试剂是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐水中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
A.除去硫酸根离子的同时,引入了新的杂质硝酸根离子,应加入氯化钡溶液,故A错误;
B.要得到钠和氯气需要电解熔融的NaCl,故B错误;
C.增加氯离子的量,AgCl的沉淀溶解平衡向逆向移动,溶解度减小,故C错误;
D.饱和纯碱溶液呈碱性,可鉴别,故D正确。
7.(6分)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3﹣+H2O⇌H2SO3+OH﹣①HSO3﹣⇌H++SO32﹣②,向0.1mol•L﹣1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3﹣)增大
B.加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3﹣)+c(OH﹣)+
c(SO32﹣)
C.加入少量NaOH溶液,
的值均增大
D.加入氨水至中性,则2c(Na+)=c(SO32﹣)>c(H+)=c(OH﹣)
A、加入少量金属Na,Na与HSO3﹣电离出的H+反应,促使平衡②右移,HSO3﹣离子浓度减小,又促使平衡①左移,平衡①左移,平衡②右移,溶液中c(HSO3﹣)浓度减小,故A错误;
B、加入少量Na2SO3固体溶解后溶液中存在电荷守恒,c(H+)+c(Na+)=2c(SO32﹣)+c(HSO3﹣)+c(OH﹣),故B错误;
C、加入氢氧化钠促进电离,平衡右移,抑制水解,平衡左移,c(SO32﹣),c(OH﹣)浓度增大;
,
比值增大,故C正确;
D、加入氨水至中性,c(H+)=c(OH﹣),电荷守恒为c(H+)+c(NH4+)+c(Na+)=c(OH﹣)+2c(SO32﹣)+c(HSO3﹣),故D错误。
二、非选择题
8.(15分)X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期,其相关信息如下表:
元素
相关信息
X
X的最高价氧化物对应的水化物化学式为H2XO3
Y
Y是地壳中含量最高的元素
Z
Z的基态原子最外层电子排布式为3s23p1
W
W的一种核素的质量数为28,中子数为14
(1)W位于元素周期表第 周期第 族;
W的原子半径比X的 (填“大”或“小”)。
三ⅣA大
(2)Z的第一电离能比W的 (填“大”或“小”);
XY2由固态变为气态所需克服的微粒间作用力是 ;
氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
小分子间作用力乙醇
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;
W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液Si+4HF=SiF4↑+2H2↑;
(4)在25℃、101kPa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
4Al(s)+3O2(g)=2Al2O3(s)△H=﹣3352kJ/mol
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期,Y是地壳中含量最高的元素,则Y为氧元素;
X的最高价氧化物对应的水化物化学式为H2XO3,最高正化合价为+4,处于ⅣA族,原子序数小于氧元素,故X为碳元素;
Z的基态原子最外层电子排布式为3s23p1,处于第三周期第ⅢA族,则Z为Al元素;
W的一种核素的质量数为28,中子数为14,其质子数=28﹣14=14,故W为Si元素。
9.(16分)有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
(1)B的结构简式是 ;
E中含有的官能团名称是 。
HOOC(CH2)4COOH羟基和氨基;
(2)由C和E合成F的化学方程式是 。
CH3OOC(CH2)4COOCH3+2HOCH2CH2NH2
HOCH2CH2NHOC(CH2)4CONHCH2CH2OH+2CH3OH;
(3)同时满足下列条件的苯的同分异构体的结构简式是 。
①含有3个双键
②核磁共振氢谱只显示1个吸收峰
③不存在甲基
(4)乙烯在实验室可由 (填有机物名称)通过 (填反应类型)制备。
乙醇消去反应
(5)下列说法正确的是。
a.A属于饱和烃
b.D与乙醛的分子式相同
c.E不能与盐酸反应
d.F可以发生酯化反应
abd
在镍作催化剂条件下,苯和氢气发生加成反应生成环己烷,环己烷被氧气氧化生成B,在催化剂条件下,B和甲醇发生酯化反应生成C,根据C的结构结合B的分子式知,B是1,6﹣己二酸;
在银作催化剂条件下,乙烯被氧气氧化生成环氧乙烷,环氧乙烷和氨气发生加成反应生成E,C和E发生取代反应生成F。
10.(13分)二氧化铈(CeO2)是一种重要的稀土氧化物。
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。
某课题组以此粉末为原料回收铈,设计实验流程如图:
(1)洗涤滤渣A的目的是为了除去 (填离子符号),检验该离子是否洗净的方法是 。
滤渣A上含有FeCl3,洗涤滤渣A的目的是为了除去Fe3+;
取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,反之,未洗净;
Fe3+;
取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,反之,未洗净。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的离子方程式为:
6H++H2O2+2CeO2=2Ce3++O2↑+4H2O;
加入稀硫酸和H2O2,CeO2转化为Ce3+,SiO2不反应,滤渣B的成分为SiO2。
6H++H2O2+2CeO2=2Ce3++O2↑+4H2OSiO2
(3)萃取是分离稀土元素的常用方法。
已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。
实验室进行萃取操作时用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,所以TBP不能与水互溶,故答案:
不能分液漏斗
(4)取上述流程中得到了Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000mol/L﹣1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液。
该产品中Ce(OH)4的质量分数为 。
Ce(OH)4~FeSO4
0.0025mol0.1000mol/L﹣1×
0.025L
所以m(Ce(OH)4)=0.0025mol×
208g/mol=0.52g,产品中Ce(OH)4的质量分数为
×
100%=97.01%,
97.01%;
11.(14分)某酸性工业废水中含有K2Cr2O7。
光照下,草酸(H2C2O4)能将其中的Cr2O72﹣转化为Cr3+。
某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用。
为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
实验
编号
初始
pH
废水样品
体积/mL
草酸溶液
蒸馏水
①
4
60
10
30
②
5
③
测得实验①和②溶液中的Cr2O72﹣浓度随时间变化关系如图所示。
①②中PH不同,是探究PH对速率的影响;
则②③是探究不同浓度时草酸对速率的影响。
实验编号
20
(2)上述反应后草酸被氧化为 (填化学式)。
草酸中碳元素化合价为+3价,被氧化为+4价,所以氧化产物为CO2。
CO2
(3)实验①和②的结果表明 ;
实验①中0~t1时间段反应速率v(Cr3+)=
mol•L﹣1•min﹣1(用代数式表示)。
由实验①②表明溶液pH越小,反应的速率越快,所以溶液pH对该反应的速率有影响,v(Cr3+)=2v(Cr2O72﹣)=
2=
mol•L﹣1•min﹣1。
溶液pH对该反应的速率有影响
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:
Fe2+起催化作用;
假设二:
;
假设三:
。
根据铁明矾[Al2Fe(SO4)4•24H2O]组成分析,Al3+起催化作用;
SO42﹣起催化作用。
Al3+起催化作用SO42﹣起催化作用
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等。
溶液中Cr2O72﹣的浓度可用仪器测定)
实验方案(不要求写具体操作过程)
预期实验结果和结论
要证明Fe2+起催化作用,需做对比实验,再做没有Fe2+存在时的实验,所以要选K2SO4•Al2(SO4)3•24H2O;
用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验,反应进行相同时间后,若溶液中c(Cr2O72﹣)大于实验①中c(Cr2O72﹣),则假设一成立;
若两溶液中的c(Cr2O72﹣)相同,则假设一不成立。
实验方案
用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验
反应进行相同时间后,若溶液中c(Cr2O72﹣)大于实验①中c(Cr2O72﹣),则假设一成立;
考试高分秘诀是什么?
试试这四个方法,特别是中考和高考生
谁都想在考试中取得优异的成绩,但要想取得优异的成绩,除了要掌握好相关的知识定理和方法技巧之外,更要学会一些考试技巧。
因为一份试卷的题型有选择题、填空题和解答题,题目的难易程度不等,再加上时间的限制,更需要考生运用考试技巧去合理安排时间进行考试,这样才能获得一个优异的成绩。
在每次考试结束之后,我们总会发现这样有趣的情形:
有的学生能超常发挥,考个好成绩,而有的学生却出现粗心大意的状况,令人惋惜。
有的学生会说这是“运气”的原因,其实更深次的角度来说,这是说明考试准备不足,如知识掌握不扎实或是考试技巧不熟练等,这些正是考前需要调整的重点。
读书学习终究离不开考试,像中考和高考更是重中之重,影响着很多人的一生,下面就推荐一些与考试有关的方法技巧,希望能帮助大家提高考试成绩。
一是学会合理定位考试成绩
你能在一份卷子当中考几分,很大程度上取决于你对知识定理的掌握和熟练程度。
像最后一道选择题和填空题,以及最后两道大题,如果你没有很大把握一次性完成,就要先学会暂时“放一放”,把那些简单题和中等题先解决,再回过头去解决剩下的难题。
因此,在考试来临之前,每位考生必须对自身有一个清晰的了解,面对考试内容,自己处于什么样的知识水平,进而应采取什么样的考试方式,这样才能帮助自己顺利完成考试,获得理想的成绩。
像压轴题的最后一个小题总是比较难,目的是提高考试的区分度,但是一般只有4分左右,很多考生都可以把前面两小题都做对,特别是第一小题。
二是认真审题,理清题意
每次考试结束后,很多考生都会发现很多明明自己会做的题目都解错了,非常可惜。
做错的原因让人既气愤又无奈,如算错、看错、抄错等,其中审题不仔细是大部分的通病。
要想把题目做对,首先就要学会把题目看懂看明白,认真审题这是最基本的学习素养。
像数学考试,就一定要看清楚,如“两圆相切”,就包括外切和内切,缺一不可;
ABC是等腰三角形,就要搞清楚哪两条是腰;
二次函数与坐标轴存在交点,就要分清楚x轴和y轴;
或是在考试过程中遇到熟悉的题目,绝不可掉以轻心,因为熟悉并不代表一模一样。
三是要活用草稿纸
有时候真的很奇怪,有些学生一场考试下来,几乎可以不用草稿纸,但最终成绩也并不一定见得有多好。
不过,我们查看这些学生试卷的时候,上面密密麻麻写了一堆,原来都把试卷当草稿纸,只不过没几个人能看得懂。
考试时间是有限,要想在有限的时间内取得优异的成绩,就必须提高解题速度,这没错,但很多人的解题速度是靠牺牲解题步骤、审清题意等必要环节之上。
就像草稿纸,很多学生认为这是在浪费时间,要么不用,要么在打草稿时太潦草,匆忙抄到试卷上时又看错了,这样的毛病难以在考试时发现。
在解题过程后果,我们应该在试卷上列出详细的步骤,不要跳步,需要用到草稿纸的地方一定要用草稿纸。
只有认真踏实地完成每步运算,假以时日,就能提高解题速度。
大家一定要记住一点:
只要你把每个会做的题目做对,分数自然就会高。
四是学会沉着应对考试
无论是谁,面对考试都会有不同程度的紧张情绪,这很正常,没什么好大惊小怪,偏偏有的学生会把这些情绪放大,出现焦躁不安,甚至是失眠的负面情况,非常可惜。
就像在考试过程中,遇到难题这也很正常,此时的你更应不慌不躁,冷静应对在考试,有些题目难免一时会想不出解题思路,千万记住不要钻牛角尖,可以暂时先放一放,不妨先换一个题目做做,等一会儿往往就会豁然开朗了。
考试,特别像中考和高考这样大型的重要考试,一定要相信一点,那就是所有试题包含的知识定理、能力要求都在考纲范围内,不要有过多的思想负担。
考试遇到难题,容易让人心烦意乱,我们不要急于一时,别总想一口气吃掉整个题目,可以先做一个小题,后面的思路就慢慢理顺了。