浙江专版18学年高中化学专题2化学反应与能量变化第二单元化学反应中的热量第1课时教学案苏教版必修2Word文档格式.docx
《浙江专版18学年高中化学专题2化学反应与能量变化第二单元化学反应中的热量第1课时教学案苏教版必修2Word文档格式.docx》由会员分享,可在线阅读,更多相关《浙江专版18学年高中化学专题2化学反应与能量变化第二单元化学反应中的热量第1课时教学案苏教版必修2Word文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
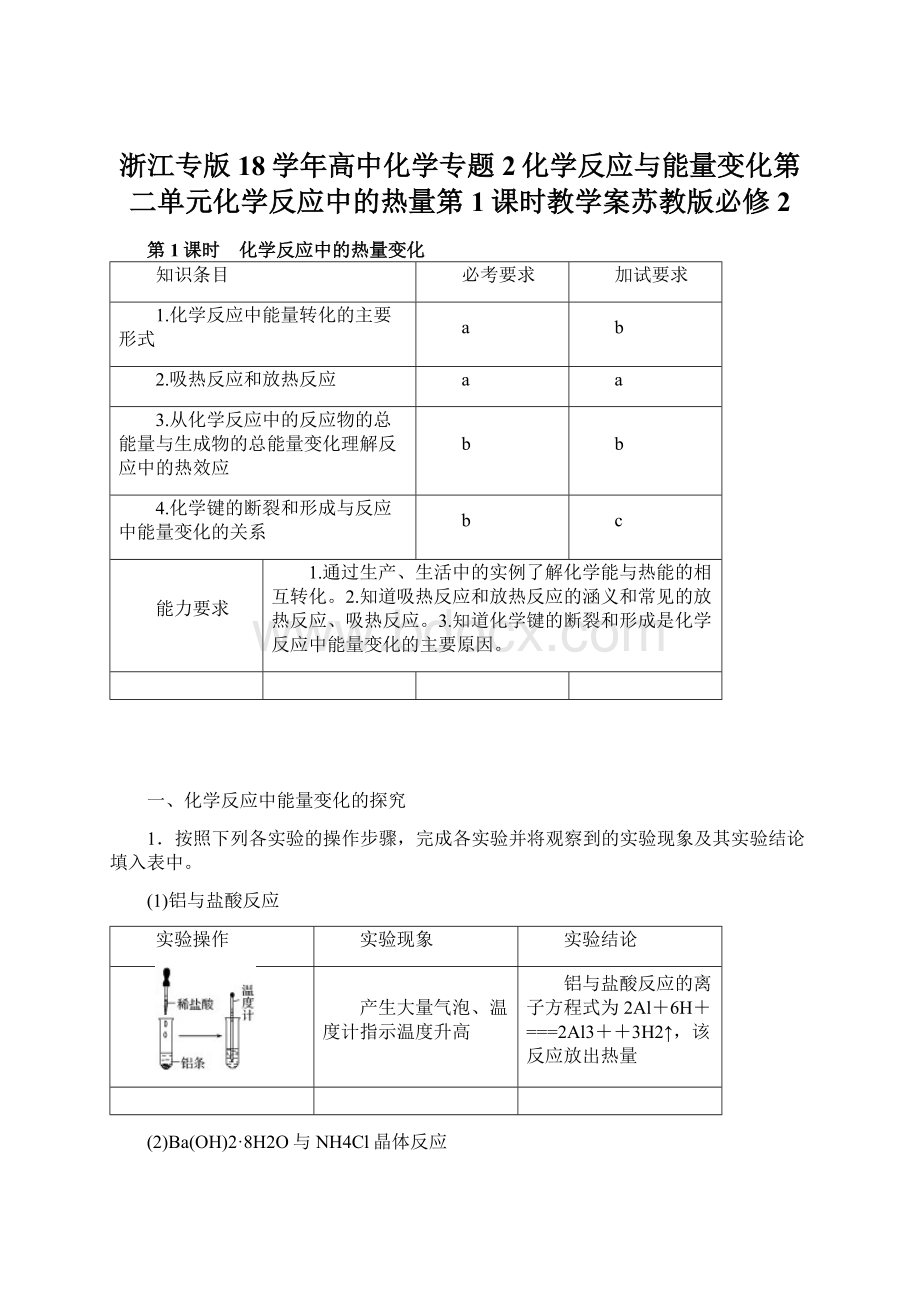
实验结论
产生大量气泡、温度计指示温度升高
铝与盐酸反应的离子方程式为2Al+6H+===2Al3++3H2↑,该反应放出热量
(2)Ba(OH)2·
8H2O与NH4Cl晶体反应
①有刺激性气味气体产生
②用手摸烧杯底部有冰凉感觉
③用手拿起烧杯,玻璃片粘结到烧杯的底部
④烧杯内反应物成糊状
化学方程式为Ba(OH)2·
8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O,该反应吸收热量
由上述实验可知,化学反应都伴随着能量变化,有的放出能量,有的吸收能量。
化学反应中的能量变化有多种形式,但通常主要表现为热量的变化。
化学上把有热量放出的化学反应称为放热反应,把吸收热量的化学反应称为吸热反应。
2.根据前面的学习和生活常识,分析下列反应是吸热反应还是放热反应?
①H2SO4+2KOH===K2SO4+2H2O
②Mg+2HCl===MgCl2+H2↑
③NH4Cl
HCl↑+NH3↑
④2Al+Fe2O3
Al2O3+2Fe
⑤2Mg+O2
2MgO
⑥Ca(OH)2+2NH4Cl===CaCl2+2NH3↑+2H2O
⑦C+CO2
2CO
⑧C+H2O(g)
CO+H2
答案 ③⑥⑦⑧为吸热反应;
①②④⑤为放热反应。
1.常见的放热反应
(1)所有的燃烧反应,剧烈的发光、发热的化学反应;
(2)酸碱中和反应;
(3)大多数的化合反应;
(4)铝热反应;
(5)活泼金属与酸或H2O的反应。
2.常见的吸热反应
(1)消石灰与氯化铵固体的反应;
(2)大多数的分解反应;
(3)碳与水蒸气的反应;
(4)以C、H2、CO为还原剂的氧化还原反应。
1.下列对化学反应的认识中错误的是( )
A.会引起化学键的变化
B.会产生新的物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
答案 C
解析 化学反应不一定引起物质状态的变化,如气相反应:
氮气与氢气化合生成氨气无状态变化。
2.下列变化中属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A.①④B.②④C.③⑤D.④⑥
答案 B
解析 ①③⑥不是化学反应,②④是吸热反应,⑤是放热反应。
二、化学反应中能量变化
1.从化学键角度分析化学反应中的能量变化
(1)请根据下列信息分析氢气燃烧生成水蒸气时,为什么会发生能量变化?
答案 从给出的信息可知,在化学反应过程中,反应物分子中旧键断裂需吸收能量,生成物分子中新键形成放出能量。
断裂1molH2和
molO2中的化学键吸收的能量总和为436kJ+249kJ=685kJ,而形成1molH2O的共价键释放930kJ能量,放出的能量大于吸收的能量,故该反应要放出能量。
(2)化学反应中的能量变化可以用下图形象地表示出来:
①若E1>
E2,反应吸收能量;
②若E1<
E2,反应放出能量。
2.化学反应的能量变化与物质内部能量的关系
(1)从物质内部能量分析化学反应过程:
化学反应的过程可看作“储存”在物质内部的能量(化学能)转化为热能、电能或光能等形式释放出来,或者是热能、电能或光能等转化为物质内部的能量(化学能)被“储存”起来的过程。
(2)化学反应的能量变化与物质内部能量的关系
①图Ⅰ中反应物内部的总能量大于生成物内部的总能量,反应释放能量;
②图Ⅱ中反应物内部的总能量小于生成物内部的总能量,反应吸收能量。
1.化学反应的基本特征:
一是物质发生了变化,即有新物质生成;
二是能量发生了变化,即吸收能量或放出能量。
2.由于拆开不同的化学键消耗的能量不同,形成不同的化学键释放的能量也不同,所以化学反应中总会伴有能量的变化,最终的反应结果表现为吸收能量和放出能量。
3.下列关于反应能量的说法中正确的是( )
A.化学反应中的能量变化,都表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.已知反应:
Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)为放热反应,则反应物总能量<
生成物总能量
D.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2,则2E1=E2
解析 化学反应中的能量变化,不是都表现为热量的变化,还可能有其他能量的变化,如光能等,故A项错误;
放热反应中反应物的总能量大于生成物的总能量,故C项错误;
分子变成原子需要破坏化学键,吸收能量,2E1>
E2,故D项错误。
4.已知断开1molH—H键吸收的能量为436kJ,形成1molH—N键放出的能量为391kJ,根据化学方程式N2+3H2
2NH3,反应完1molN2放出的能量为92.4kJ,则断开1molN≡N键需吸收的能量是( )
A.431kJB.945.6kJC.649kJD.869kJ
解析 设断开1molN≡N键需吸收的能量为x,根据反应放出的能量=形成新键放出的能量-断开旧键吸收的能量,代入数据:
92.4kJ=6×
391kJ-3×
436kJ-x,x=945.6kJ。
1.判断下列说法的正误,正确的在括号内划“√”,错误的在括号内划“×
”。
(1)所有化学反应必然引起物质状态的变化( )
(2)不同的化学反应放出或吸收的能量一般是不相同的( )
(3)同一化学反应中反应物的用量不同时,放出或吸收的能量却相同( )
(4)放出能量越多的反应,通常生成物越不稳定( )
(5)因为氢气在氧气中燃烧是放出能量的,所以水的分解反应一定是吸收能量的( )
答案
(1)×
(2)√ (3)×
(4)×
(5)√
解析 (4)放出能量越多的反应,说明生成物的能量越低,生成物越稳定。
2.根据下图提供的信息,下列所得结论不正确的是( )
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比生成物稳定
D.因为生成物的总能量高于反应物的总能量,所以该反应不需要加热
答案 D
解析 由图可知,生成物的总能量高于反应物的总能量,故一定有其他的能量转化成了化学能,该反应应为吸热反应,A、B正确;
物质能量越低越稳定,C正确;
吸热反应一般需要加热才能发生,D错误。
3.下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④B.只有①②
C.①②③④D.②③④
答案 A
解析 加热才能发生的反应不一定是吸热反应,如铜在氯气中燃烧;
放热反应在常温下不一定容易发生,如N2与H2合成NH3;
反应是放热还是吸热取决于反应物、生成物所具有的总能量的相对大小;
需要加热才能发生的放热反应,如果反应放出的热量达到反应所需要的热量,停止加热反应也能继续进行,如Fe+S
FeS。
4.如图为反应2H2(g)+O2(g)===2H2O(g)的能量变化示意图。
下列说法中正确的是( )
A.拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共放出1368kJ能量
B.由H、O原子形成2molH2O(g),共吸收1852kJ能量
C.2molH2(g)和1molO2(g)反应生成2molH2O(l),共吸收484kJ能量
D.2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量
5.已知在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9kJ的热量。
(1)石墨转化为金刚石属于________变化。
(2)石墨和金刚石相比,________能量高,________更稳定。
(3)推测石墨与金刚石各1mol在相同条件下燃烧,________放出的热量多。
答案
(1)化学
(2)金刚石 石墨 (3)金刚石
解析 同素异形体之间的转化是化学变化;
1mol石墨转化为金刚石,该反应吸收1.9kJ的热量,属于吸热反应,金刚石的能量高,石墨的能量低,故石墨更稳定;
石墨与金刚石各1mol在相同条件下燃烧时金刚石放出的热量多。
[基础过关]
题组一 化学变化的本质及特征
1.物质在发生化学变化时,下列说法正确的是( )
A.反应物的总质量等于生成物的总质量
B.发生电子得失或偏移
C.有化学键的断裂,不一定有新物质生成
D.反应物所具有的总能量等于生成物所具有的总能量
解析 A项符合质量守恒,正确;
非氧化还原反应没有电子得失或偏移,B项不正确;
化学变化时有化学键的断裂,则一定有新物质生成,C项不正确。
2.(2017·
杭州期中)下列与化学反应能量变化相关的说法不正确的是( )
A.任何化学反应都伴随着热量的变化
B.一个反应是吸热反应还是放热反应要看反应物和生成物具有总能量的相对大小
C.化学键的断裂一定吸收能量,化学键的形成一定释放能量
D.化学反应过程中的能量变化除热能外,也可以是光能、电能等
3.(2017·
台州市月考)下列说法不正确的是( )
A.化学反应的实质是旧化学键的断裂和新化学键的形成
B.物质由高能量向低能量转化时,放出热量
C.将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多
D.干冰升华时放出大量的热
题组二 放热反应和吸热反应的判断
4.(2017·
杭州市期末)对于化学反应中的能量变化,表述正确的是( )
A.中和反应是吸热反应
B.燃烧属于放热反应
C.断开化学键的过程会放出能量
D.加热才能发生的反应一定是吸热反应
解析 常见的放热反应:
所有的物质燃烧,所有金属与酸反应、金属与水反应,所有中和反应,绝大多数的化合反应和铝热反应。
5.(2017·
湖州市期中)下列物质放入水中,会显著放热的是( )
A.生石灰B.硝酸铵
C.氯化钠D.蔗糖
6.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·
8H2O晶体与NH4Cl晶体的反应
解析 锌粒与稀硫酸的反应、甲烷的燃烧反应均是放热反应,不合题意;
Ba(OH)2·
8H2O晶体与NH4Cl晶体的反应是吸热反应,但元素的化合价无变化,是非氧化还原反应,D项不合题意。
7.有下列物质:
①NaOH固体;
②浓硫酸;
③NH4NO3晶体;
④CaO固体。
现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内红墨水的水面呈现如下图所示状态。
判断加入的物质可能是( )
A.①②③④B.①②④
C.②③④