华东师大版九年级上学期阶段性测试一科学试题Word格式文档下载.docx
《华东师大版九年级上学期阶段性测试一科学试题Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《华东师大版九年级上学期阶段性测试一科学试题Word格式文档下载.docx(12页珍藏版)》请在冰豆网上搜索。
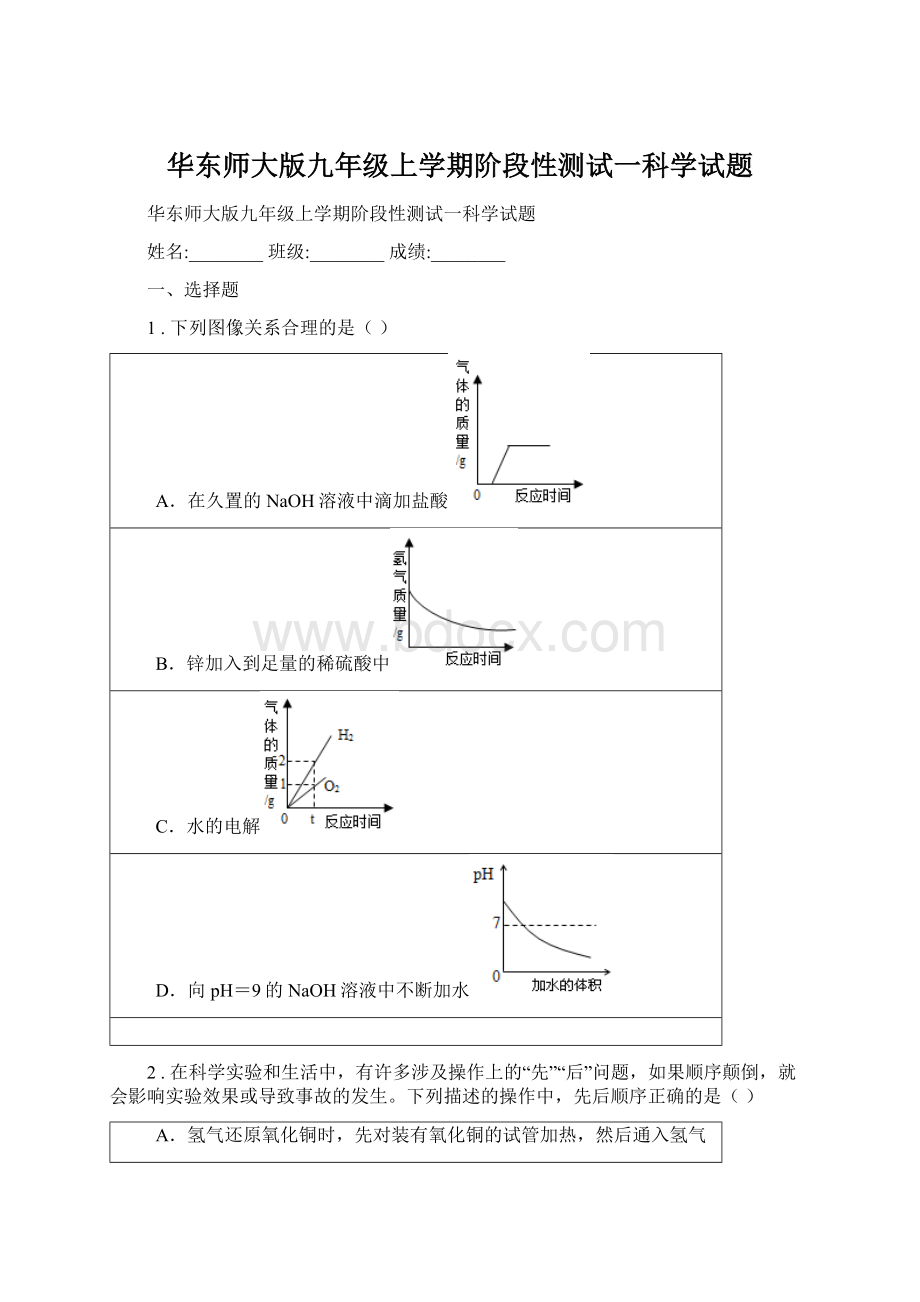
D.水在直流电的作用下,与电源负极相连的玻璃管内产生氢气,与电源正极相连的玻璃管内产生氧气
4.下列图象不能正确反应其对应操作中各量变化关系的是()
①
②
③
④
A.①表示某铁丝在氧气中完全燃烧后,固体质量随时间的变化,(M2-M1)表示反应的O2的质量
B.②表示向某稀硫酸中滴入适量的氯化钡溶液,溶液的H+个数的变化曲线
C.③表示向一部分变质的氢氧化钠溶液中逐滴加入稀盐酸至过量,溶液质量的变化曲线
D.④表示酵母菌在代谢过程中CO2产生速率与O2浓度之间的关系
5.正确规范的操作是实验成功的关键。
下列实验操作符合规范的是()
A.
辨别相线
B.
读液体体积
C.
高倍物镜下调焦
D.
检验气密性
6.酸碱(中和)反应在工农业生产和日常生活中有广泛的用途.下列应用一定与酸碱反应原理无关的是()
A.石灰浆抹的墙壁变得坚硬
B.稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒
C.施用熟石灰改良酸性土壤
D.用NaOH溶液洗涤石油产品中残余硫酸
7.天平两边各放质量相等的烧杯,分别装入等质量,等溶质质量分数的稀硫酸,此时天平平衡,将等质量的MgCO3和Na2CO3分别加入两烧杯中,充分反应后,下列说法错误的是
A.若天平不平衡,指针一定偏向加Na2CO3的一边
B.若天平平衡,两烧杯中的酸一定完全反应
C.若反应后Na2CO3有剩余,天平一定平衡
D.若天平不平衡,两种碳酸盐一定都没有剩余
8.长期食用“地沟油”可能会引发癌症。
以下都是辨别“地沟油”的简易方法,其中一定涉及化学变化的是()
A.看油是否透明
B.听油燃烧时是否有劈啪声
C.闻油是否有异味
D.降温看油是否更易凝固
9.氢氧化铯是一种可溶性碱,其化学式CsOH,则下列叙述中不正确的是()
A.CsOH溶液能与CO2反应
B.CsOH溶液能使酚酞溶液变红
C.CsOH溶液与硫酸反应生成的盐的化学式为CsSO4
D.CsOH在水中能电离出Cs+、OH-
10.氢氧化钴[Co(OH)2]受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:
①Co+2HCl=CoCl2+H2↑②CoCl2+2NaOH=Co(OH)2↓+2NaCl下列说法正确的是()
A.钴与金属铜的化学性质相同
B.氢氧化钴难溶于水
C.氢氧化钴的化学性质稳定
D.氢氧化钴可用于干燥氯化氢气体
11.长期食用“地沟油”可能会引发癌症。
以下都是辨别“地沟油”的简易方法,其中利用化学性质进行辨别的是
B.闻油是否有异味
C.听油燃烧时是否有劈啪声
12.下列属于置换反应的是
13.下列实验过程与图象相符的是()
一定温度下,向饱和的石灰水中加入氧化钙固体
向等量的镁、锌固体中加入足量的稀硫酸
向稀盐酸中加入过量的氢氧化钠溶液
向盐酸和氯化镁混合溶液中加入过量的氢氧化钠溶液
14.善于归纳知识,有利于培养素质.下列对部分化学知识点的归纳完全正确的一组是()
①碱的水溶液显碱性,但显碱性的不一定是碱的溶液;
②用pH试纸测得苹果汁的pH为3.2;
③用洗洁精清洗油污利用乳化功能;
④稀盐酸、稀硫酸化学性质相似是因为它们的溶液中都有氢离子;
⑤打开浓盐酸瓶盖有白烟;
⑥浓硫酸不慎沾在皮肤上,要用大量水冲洗,再涂上硼酸溶液.
⑦生成盐和水的反应一定是中和反应.
A.①③④
B.①③⑤⑥
C.①③④⑦
D.①②③④
15.在烧杯中分别盛放相等质量的下列物质,暴露在空气中一段时间后,质量增加、溶质质量分数减小的是()
A.浓盐酸
B.浓硫酸
C.氯化钠溶液
D.浓硝酸
二、填空题
16.现有含碳酸钠的食盐样品,课外活动小组的同学称取10g该食盐样品于烧杯中,并将40g稀盐酸平均分成四次加入烧杯中,实验数据见表:
实验序号
加入稀盐酸的质量(g)
反应后烧杯中剩余物质的质量(g)
第一次
10
19.12
第二次
28.24
第三次
37.8
第四次
m
(1)表中第四次实验的m值为___。
(2)产生CO2气体的总质量为__________g。
(3)求使用的稀盐酸的溶质质量分数。
__________
(4)求第四次实验后,溶液中氯化钠的溶质质量分数。
_________(计算结果精确到0.1%)
17.家庭厨房用量最多的碳酸盐是______,用量最多的盐酸盐是____;
食醋的主要成分是_______;
锅炉水垢的主要成分是________,可用_______除去。
18.从稀盐酸、硫酸铜、食盐、石灰石等物质中选出适当的物质,将其物质名称填入空格内:
可用作建筑材料的是
;
可用于清除金属表面锈层的是
可做食品调味剂的是
可用于配制波尔多液的是
。
19.生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_____________;
发生反应的方程式为________________________________;
反应一段时间后,又观察到的现象是__________________________,发生反应的方程式为_____________________。
20.用已知溶质质量分数的溶液可以测定未知溶液的质量分数,实验室有一瓶标签模糊的稀盐酸,某同学为了测定其溶质质量分数,进行了如下实验。
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴入几滴紫色石蕊试液(质量忽略不计),重新称量;
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量,数据如下表:
锥形瓶
锥形瓶+稀盐酸
锥形瓶+反应后溶液
质量(克)
35.5
55.5
80.5
(1)若要配制500克16%的氢氧化钠溶液,需要氢氧化钠固体________克;
(2)该瓶稀盐酸的溶质质量分数为________;
(3)另有同学做了同样实验,却得到了不同的结果,于是用精密pH试纸测得反应后锥形瓶内溶液的pH为8.2,则他测出的盐酸溶质质量分数_______(选填“偏大”或“偏小”),造成这一偏差的原因是_______。
21.有下列几种物质:
a:
盐酸;
b:
熟石灰;
c:
纯碱;
d:
食盐;
e:
烧碱,请选择合适的标号+填空。
(1)用来清除铁锈的物质_______;
(2)用来配制农药波尔多液的是_____;
(3)在日常生活中用作调味剂的是___;
(4)精制石油时用来中和过量酸的是___;
(5)做馒头时用于除去面团发酵生成的酸的是_______。
22.A~F均为初中所学的物质,其中属于碱的是B、C,属于盐的是D、E,其中D是钠盐;
胃酸中含有F能帮助消化,A是食品包装袋中常用的干燥剂。
其物质间的转化关系如图所示。
图中“—”表示两端的物质能发生反应;
“→”表示物质间存在的转化关系,其余反应条件、部分反应物和生成物均已略去。
试回答:
(1)A的俗称是______________。
(2)图中的相互关系中没有涉及的基本反应类型是__________________。
(3)写出标号②的化学反应方程式:
______________________
23.如图,A、B、C、D、E各代表铁.水.二氧化碳.硫酸铜溶液.氢氧化钡溶液中的一种物质。
常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。
请填空:
(1)写出下列物质的化学式:
B_______,D______。
(2)相连环物质间发生的反应,没有涉及的基本反应类型是________。
24.大理石是含杂质的碳酸钙,因具有美丽花纹面被广泛用于建筑物外墙、内壁的贴面和地面铺设。
某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。
(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(杂质不参加反应),产生的气体用含有碱性物的吸收装置充分吸收,分液漏斗中所加液体不选用硫酸,理由是________。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克,实验后,根据实验数据绘了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。
请综合分析曲线a、b,计算出实验中反用盐酸的溶质质量分数。
________(结果精确到0.1%)
(3)计算后,该同学对上述实验进行了反思,他认为分液漏斗中用的盐酸浓度偏大,会对实验结果造成较大影响。
其原因是________。
25.工业生产中,可用盐酸清洗钢铁表面的致密氧化层。
为了提高酸洗液的浓度或温度以加快反应,可在酸洗液中加入()
A.食盐
B.生石灰
C.固体氢氧化钠
D.浓硫酸
26.有A、B、C、D四种物质的稀溶液,已知它们分别是K2CO3、BaCl2、HCl、AgNO3中的某一种溶液。
如图为常温时上述溶液两两混合的部分实验现象,其中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象。
(1)请判断A物质是______。
(2)请用“↓”“↑”或“-”将图中②处的实验现象表示出来:
___。
(3)请写出B与D反应生成的沉淀的化学式:
_____。
27.小明打扫卫生时发现地砖上的铁锈(主要成分Fe203)用水很难清洗,决定运用所学知识解决这一难题,他进行了如下活动:
①通过测试pH,寻找除锈剂,结果如下表:
物品
食用醋
洗洁精
油污净
洁厕灵
pH
3
13
1
②将少量洁厕灵倒在地砖的锈斑上,进行擦拭冲洗,铁锈很快被清除;
③查阅资料得知,“洁厕灵”主要成分是一些酸和多种其它物质组成的混合物。
根据上述材料,请回答:
(1)铁锈在水中的溶解性为________________(填“易溶”、“可溶”或“难溶”);
(2)上述物品中,酸性最强的是__________________;
(3)如果洁厕灵中某酸的化学式为HR