备战高考化学与化学反应与能量变化有关的压轴题含答案Word下载.docx
《备战高考化学与化学反应与能量变化有关的压轴题含答案Word下载.docx》由会员分享,可在线阅读,更多相关《备战高考化学与化学反应与能量变化有关的压轴题含答案Word下载.docx(21页珍藏版)》请在冰豆网上搜索。
【分析】
根据元素在周期表的位置可得,X为H元素,Y为N元素,Z为O元素,W为Na元素,R为S元素,T为Cl元素,据此分析解答;
【详解】
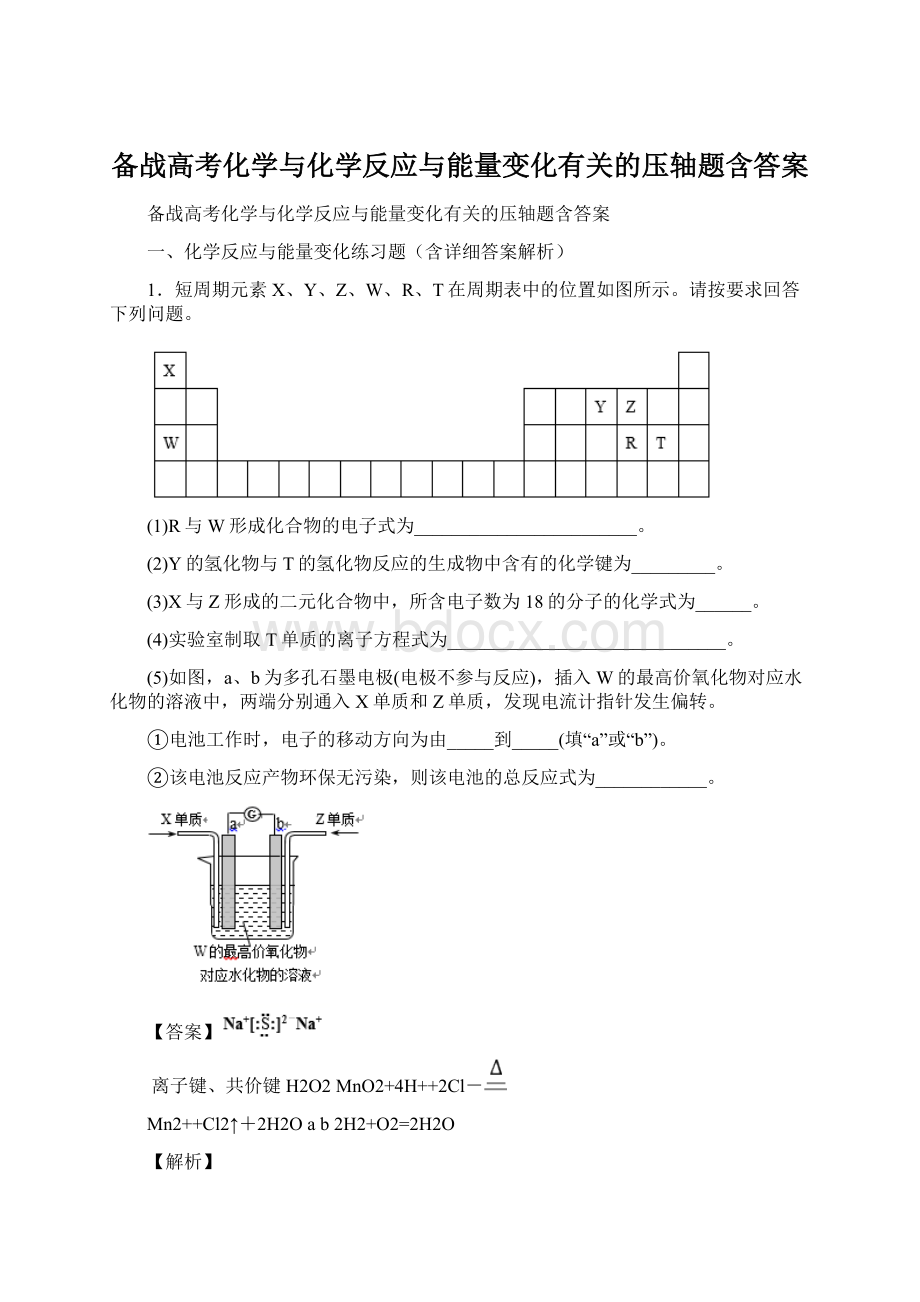
(1)R为S元素,W为Na元素,R与W形成化合物为Na2S,电子式为
;
(2)Y为N元素,T为Cl元素,Y的氢化物与T的氢化物分别为NH3和HCl,反应的生成物为NH4Cl,属于含有共价键的离子化合物,其中含有的化学键为离子键、共价键;
(3)X为H元素,Z为O元素,X与Z形成的二元化合物为H2O、H2O2,所含电子数为18的分子的化学式为H2O;
(4)T为Cl元素,实验室用二氧化锰和浓盐酸在加热的条件下制取氯气,的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(5)W为Na元素,W的最高价氧化物对应水化物的溶液为氢氧化钠溶液,两端分别通入H2和O2,发现电流计指针发生偏转,说明该装置构成氢氧燃料电池。
①电池工作时,通入燃料的一极为负极,则如图所示,a为负极,b为正极,电流从正极流向负极,则电子由a到b;
②装置构成氢氧燃料电池,电池反应产物只有水,环保无污染,则该电池的总反应式为2H2+O2=2H2O。
2.铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。
工作时该电池总反应式为:
Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l)。
根据上述情况判断:
(1)放电时,电解质溶液的pH________(填“增大”“减小”或“不变”)。
(2)放电时,电解质溶液中阴离子移向_____极,电子从_____极流向____极。
(3)写出负极的电极方程式:
_____________________________________。
【答案】增大负负正Pb-2e-+SO42-=PbSO4
放电时,负极发生氧化反应,Pb失去电子产生Pb2+,Pb2+与溶液中的SO42-结合形成PbSO4,反应消耗硫酸,硫酸的浓度减小,负极得到PbSO4,正极上PbO2获得电子变为Pb2+,Pb2+与溶液中的SO42-结合形成PbSO4,电子由负极经外电路流向正极,由此分析解答。
(1)该电池总反应式为:
Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l)。
根据工作原理可知:
在放电时Pb发生氧化反应,失去电子变为Pb2+,电极反应式为Pb-2e-=Pb2+;
正极上PbO2获得电子变为Pb2+,电极反应式为:
PbO2+4H++SO42-=PbSO4+2H2O,反应消耗硫酸,使硫酸的浓度减小,溶液中c(H+)降低,所以溶液的pH增大;
(2)放电时,由于负极不断产生Pb2+,使正电荷数目增大,所以电解质溶液中阴离子SO42-移向负极,电子从负极Pb极流向正极PbO2极;
(3)负极失去电子,发生氧化反应,负极的电极反应式:
Pb+SO42--2e-=PbSO4。
【点睛】
本题考查了原电池工作原理,要会根据电池反应及元素化合价变化判断电池的正负极,并书写正负极电极反应式。
注意:
负极上生成难溶性的硫酸铅导致负极质量增加,正极上也产生难溶性的硫酸铅导致正极质量也增加,而溶液的酸性会减弱。
3.有A、B、C、D四种金属片,进行如下实验:
①A、B用导线连接后浸入稀H2SO4中,电流由B
导线
A;
②C、D用导线相连后,同时伸入稀H2SO4溶液中,C极为负极;
③A、C相连后同时浸入稀H2SO4中,C极产生大量气泡;
④B、D相连后同时浸入稀H2SO4中,D极发生氧化反应;
试判断四种金属的活动顺序是()
A.A>C>D>BB.A>B>C>DC.B>A>C>DD.B>D>C>A
【答案】A
①A、B用导线连接后浸入稀H2SO4中,电流由B
A,A为负极,B为正极,金属性A>
B
②C、D用导线相连后,同时伸入稀H2SO4溶液中,C极为负极,D极为正极,则金属性C>
D;
③A、C相连后同时浸入稀H2SO4中,C极产生大量气泡,C为正极,A为负极,则金属性A>
C;
④B、D相连后同时浸入稀H2SO4中,D极发生氧化反应,D为负极,B为正极,则金属性D>
B;
综上分析:
金属性:
A>C>D>B;
答案选A。
原电池中活泼的电极做负极,不活泼的做正极,利用电极的活性来判断电极金属性的强弱,判断原电池正负极的方法:
1、根据两极材料判断。
一般活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极;
2、根据电极现象判断。
一般情况下电极逐渐溶解为负极,电极增重可放出气体的为正极;
3、根据电子流动方向来判断。
电子流出的为负极、电子流入的为正极或电流流出的正极、电流流入的负极;
4、根据原电池里电解质溶液内离子的定向移动方向判断。
阴离子流向的为负极、阳离子流向的为正极;
5、根据原电池两极发生的变化来判断。
失去电子发生氧化的是负极、得到电子发生还原反应是正极;
4.请根据化学反应与热能的有关知识,填写下列空白:
(1)在Ba(OH)2·
8H2O和NH4Cl晶体反应的演示实验中:
反应物混合后需用玻璃棒迅速搅拌,其目的是____________,体现该反应为吸热反应的现象是烧杯变凉和________。
(2)下列过程中不一定释放能量的是____(请填编号)。
A.形成化学键B.燃料燃烧C.化合反应D.葡萄糖在体内的氧化反应
E.酸碱中和F.炸药爆炸
(3)已知:
通常条件下,酸碱稀溶液中和生成1mol水放出的热量为中和热。
稀溶液中1molH2SO4和NaOH恰好反应时放出QkJ热量,则其中和热为____kJ/mol。
(4)已知H2和O2反应放热,且断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ,由此可以推知下列关正确的是___(填编号)。
A.Q1+Q2>
Q3B.Q1+Q2>
2Q3C.2Q1+Q2<
4Q3D.2Q1+Q2<
2Q3
【答案】搅拌,使反应物充分接触促进反应玻璃片上水结冰而与烧杯粘在一起C
C
(1)通过玻璃棒的搅拌可使混合物充分接触而促进反应进行;
烧杯和玻璃片之间的水结冰会将二者粘在一起;
(2)形成化学键释放能量,燃烧放热、有些化合反应是吸热反应,如碳和二氧化碳反应制一氧化碳,大多数分解反应是吸热反应,氧化反应、酸碱中和、炸药爆炸都是放热反应;
(3)依据中和热的概念是强酸、强碱的稀溶液完全反应生成1mol水和可溶性盐放出的热量进行分析;
(4)根据旧键断裂吸收的能量减去新键生成释放的能量的差值即为反应热,结合燃烧反应为放热反应分析解答。
(1)固体参加的反应,搅拌可使反应混合物充分接触而促进反应进行,通过玻璃片上水结冰而与烧杯粘在一起,知道氢氧化钡晶体和氯化铵之间的反应是吸热反应;
(2)形成化学键、燃料的燃烧、葡萄糖在体内的氧化反应、酸碱中和反应和炸药的爆炸过程都属于放热反应,而化合反应不一定为放热反应,如CO2与C在高温下反应产生CO的反应属于吸热反应,所以不一定释放能量的为化合反应,故合理选项是C;
(3)在稀溶液中1molH2SO4与NaOH溶液恰好完全反应时生成2molH2O,放出QkJ热量,而中和热是指强酸、强碱在稀溶液中发生中和反应生成可溶性盐和1mol水时放出的热量,故H2SO4与NaOH反应的中和热为:
kJ/mol;
(4)1molH2O中含2molH-O键,断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ,则形成1molO-H键放出Q3kJ热量,对于反应H2(g)+
O2(g)=H2O(g),断开1molH-H键和
molO=O键所吸收的能量(Q1+
Q2)kJ,生成2molH-O新键释放的能量2Q3kJ,由于该反应是放热反应,所以2Q3-(Q1+
Q2)>
0,2Q1+Q2<
4Q3,故合理选项是C。
本题考查了化学反应与能量变化,注意掌握中和热的概念,反应热为断裂反应物化学键吸收的总能量与形成生成物化学键释放的总能量的差,(4)1molH2O中含2molH-O键为解答易错点。
5.
(1)选择适宜的材料和试剂设计一个原电池,完成下列反应:
Zn+CuSO4=ZnSO4+Cu。
①画出装置图:
___。
②电极材料和电解质溶液各是什么___。
?
③写出电极反应式:
负极:
___;
正极:
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气___L(标准状况下)。
导线中通过___mol电子。
负极:
锌片、正极:
铜片;
CuSO4溶液Zn–2e-=Zn2+Cu2++2e-=Cu1.12L0.1
(1)利用反应Zn+CuSO4=ZnSO4+Cu设计原电池,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如铜等,也可以是碳棒,电解质溶液应为CuSO4,根据原电池原理写出电极反应式。
(2)根据锌和氢气之间转移电子数目相等计算。
(1)①利用反应Zn+CuSO4=ZnSO4+Cu设计原电池,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如铜等,也可以是碳棒,电解质溶液应为CuSO4,设计的原电池装置为:
②根据以上设计可知,负极为锌片,正极为铜片,电解质溶液为CuSO4溶液;
③原电池中负极活泼金属失电子发生氧化反应,电极反应为:
Zn–2e-=Zn2+,正极为溶液中的阳离子得到电子发生还原反应,CuSO4溶液中的阳离子有Cu2+和H+,放电能力Cu2+大于H+,正极反应为:
,Cu2++2e-=Cu;
(2)用锌片、铜片连接后浸入稀硫酸溶液中构成的原电池中,负极:
Zn–2e-=Zn2+,正极:
2H++2e-=H2↑,由电极反应n(H2)=n(Zn)=
,V(H2)=0.05mol⨯22.4L/mol=1.12L,n(e-)=2n(Zn)=2⨯0.05mol=0.1mol。
原电池中负极材料一般为活泼金属,失去电子发生氧化反应,负极由于消耗而减少,正极一般是溶液中的阳离子得到电子发生还原反应,放电能力强的阳离子发生反应,正极上的现象一般为产生气体或质量增加。
6.电化学在化学工业中有着广泛应用。
根据图示电化学装置,
(1)甲池通入乙烷(C2H6)一极的电极反应式为___。
(2)乙池中